L’endomètre est la muqueuse qui tapisse l’intérieur de la cavité utérine.Le cancer de l’endomètre est aussi appelé cancer du corps de l’utérus et il ne doit pas être confondu avec le cancer du col utérin car les causes et les caractéristiques épidémiologiques de ces deux cancers sont différentes. Le cancer du col est un cancer de la femme jeune associé à une infection génitale par un virus transmis sexuellement, l’HPV (Human Papilloma Virus) alors que le cancer de l’endomètre se voit plutôt chez des femmes ménopausées ou en période per-ménopausique et est un cancer hormonodépendant. Il est favorisé par l’obésité et l’hyperplasie de l’endomètre.
Les signes de découverte
Le signe d’alerte essentiel du cancer du corps utérin est un saignement (métrorragie) se manifestant le plus souvent en période post-ménopausique ou en dehors de la période des règles lorsque la patiente n’est pas encore ménopausée. Cependant, il est parfois sous-estimé par la patiente, soit parce que la perte sanglante est minime, soit par négligence. Tout saignement survenant après la ménopause doit conduire à consulter son médecin et à pratiquer un certain nombre d’examens à la recherche d’une lésion endométriale.
D’autres signes révélateurs sont possibles: leucorrhées (hydrorrhée, leucopyorrhée ou pyorrhée) accompagnées généralement de pertes sanguines leur donnant
alors une coloration rosée, ou des signes de diffusion d’une infection endomètriale tels qu’une
paramétrite douloureuse, des cystites, etc.
Il n’existe pas de dépistage du cancer de l’endomètre.
Le diagnostic
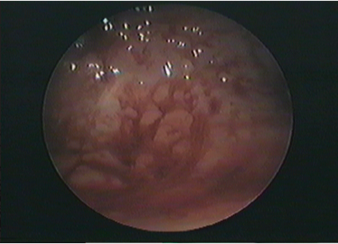
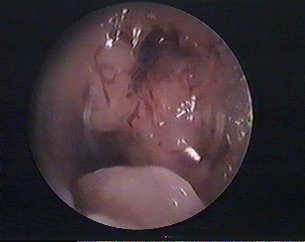
L’échographie peut montrer un endomètre anormalement épaissi (>4mm), mais le diagnostic repose sur un prélèvement histologique qui peut être fait lors d’une consultation (type pipelle de Cornier = pipette aspirant des éléments contenus dans la cavité utérine). Si le résultat de ce prélèvement est négatif, il faut réaliser des biospsies sous hystéroscopie diagnostique. Cet examen se fait sans anesthésie générale et consiste, à l’aide d’un “câble” optique à voir l’intérieur de l’utérus et à faire des biopsies au niveau de zones anormales. Parfois, ces prélèvements sont impossibles car l’orifice du col de l’utérus est fermé. Il faut alors endormir la patiente pour réaliser une hystéroscopie après dilatation du col.
L’analyse anatomopathologique de la biopsie permet :
– de confirmer la malignité ;
– de définir le type histologique :
• type 1 (les plus fréquents) : adénocarcinomes endométrioïdes (90% des cancers de l’endomètre);
• type 2 (de moins bon pronostic) : adénocarcinomes à cellules claires, papillaires, séreux, mucineux, squameux et carcinosarcomes ;
– et pour les types histologiques 1, d’évaluer le grade de 1 à 3. (le grade 1 le plus différencié et de meilleur pronostic).
Bilan d’extension
Une fois le diagnostic fait, il est indispensable de faire un bilan de l’extension du cancer et de juger de certains facteurs pronostics en vue de planifier un traitement adapté.
Outre l’examen gynécologique et l’échographie pelvienne, l’examen principal est l’IRM abdomino-pelvienne (très supérieure au scaner dans cette indication). l’IRM permet au mieux d’évaluer le volume tumoral, la profondeur de l’infiltration myométriale, d’une extension ou non vers le col utérin, d’une atteinte ovarienne de l’atteinte ganglionnaire pelvienne et lombo-aortique (IRM de diffusion). Le scanner abdominopelvien associé à l’échographie pelvienne n’est indiqué qu’en cas de contre-indication à l’IRM . La TEP-FDG/TDM peut être discutée en cas de suspicion d’extension régionale (stades III/T3 et/ou N1 ou IV/T4 et/ou M1). Parfois échographie hépatique en cas d’extension régionale.
On complète par une radio pulmonaire et le bilan pré-anesthésique.
Il n’existe pas de marqueur tumoral spécifique du cancer de l’endomètre.
Cependant, pour évaluer la réponse au traitement, le dosage initial du CA 125 peut être discuté en cas de suspicion d’extension régionale (stade III/T3 et/ou N1 ou plus), d’atteinte ovarienne ou de type 2 histologique.
La classification des cancers de l’endomètre
Muni du résultat histologique et des données de l’IRM, on peut classifier ce cancer.
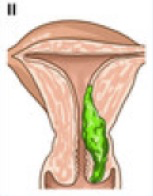
Stade 0 ou Tis : cancer in situ
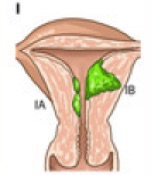
Stades I
Tumeur limitée au corps utérin
– Ia Tumeur limitée à l’endomètre ou ne dépassant pas la moitié du myomètre
Ib Tumeur envahissant la moitié du myomètre ou plus de la moitié du myomètre
Stades II
Tumeur envahissant le stroma cervical mais ne s’étendant pas au delà de l’utérus
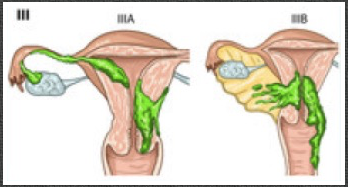
Stades III
Extension locale et/ou régionale
– IIIA Séreuse et/ou annexes
– IIIB Envahissement vaginal et/ou paramétrial
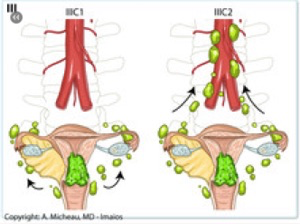
– IIIC Atteinte des ganglions lymphatiques régionaux
– IIIC1 Ganglions pelviens
IIIC2 Ganglions para-aortiques +/- ganglions pelviens
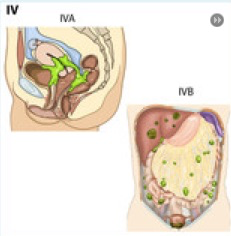
Stades IV
Extension à la muqueuse vésicale et/ou intestinale et/ou métastases à distance
– IVA Extension à la muqueuse vésicale et/ou intestinale
IVB Métastases à distance incluant les métastases intra-abdominales et/ou ganglions inguinaux
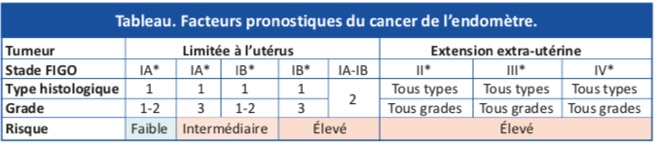
Cette classification qui est «anatomique» est affinée par les autres facteurs de risque. Ainsi on distingue en particulier pour les stade I:
Stade I:
-Types 1 histologique:
-Risque bas: T1a de grade 1 ou 2
-Risque intermédiaire: T1a grade 3 et T1b grade 1 ou 2
-Risque élevé: T1b grade 3
-Types 2 histologiques (risque élevé):
-Carcinomes à cellules claires ou papillaires séreux
-Carcinosarcomes
Les facteurs pronostic sont donc: le stade, le type histologique, le degré de différenciation (grade histologique), l’âge (pronostic meilleur avant 60 ans), l’opérabilité, l’envahissement ganglionnaire, la cytologie péritonéale positive et l’infiltration du myomètre (que l’on retrouve dans le stade), la présence d’embols vasculaires, la densité en récepteurs hormonaux. Un index de DNA>1,5 et l’aneuploïdie sont des facteurs de mauvais pronostic. L’atteinte du col n’est pas un facteur pronostic.
Les méthodes de traitement
La chirurgie
Elle repose sur l’hystérectomie totale avec annexectomie bilatérale par voie abdominale ou vaginale. Elle est suffisante pour les petites tumeurs. Sinon c’est une hystérectomie élargie qui résèque les paramètre + une collerette vaginale, et +/- lymphadénectomie iliaque et parfois lombo-aortique.
Autres interventions palliatives : colostomie, urétérostomie de décharge…
La radiothérapie
La curiethérapie vaginale permet de limiter les rechutes au niveau du dôme vaginal qu’elle soit faite en pré ou en post-opératoire. Radiothérapie externe permet de limiter les rechutes pelviennes. Les deux méthodes sont utilisées principalement en post opératoire pour réduire le risque de rechute locorégionale.
-Radiothérapie externe:
Accélérateur linéaire d’énergie de 15 MeV ou plus.
Volume cible : col, utérus, 2/3 supérieur du vagin, paramètres et ganglions iliaques irradiation lombo-aortique discutée (efficacité et complications).
Organes critiques : face antérieure du rectum, face postérieure de la vessie, sigmoïde, grêle, tête fémorale.
Champs d’irradiation : 4 champs, 2 latéraux et 2 antéropostérieurs.
Dose : 1,8 Gy × 5/semaine.
Tous les champs traités le même jour.
45 Gy sur tout le pelvis, 70 Gy si radiothérapie exclusive, le complément à partir de 45 Gy se fait par des champs réduits.
-Curiethérapie
Elle peut se faire en pré ou post opératoire. L’intérêt de la curiethérapie pré-opératoire est d’obtenir une fonte tumorale, la dose utilisée est de 20 à 30 Gy en trois ou quatre séances. En post opératoire, il s’agit de diminuer les rechute au niveau de la cicatrice vaginale. Elle utilise un moule personnalisé ou un applicateur standard. Deux ou trois sources d’iridium 192 ou de Cesium 137 y sont placées. Le temps d’application dépend de la dosimétrie prévisionnelle.
La chimiothérapie
Actuellement la chimiothérapie n’a pas d’intérêt en terme de survie en néo-adjuvant. Elle permet une fonte tumorale mais ne permet pas de diminuer le taux de rechute locale ou métastatique. Elle est principalement utilisée chez les femmes métastatiques pouvant supporter ce type de traitement. Le protocole le plus utilisé est le protocole CEP (Cisplatine, Endoxan, Epirubicine).
L’hormonothérapie
repose sur les progestatifs (Farlutal®, Prodasone®). Les taux de réponse sont faibles mais la tolérance est bonne.
Protocoles thérapeutiques
Pour les stade I (opérables):
-Bas risque: Hystérectomie totale avec annexectomie bilatérale. Une lymphadénectomie n’est pas recommandée. Une curiethérapie postopératoire à haut débit de dose n’est pas recommandée sauf en cas de stade IA grade 2 avec envahissement massif du 1/3 interne du myomètre où elle peut être envisagée. La radiothérapie externe n’est pas recommandée. Le traitement conservateur de l’utérus n’est pas recommandé mais peut être discuté pour des patientes désirant une grossesse, présentant des tumeurs supposées de stade I, grade 1 sans envahissement myométrial, au mieux après exploration coelioscopique des ovaires pour éliminer une extension extra- utérine ou de la séreuse. Sous les mêmes réserves, le traitement conservateur des ovaires associé à une hystérectomie totale avec salpingectomie bilatérale peut être discuté pour les patientes de moins de 40 ans désirant le maintien des fonctions ovariennes. Une chimiothérapie intraveineuse adjuvante n’est pas recommandée.
-Risque intermédiaire: Une hystérectomie totale avec salpingo-ovariectomie bilatérale est recommandée. La lymphadénectomie pelvienne n’est pas recommandée. Elle peut cependant être envisagée en cas de stade IA grade 3 et IB grade 2. Elle est possible sous la forme de recherche de ganglion sentinelle dans le cadre de protocole de recherche. Pas de reprise chirurgicale pour lymphadénectomie pelvienne si non fait de première intention pour grade 2 et à rediscuter en RCP pour les grades 3. Une curiethérapie postopératoire à haut débit de dose est recommandée. La radiothérapie externe n’est pas recommandée. Une chimiothérapie intraveineuse adjuvante n’est pas recommandée.
-Haut risque: Une hystérectomie totale avec salpingo-ovariectomie bilatérale est recommandée. Une lymphadénectomie lomboaortique et iliaque commune est recommandée. Dans ce contexte, la chirurgie endoscopique est recommandée si possible par voie extrapéritonéale en raison de la
réduction du risque adhérentiel. La lymphadénectomie pelvienne n’est pas recommandée. En cas de découverte de facteurs de risque élevé sur la pièce d’hystérectomie, une reprise de
stadification ganglionnaire et/ou péritonéale, de préférence coelioscopique, est recommandée. Une radiothérapie externe pelvienne conformationnelle (45 Gy) postopératoire est recommandée. Une curiethérapie vaginale de surimpression est proposée. Une chimiothérapie intraveineuse adjuvante n’est pas recommandée hors essai clinique .
-Haut risque de type 2 histologique:
-En cas de papillaires séreux: Une hystérectomie totale avec salpingo-ovariectomie bilatérale, une lymphadénectomie pelvienne et lomboaortique, une omentectomie infracolique, une cytologie et biopsies péritonéales sont recommandées. Une radiothérapie externe pelvienne conformationnelle (45 Gy) postopératoire est recommandée. Une curiethérapie vaginale de surimpression est proposée. Une chimiothérapie intraveineuse adjuvante séquentielle est possible selon le shéma du RTOG ( 2 cures de cisplatine J1-J25 50 mg /m2 concommitant +4 carbo taxol adjuvant).
-En cas de carcinosarcome: Une hystérectomie totale avec salpingo-ovariectomie bilatérale, une lymphadénectomie pelvienne et lomboaortique et une cytologie et biopsies péritonéales sont recommandées. Une radiothérapie externe pelvienne conformationnelle (45 Gy) postopératoire est recommandée. Une chimiothérapie intraveineuse adjuvante séquentielle et une curiethérapie vaginale de surimpression peuvent être discutée en RCP de recours (spécifique des sarcomes).
Pour les stade II
Une hystérectomie avec salpingo-ovariectomie bilatérale est recommandée. L’hystérectomie sera simple ou élargie, avec ou sans colpectomie, en fonction des caractéristiques de
la tumeur avec objectif d’obtenir des marges saines. Une lymphadénectomie pelvienne est recommandée. Une lymphadénectomie lomboaortique d’emblée ou à la suite d’une lymphadénectomie pelvienne en cas de ganglions pelviens positifs peut être discutée en cas de type 1 histologique. En cas de type 2 histologique, une omentectomie infracolique, une lymphadénectomie pelvienne et
lomboartique, une cytologie et biopsies péritonéales doivent être réalisées. Une radiothérapie externe pelvienne conformationnelle (45 Gy) postopératoire associée à une curiethérapie vaginale postopératoire à haut débit de dose est recommandée. Une chimiothérapie intraveineuse adjuvante séquentielle peut être discutée en complément de la radiothérapie en RCP pour les grades 3 et types 2.
Pour les stade III:
-IIIA: atteinte de la séreuse et ou des annexes : Une hystérectomie totale avec salpingo-ovariectomie bilatérale, une omentectomie infragastrique, une lymphadénectomie pelvienne et lomboaortique et une cytologie péritonéale sont recommandées. En cas d’atteinte isolée de la séreuse, une radiothérapie externe pelvienne conformationnelle (45 Gy) postopératoire associée à une curiethérapie postopératoire à haut débit de dose sont recommandées. En cas d’atteinte cervicale, une curiethérapie postopératoire à haut débit de dose est recommandée. En cas d’atteinte annexielle, une chimiothérapie intraveineuse adjuvante séquentielle est recommandée.
–IIIB:atteinte vaginale et ou paramétriale:Le traitement par radiothérapie exclusive est privilégié. Une stadification ganglionnaire lomboaortique préthérapeutique peut être discutée. Une radiothérapie externe pelvienne conformationnelle (45 Gy) suivie d’une curiethérapie utéro- vaginale (15 Gy) est recommandée. Une chimiothérapie intraveineuse concomitante est proposée par analogie au cancer du col de l’utérus. Une chirurgie de la tumeur primaire doit être discutée en cas de réponse incomplète.
-IIIC: atteinte ganglionnaire histologique :
-Si le stade IIIC (N1 TNM) est défini sur la base d’une lymphadénectomie pelvienne, une lymphadénectomie lomboaortique immédiate ou différée est recommandée selon l’état de la patiente et les possibilités chirurgicales.
-Si découverte histopathologique après stadification complète (pelvienne et lomboaortique), une radiothérapie externe conformationnelle (45 Gy), postopératoire (pelvienne au stade IIIC1 (N1 TNM), pelvienne et lomboaortique au stade IIIC2 (N1 TNM)), suivie d’une curiethérapie à haut débit de dose, sont recommandées.
-Une chimiothérapie intraveineuse adjuvante séquentielle doit être discutée.
-C1 atteinte ganglionnaire pelvienne à l’imagerie : Il s’agit d’une discussion RCP. Un traitement chirurgical premier comportant une hystérectomie totale avec salpingoovariectomie
bilatérale, une exérèse ganglionnaire pelvienne et un curage lomboaortique à visée thérapeutique si
faisable est recommandé. Une radiothérapie externe pelvienne conformationnelle (45 Gy) suivie d’une curiethérapie vaginale sont recommandées. Une chimiothérapie intraveineuse adjuvante séquentielle peut être discutée.
-C2 atteinte ganglionnaire lomboaortique +/- pelvienne à l’imagerie: Une radiothérapie externe pelvienne et lomboaortique conformationnelle (45 Gy) suivie d’une surimpression ganglionnaire et d’une curiethérapie utéro-vaginale sont recommandées. Si les conditions sont favorables pour une chirurgie, un traitement chirurgical premier, comportant une hystérectomie totale avec salpingo-ovariectomie bilatérale et une lymphadénectomie pelvienne et lomboaortique à visée thérapeutique, est recommandé. Une radiothérapie externe pelvienne et lomboaortique conformationnelle (45 Gy) et une curiethérapie vaginale postopératoires sont recommandées. Une chimiothérapie intraveineuse séquentielle doit être discutée. Soit il est aussi possible de proposer une chimiothérapie première , suivie de la chirurgie, et avec une radiothérapie de clôture.
Pour les stade IV
-IVA: atteintes vésicales ou intestinales: Une radiothérapie externe pelvienne conformationnelle (45 Gy) suivie d’une curiethérapie sont recommandées. Une chimiothérapie intraveineuse concomitante doit être discutée par analogie au cancer du col de l’utérus. Une exentération pelvienne à visée curative peut être discutée en cas d’échec de l’irradiation si NO sur imagerie.
-IVB: atteintes intra-abdominales y compris les ganglions inguinaux :Une chirurgie de cytoréduction complète à visée curative identique à celle réalisée dans le cancer de l’ovaire est recommandée uniquement en cas de carcinose péritonéale résécable sans métastase à distance. Une chimiothérapie intraveineuse est recommandée. Une hormonothérapie est recommandée en cas de récepteurs hormonaux positifs ou de maladie lentement évolutive. Une radiothérapie externe conformationnelle sur la tumeur primitive est recommandée selon la localisation des lésions.
En cas de stade IVB défini par une atteinte inguinale isolée, une adénectomie complémentaire du
traitement adaptée à l’extension locorégionale est recommandée si possible ou sinon une radiothérapie
inguino-crurale. Soit il est aussi possible de proposer une chimiothérapie première , suivie de la chirurgie, et avec une radiothérapie de clôture
5- En cas de pyométrie: pas de chirurgie première. Pas d’hystéroscopie. Drainage et antibiothérapie.
Dans la mesure du possible, obtenir une histologie par une biopsie d’endomètre. Chirurgie première selon le stade après régression du syndrome infectieux.
6- En cas de récidive: Il s’agit d’un tournant dans l’évolution de la maladie car il constitue un événement de très mauvais pronostic en terme de survie.
Le diagnostic est fait sur l’histologie ou sur une suspicion iconographique. Le bilan comporte un examen sous anesthésie et un bilan d’extension comportant une radiographie pulmonaire et/ou TDM thoracique, ou une IRM thoraco-abdomino-pelvienne. Un TEP est souvent proposé devant une récidive locale isolée.
L’attitude médicale est fonction du terrain, de l’extension et de la localisation de la récidive, des antécédents d’irradiation, et des souhaits de la patiente.
-Récidives locorégionales: l’attitude est différente selon le siège de la récidive :
-Vaginale isolée :
-Patientes précédemment irradiées :
-Récidive en territoire traité : colpectomie ;
-Récidive en territoire non traité (1/3 inférieur du vagin) : curiethérapie +/- colpectomie de rattrapage.
-Patientes non irradiées :Radiothérapie pelvienne (45 Gy) puis réévaluation : régression objective : curiethérapie. Pas de régression objective : colpectomie.
L’ordre des traitements dépend du volume et de la localisation de la récidive.
-Pelviennes, centro ou latéropelviennes :Le caractère très péjoratif de ces récidives doit faire discuter les indications chirurgicales avec discernement. Néanmoins une chirurgie d’exérèse, lorsqu’elle est possible, pourra être proposée dans un premier temps.
-Patientes précédemment irradiées :Hormonothérapie et/ou chimiothérapie ;
Radiothérapie pelvienne (45 Gy) +/- complément dans la zone de récidive, si antécédent de curiethérapie seule.
-Patientes non irradiées : Chirurgie si possible.Chimiothérapie / radiothérapie.
-Métastases: Quel que soit le traitement proposé, l’efficacité est modeste :Traitement symptomatique ; Corticothérapie.;Hormonothérapie : prodasone ou farlutal (400mg en continu) ; Chimiothérapie éventuellement : carboplatine – novantrone – endoxan.
7-Pour les sarcomes de l’endomètre et du myomètre:
-Si diagnostic histologique connu en pré-opératoire :
-En l’absence de métastases: Colpohystérectomie +/- adénectomie si ganglion(s) palpable(s) ;
Radiothérapie pelvienne (50Gy). La curiethérapie vaginale n’a pas prouvé totalement son intérêt, elle reste optionnelle en fonction des habitudes des équipes. Chimiothérapie adjuvante en cas d’envahissement ganglionnaire et/ou d’emboles lymphatiques.
-En présence de métastases (le bilan doit comporter un scanner thoracique) : Hystérectomie avec annexectomie bilatérale ;Chimiothérapie.
-Si diagnostic connu sur une pièce opératoire : Le bilan doit comporter un TDM thoracique et abdominopelvien :
-TDM négative : radiothérapie pelvienne et curiethérapie ;
-TDM pelvienne positive : radiothérapie pelvienne + curiethérapie + chimiothérapie ; TDM pelvienne et lombo-aortique positive : idem métastases.
La surveillance après traitement
La surveillance est essentiellement clinique. La réalisation de frottis vaginaux n’a pas fait la preuve de son efficacité. On ne réalise pas d’imagerie systématique chez les patientes traitées, en rémission complète et non symptomatiques.
Dès qu’il existe une symptomatologie, l’IRM est le meilleur examen permettant de faire la part entre anomalies post-thérapeutiques et nouvelle évolution tumorale.
Type de surveillance : elle repose sur l’examen clinique général et gynécologique (recherche de récidive du fond vaginal ou de la région sous-urétrale) :
La surveillance doit être réalisée :
– tous les 4 à 6 mois, durant les 3 premières années, puis annuellement pour les stades I et II,
– tous les 4 à 6 mois, durant les 5 premières années puis annuellement, pour les stades III et IV.
Comme toute patiente traitée pour un cancer, il est souhaitable :
– de vérifier la mise à jour de ses vaccinations;
– d’aider la patiente à éviter les drogues, le cannabis et le tabac;
– d’aider la patiente à poursuivre ou à débuter une activité physique selon son état général
– d’aider la patiente à acquérir une alimentation selon les recommandations nationales
Des consultations spécialisées dans les services qui prennent en charge ces patientes doivent pouvoir leur être proposées.
Pour les femmes âgées de 50 à 74 ans, la participation aux programmes nationaux de dépistage organisé du cancer du côlon et du cancer du sein doit être encouragée.
Si elle n’a pas été réalisée avant, la recherche d’une instabilité des microsatellites au niveau tumoral est recommandée pour identifier un syndrome HNPCC/Lynch chez toutes les patientes présentant un cancer de l’endomètre avant 50 ans ou quel que soit l’âge chez une patiente dont un apparenté au premier degré a été atteint d’un cancer colorectal ou du « spectre HNPCC » (endomètre, intestin grêle, urothélium, voies biliaires, estomac, ovaire). En cas de syndrome HNPCC avéré, des recommandations sur les indications de surveillance et de chirurgie prophylactique sont disponibles sur le site Internet de l’INCa.
Il n’y a pas de contre-indication à un traitement hormonal substitutif uniquement oestrogénique chez les femmes de moins de 50 ans qui peut être proposé au titre du traitement de la ménopause secondaire à l’ovariectomie bilatérale. Après 50 ans, les indications et contre-indications sont les mêmes que dans la population générale.
En conclusion,
on retiendra que le cancer de l’endomètre est plutôt un cancer de bon pronostic. Souvent découvert précocement lors d’un bilan de saignement utérin chez une femme ménopausée, la tumeur est très fréquemment accessible à un traitement chirurgical curatif.