I-De quoi s’agit-il?
Les incompatibilités sanguines érythrocytairesfœto-maternelles résultent de l’élaboration par la mère d’anticorps capables de traverser la barrière placentaire et de se fixer sur les globules rouges fœtaux provoquant leur destruction. Cela se produit lorsque le fœtus a hérité de son père des antigènes de groupe sanguin que sa mère ne possède pas et contre lesquels elle synthétise des anticorps.
Les antigènes de groupes sanguins sont des structures présentes à la surface des globules rouges. Il en existe une centaine. Une trentaine d’entre eux est susceptible de provoquer l’élaboration d’anticorps. Ces anticorps sont le plus souvent dirigés contre les antigènes des systèmes rhésus et ABO.
L’incompatibilité rhésus est la plus grave mais depuis que sa prévention existe, elle devient de plus en plus rare, laissant le devant de la scène aux incompatibilités ABO.
II-Le système Rhésus
Le système rhésus est constitué par une famille d’antigènes de surface génétiquement transmis et dont les caractères antigéniques se développent très tôt au cours de la vie embryonnaire.
Ces antigènes résultent de la combinaison de trois paires de gènes: C ou c, D ou d et E ou e.
L’antigène D étant le plus fortement immunogène, et du fait qu’il n’existe pas d’anticorps anti-d, c’est l’absence d’antigène D qui définit le groupe rhésus négatif, et c’est la production d’anticorps anti-D par les femmes rhésus négatifs qui est responsable de l’incompatibilité rhésus.
Sujets Rh+: CDe, cDE, cDe,CDE
Sujets Rh-: Cde, cdE, cde, CdE
III-Mécanisme de l’allo-immunisation anti D
Pour qu’une allo-immunisation anti-D puisse se produire, il faut qu’apparaissent des antigènes D dans la circulation d’une femme rhésus négatif afin qu’elle élabore des anticorps anti-D. Seules les femmes rhésus négatif sont donc concernées ; seuls les fœtus rhésus positifs seront menacés.
A-Situations permettant l’allo-immunisation
Très peu d’hématies Rh positif sont capables de provoquer une immunisation chez une femme Rh négatif (à partir de 0.25 ml de sang). Ce passage d’hématies étrangères peut se produire dans les circonstances suivantes :
— transfusion de sang hétéro-rhésus ;
— toute effraction vasculaire au niveau de la chambre intervilleuse placentaire au cours d’une grossesse dont l’embryon ou le fœtus est rhésus positif. Une telle effraction permettant le passage de sang fœtal dans la circulation maternelle peut se produire à l’occasion d’un banal accouchement, d’une fausse couche spontanée ou provoquée, d’une grossesse extra-utérine, d’un hématome rétro-placentaire, d’hémorragies sur placenta bas inséré, d’un cerclage, d’une amniocentèse, d’une ponction de sang fœtal ou d’une biopsie de trophoblaste, d’une version par manœuvres externes, d’une chute ou de tout accident de la voie publique chez une femme enceinte Rh négatif, d’une mort fœtale in utero.
B-facteurs influençant la réponse immunitaire de la femme
L’élaboration des anticorps anti-D par la femme n’est pas obligatoire en présence d’antigènes D et lorsqu’elle existe, l’intensité de la réponse antigénique dépend de divers facteurs. La gravité de l’atteinte fœtale ultérieure dépend en partie de l’importance de cette réaction immunitaire.
1-Le volume de sang transfusé
Si le volume de sang Rh+ qui est passé dans la circulation maternelle est inférieur à 0,25 ml, il ne se produit pas d’immunisation.
2-La capacité de réponse à une stimulation antagonique
Toutes les femmes rhésus négatif ne sont pas capables de s’immuniser. Près d’un tiers d’entre elles n’élaborent pas d’anticorps anti-D, même en présence d’une quantité importante de sang Rh positif.
3-Le temps
Il faut plusieurs semaines à plusieurs mois pour que l’organisme de la mère élabore les anticorps anti-D après l’introduction des hématies Rh négatif. Ce délai doit être mis à profit pour empêcher l’immunisation par l’injection de gamma globulines anti-D.
4-La compatibilité dans le système ABO
Le risque d’immunisation est 10 fois moindre si la mère et l’enfant sont incompatibles dans le système ABO que s’ils sont compatibles.
5-La parité
Le risque d’immunisation est maximum lors de la 2e et de la 3e grossesse. Il diminue ensuite.
C-L’allo-immunisatin est définitive
Une fois immunisée la mère conserve des anticorps pendant de nombreuses années. En présence d’une nouvelle grossesse incompatible, il se produit une réascension des anticorps, parfois brutale et intense. La rapidité de cette ascension secondaire conditionne le pronostic fœtal.
IV-Conséquences foetales
L’allo-immunisation anti-D maternelle est susceptible de provoquer une hémolyse chez le fœtus.
A-Mécanisme de l’atteinte foetale
1-LLes anticorps anti-D
Les anticorps anti-D élaborés par la mère sont des IgG.
La gravité de l’atteinte fœtale dépend notamment de la concentration en anticorps dans le sang maternel :
— pour une concentration inférieure à 1 microg/ml, il n’y a pas de risque vital pour le fœtus avant 34 semaines d’aménorrhée. Au-delà, le risque n’existe que pour des concentrations comprises entre 0,7 et 1 microg/ml ;
— au-dessus de 1microg/ml, le risque fœtal est proportionnel à la concentration.
2-Le passage trans placentaire des anticorps anti D
Les IgG traversent la barrière placentaire. Il s’agit d’un phénomène actif qui dépend donc de la maturation placentaire. Ainsi, à 20 semaines, la concentration en anticorps chez le fœtus ne représente que le dixième de leur concentration chez la mère. Cela explique l’absence de mort fœtale au premier trimestre. Tout est par contre possible à partir du 2e trimestre dans les formes graves.
3-LL’affinité des anticorps
L’affinité des anticorps pour l’antigène D est variable d’une femme à l’autre ; or ce sont ceux qui se fixent sur les hématies D qui font la gravité de la maladie. Il est donc important de distinguer la concentration des anticorps dans le sang maternel ou fœtal de leur taux de fixation sur les hématies apprécié par le titrage (test de Combs indirect). Ainsi, une concentration faible (inférieure à 1 microg/ml) est rassurante même si le titre est élevé (supérieur à 1/16) ; un titre faible (1/4 par exemple) est également rassurant, même si la concentration est élevée (4 microg/ml par exemple). Cette association du dosage pondéral au titrage permet parfois de différer ou d’éviter les autres explorations plus invasives.
4-L’hémolyse foetale
La fixation des anticorps sur les antigènes érythrocytaires D forme un complexe immun qui va être attaqué par les macrophages du fœtus. L’hémolyse fœtale est le résultat d’une érythrophagocytose macrophagique qui se produit au niveau du foie et de la rate. Elle n’est possible que lorsque la maturité du système réticulo-endothélial est acquise, c’est-à-dire vers 17-18 semaines.
B-Conséquences chez le foetus
L’hémolyse provoque chez le fœtus :
— une anémie ;
— une hypertrophie du foie et de la rate ;
— une hyperbilirubinémie risquant de provoquer un ictère nucléaire ;
— une ascite aboutissant rapidement à un tableau d’anasarque fœto-placentaire ;
— puis une mort fœtale in utero en l’absence de traitement.
V-méthodes d’évaluation de la gravité de l’atteinte foetale
Du plus simple au plus sophistiqué, il existe plusieurs moyens de juger la gravité de l’état du fœtus.
A-L’interrogatoire
étudie l’issue des grossesses antérieures, sachant que, du fait des relances immunitaires éventuelles, la maladie fœtale a tendance à s’aggraver au cours des grossesses successives. Ainsi un antécédent d’anasarque ou de mort in utero est de très mauvais pronostic si l’enfant doit être rhésus positif.
B-Dosage pondéral et titrage des anticorps maternels
Les valeurs seuil sont de 1 microg/ml pour le dosage pondéral (0,7 microg/ml après 34 semaines) et de 1/16 pour le titrage.
Ces deux examens représentent la base de la surveillance. Ils permettent :
— de reconnaître les patientes dépourvues de risque ;
— de déterminer le moment de la grossesse où il faut envisager des explorations plus poussées : amniocentèse et ponction de sang fœtal.
C-Les échographies
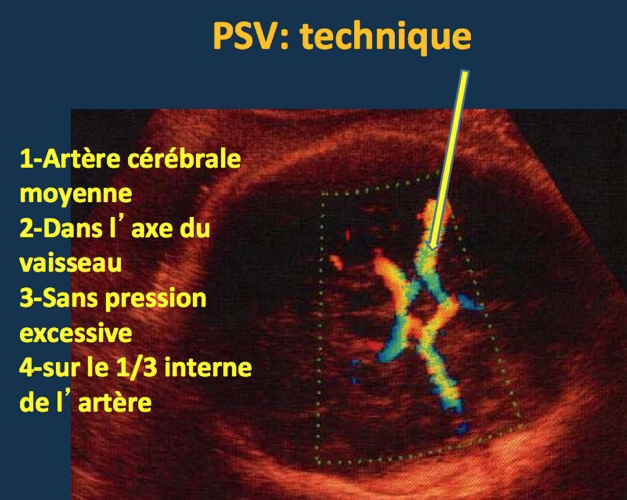
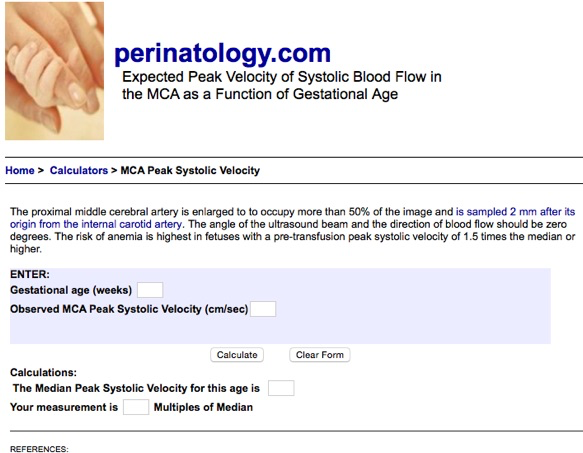
1-La mesure du PSV (Pic Systolique Vélocimétrique)
Il s’agit de mesurer par Doppler la vitesse maximum (pic systolique) observée au niveau de l’artère cérébrale moyenne. Le choix s’est porté sur l’artère cérébrale moyenne parce qu’elle répond rapidement à l’hypoxie en raison de la forte dépendance du cerveau envers l’oxygène et parce qu’il est relativement facile de la visualiser au Doppler et d’y appliquer un angle de tir proche de 0 degré.
La technique en est assez rigoureuse pour avoir des résultats fiables. Il faut d’obtenir une coupe axiale du cerveau passant par les thalami et le septum lucidum. Le Doppler permet de visualiser le polygone de Willis et l’on fait porter l’examen sur l’une des artères cérébrales moyennes près de son origine de la carotide interne. En effet, la vitesse systolique diminue lorsqu’on s’éloigne de l’origine du vaisseau.
L’angle formé par le tir Doppler et l’axe de l’artère doit être aussi près possible de 0 degré . En effet la vitesse appréciée du flux sanguin est inversement proportionnelle à l’angle α que forme le faisceau Doppler avec l’axe de l’artère, selon la formule :
V = Fc/2Fe.Cos α
Où F est la fréquence moyenne, c la célérité des ultrasons, α l’angle incident et Fe la fréquence émise.
La mesure du pic systolique nécessite donc une technique rigoureuse afin d’éviter d’obtenir des valeurs faussement inférieures à la réalité. L’orientation du Doppler doit être la plus près possible de l’axe du vaisseau. Tout écart par rapport à cet axe minimise la mesure de vitesse du flux. On remarquera qu’un tel écart ne change pas les rapports systole/diastole représentés par les index habituels D/S ou S-D/S, mais il modifie la valeur absolue de la systole, c’est-à-dire le pic systolique.
Il faut également éviter d’exercer une pression sur la tête foetale qui diminuerait également le pic systolique.
Au total, comme toutes les erreurs techniques répertoriées ci-dessus ne peuvent aboutir qu’à une diminution du pic systolique réel, il faut prendre plusieurs mesures et systématiquement retenir la plus élevée..
Enfin, il semble que la mesure au niveau d’une seule artère soit suffisante.
Les différentes publications sur le sujet retrouvent toutes une excellente corrélation entre la mesure de la PSV-ACM et le taux réel d’hémoglobine du fœtus.De plus la corrélation entre PSV et Hémoglobine est encore meilleure lorsque les taux d’hémoglobine deviennent bas (25).
La définition des valeurs normales et pathologiques a été au début un peu hésitante. Une étude de Texeira en 2000 a considéré les valeurs pathologiques au-delà de une déviation standard (1 DS). Une étude de Mari préférait parler en multiples d’erreur standard.
Dans une large étude multicentrique parue en 2000, Mari a finalement défini l’anémie fœtale comme étant modérée si l’hémoglobine est entre 0,65 et 0,55 fois la valeur médiane pour le stade de la grossesse et sévère si elle est moins de 0,55 fois la médiane. Il en résulte que le pic systolique de vélocimétrie (PSV) de l’artère cérébrale moyenne traduit une anémie qui commence à être moyenne à partir de 1,5 et sévère à 1,55 fois la valeur moyenne.
Si l’on considère la mesure du pic systolique du Doppler de l’artère cérébrale moyenne, en fonction de la sévérité de l’anémie, Mari rapporte le tableau suivant sur lequel les ronds clairs correspondent à des fœtus sans anémie ou avec anémie légère (c’est-à-dire >ou= à 0,65 MoM de la concentration d’hémoglobine), les triangles représentent les fœtus avec anémie modérée ou sévère (c’est-à-dire <0,65 MoM de l’hémoglobine) et les ronds noirs représentent les fœtus avec anasarque:
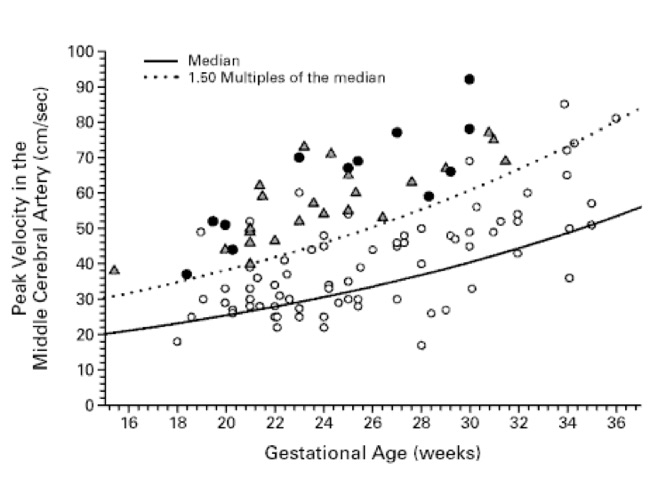
Le tableau ci–dessus montre bien que le risque d’anémie est élevé pour un pic systolique supérieur ou égal à 1,50 fois la médiane. En dessous de 1,50 il n’y a pas d’anémie ou minime. Il semble donc que l’on puisse retenir le seuil de 1,5MoM comme valeur seuil de anémies sévères indiquant le recours à l’exanguinotransfusion ou à l’extraction du fœtus.
Il semble admis qu’à partir du moment ou est diagnostiquée une anémie modérée, il faille répéter la mesure du PSV-ACM toutes les semaines, l’agravation de l’anémie pouvant se faire très rapidement.
La concordance entre la valeur du PSV et le multiple de la médiane peut être calculé automatiquement sue le site perinatalogy. com à l’adresse http://perinatology.com/calculators/MCA.htm
2-Les autres signes échographiques
sont plus tardifs . Ils sont basés sur les manifestations d’anasarque foetale. Épanchement péricardique, péritonéal ou pleural, excès de liquide amniotique, épaississement du placenta. L’anémie profonde, aux alentours de 2 grammes d’hémoglobine, est quasi-certaine en cas d’anasarque massive. En revanche, des anémies sévères peuvent être rencontrées en l’absence d’anasarque franche.
D-L’enregistrement du rythme cardiaque foetal
Dans les situations à haut risque d’anémie, il ne permet encore que de découvrir des signes tardifs, liés à l’anémie profonde comme le tracé sinusoïdal.
E-L’amniocentèse
Elle doit éviter de traverser le placenta afin de limiter le risque de réactivation immunitaire. 5ml de liquide amniotique non sanglant sont suffisants pour doser la bilirubine d’origine fœtale dans le liquide amniotique. Le tube de prélèvement doit être strictement conservé à l’abri de la lumière, entouré de coton cardé. L’étude spectrophotomètrique du liquide amniotique permet au niveau de la bande d’absorption de 450 millimicrons (indice optique 450) de déterminer le taux de bilirubinamnie amniotique. La méthode d’interprétation de Liley consiste à porter la valeur de bilirubiamnie à l’indice 450 sur un diagramme en cordonnées semi-logaritmiques. Les abcisses correspondent aux semaines d’aménorrhée de la grossesse. Le diagramme de Liley permet de reconnaître trois zones :
— une zone inférieure d’atteinte nulle où le fœtus ne court aucun danger. L’amniocentèse ne sera refaite que si l’on assiste à une nouvelle ascension des anticorps ou systématiquement un mois après ;
— une zone intermédiaire où une surveillance rapprochée s’impose, nécessitent la répétition des échographies et de l’amniocentèse toutes les deux semaines et si la bilirubinamnie augmente, il faut soit pratiquer une transfusion in utero soit déclencher l’accouchement ;
— une zone supérieure qui correspond à une hémolyse sévère et permet de craindre la mort fœtale dans un délai de 10 jours. La ponction de sang fœtal peut confirmer l’anémie. Si le fœtus est mature, il faut l’extraire ; s’il ne l’est pas, il faut le transfuser in utero.
Mais ce test est abandonné au profit du prélèvement de sang foetal qui est indiqué sur les résultat de la mesure du PSV.
F-Le prélèvement de sang foetal

C’est l’examen le plus précis, le seul capable de quantifier l’anémie du foetus. Cette procédure a été initiée dans les années 80 avec les travaux pionniers de Fernand Daffos.
Il n’est cependant pas anodin, comportant un risque fœtal (comme toute ponction de ce type) et un risque d’aggravation de l’immunisation maternelle. Il ne doit donc pas être utilisé au titre purement diagnostic de l’anémie. En pratique, il faut obtenir une suspicion suffisante d’anémie hémolytique sévère à l’aide des autres examens et réaliser la ponction de sang fœtal dans un but thérapeutique de transfusion in utero. Le dosage du taux d’hémoglobine fœtal est alors réalisé de manière extemporanée, confirmant l’anémie et appréciant sa gravité, alors que la transfusion est immédiatement entreprise.
VI-Conduite à tenir chez une femme enceinte immunisée
Une première orientation est donnée par le titre et la concentration des anticorps au premier trimestre de la grossesse.
Cas rassurants
Concentration inférieure à 1 microg/ml ou titre inférieur à 1/16. Il faut alors doser et titrer l’anticorps toutes les 2 à 3 semaines dès 4 mois de grossesse afin de dépister une réactivation de l’immunisation.
Si les chiffres restent identiques, on se contente d’une surveillance échographique régulière. Une amniocentèse peut être réalisée si la concentration se situe entre 0,7 et 1 microg/ml et si le titre est égal à 1/16.
Cas nécessitant une surveillance plus poussée
S’il apparaît une réactivation de l’immunité ou si d’emblée la concentration est supérieure à 1 microg/ml ou si le titrage est supérieur à 1/16, il faut titrer et doser l’anticorps toutes les 2 à 3 semaines dès trois mois de grossesse et tous les 15 jours au troisième trimestre.
— Pour une concentration entre 1 et 3 microg/ml, la surveillance échographique débute dès 24 semaines d’aménorrhée.
— Pour une concentration entre 3 et 8 microg/ml, les échographies sont réalisées dès 20 semaines d’aménorrhée. En l’absence d’anomalie, l’amniocentèse sera plus précoce, vers 20 à 24 semaines d’aménorrhée.
— Si la concentration est supérieure à 8 microg/ml, une ponction de sang fœtal en vue d’une transfusion in utero doit être envisagée dès 18-20 semaines d’aménorrhée en fonction également du PSV.
L’exanguinotransfusion in utero
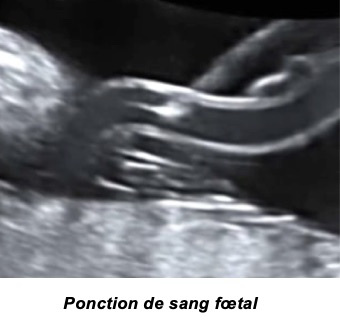
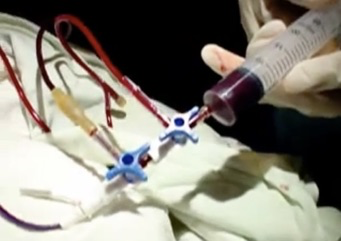
Le développement de la technique de l’abord vasculaire fœtal par la ponction d’une veine du cordon permet aujourd’hui de traiter le fœtus in utero en corrigeant son anémie, ce qui permet d’attendre sa maturité pour le faire naître.
La décision d’exsanguino-transfusion ne doit être prise qu’au cours de la ponction de sang fœtal, en fonction du taux d’hémoglobine.
— Lorsque l’hémoglobine est inférieure ou égale à 8 g %, il faut exsanguino-transfuser. De petits volumes de sang fœtal (2 à 15 ml de sang selon l’âge gestationnel qui peut aller de 18 à 34 semaines d’aménorrhée) sont alternativement soustraits et remplacés par du concentré érythrocytaire jusqu’à obtenir un taux d’hémoglobine de 15 à 18 g %.
— Lorsque l’hémoglobine fœtale est comprise entre 8 et 12 g % on peut décider soit de mettre en route le traitement soit de le reporter à une date ultérieure, le fœtus n’étant pas immédiatement menacé. La décision doit tenir compte des antécédents, du stade de la grossesse, de l’existence d’une augmentation récente et rapide des anticorps, de l’aspect du liquide amniotique et du risque lié à l’acte lui-même.
Toute allo-immunisation fœtale doit aujourd’hui pouvoir bénéficier de ce type de traitement. Il faut cependant insister sur le fait que la maladie étant devenue très rare grâce à la prévention par les immunoglobulines anti-D et l’exsanguino-transfusion étant un geste techniquement délicat nécessitant en bon entraînement, seuls de rares centres sont capables de la réaliser correctement. Les patientes pour lesquelles une telle indication est envisagée doivent leur être adressées.
Des complications restent possibles: hématome du cordon, section vasculaire, accouchement prématuré, infection, ovulaire.
Le renouvellement de l’exsanguino-transfusion in utero
Le délai entre deux apports successifs dépend du taux d’hémoglobine atteint lors de l’apport précédent, sachant que le taux d’hémoglobine va spontanément chuter de 1,5 à 2 g % par semaine.
Choix du moment de naissance
La naissance doit être provoquée, au plus tard au début du 9e mois, pas après, car la maturité fœtale est alors acquise et le risque d’aggravation brutale est possible pendant le 9e mois. Inversement, il faut tout faire pour ne faire naître l’enfant qu’après la 35e semaine d’aménorrhée ; ce but doit pouvoir être atteint grâce à une surveillance correcte de la grossesse et grâce aux exsanguino-transfusions, tout en dépistant soigneusement la survenue d’une souffrance fœtale. Selon les conditions obstétricales, on peut choisir entre une césarienne et un déclenchement du travail.
L’existence d’une souffrance fœtale aiguë dans un tableau d’anasarque fœto-placentaire impose une césarienne de sauvetage en urgence.
VII-Conséquences néonatales
UN RISQUE MAJEUR POUR LE NOUVEAU-NÉ : L’ICTÈRE NUCLÉAIRE
Le nouveau-né atteint a une anémie plus ou moins marquée, éventuellement un tableau d’anasarque avec ascite ethépatosplénomégalie et surtout risque de développer un ictère précoce et rapide. Dans sa forme grave, il réalise l’ictère nucléaire qui touche plus volontiers les prématurés et qui se caractérise par un syndrome neurologique particulier :
— hypertonie généralisé avec opisthotonos ;
— regard en «coucher de soleil» ( la partie inférieure de l’iris est cachée par la paupière inférieure) ;
— trémulations de la face et des membres, puis mouvements pseudo-athétosiques ;
— cri aigu ;
— troubles de la déglutition, de la respiration, de la régulation thermique précédant parfois la mort ;
— lorsque l’enfant survit, il risque de conserver de redoutables séquelles psychomotrices et sensorielles (surdité) qui en font un infirme-moteur-cérébral.
CONDUITE À TENIR EN PÉRIODE NÉONATALE
–Dès la naissance
Dès la naissance, le cordon doit être rapidement sectionné et du sang recueilli pour faire :
— le groupe et le facteur rhésus du nouveau-né ;
— un taux d’hémoglobine ;
— un taux de bilirubine ;
— un test de Coombs direct dont la positivité affirme l’atteinte fœtale.
Un transfert immédiat en réanimation s’impose si l’enfant est prématuré, s’il y a eu des signes de souffrance fœtale et s’il est porteur de signes cliniques (ascite…). Une exsanguino-transfusion va être réalisée en urgence.
–La surveillance pendant la première semaine
Une indication de transfusion précoce peut apparaître au vu des premiers résultats biologiques : hémoglobine inférieure à 13 g pour 100 ml, bilirubine totale supérieure à 50 mmol/l (30 mg/l), bilirubine intra-érythrocytaire inférieure ou égale à 100 mg/l de globules rouges (mais ce dernier examen n’est pas très répandu), voire la présence de la bilirubine non liée à l’albumine (à partir de 1 mg/l) qui est celle qui est dangereuse pour le système nerveux du fœtus.
Dans les autres cas, l’examen clinique étant normal, la surveillance porte :
— sur la clinique : apparition d’un ictère, d’une anémie, d’une hépatosplénomégalie ;
— sur les paramètres biologiques, essentiellement la bilirubine libre. Le taux de bilirubine doit être interprété en fonction du poids et de l’âge du nouveau-né. Plus l’enfant est jeune et de petit poids, moins il faut s’approcher des valeurs limites qui sont pour des enfants de poids normal
– 100 mg à la 24è heure ;
-130 mg à la 48è heure ;
-150 mg au 3è jour ;
-180 mg à partir du 5è jour.
Une hypoprotidémie doit faire poser l’indication de transfusion pour des chiffres plus faibles. Il faut veiller à ne pas se laisser surprendre, chez des enfants non exsanguino-transfusés dès la naissance par une augmentation brutale de la bilirubine au 3e-4e jour ou par la constitution insidieuse d’une anémie au cours des 15 premiers jours.
En l’absence d’indication à l’exsanguino-transfusion, la photothérapie constitue un traitement d’appoint contribuant à réduire des taux modérés de bilirubine.
–L’exanguinotransfusion
L’exsanguino-transfusion est en fait le seul traitement de la maladie hémolytique du nouveau-né.
Elle a pour buts :
— de remplacer les hématies de l’enfant porteuses d’anticorps par des hématies normales ;
— d’éliminer les anticorps circulants ;
— d’épurer la bilirubine.
Elle est réalisée par la veine ombilicale à l’aide d’un robinet à trois voies permettant la soustraction de sang fœtal puis la réinjection de quantités successives de 5 à 15 ml de sang d’un donneur Rh négatif non immunisé. Le volume de sang utilisé est en général de 2 à 3 fois la masse sanguine du nouveau-né.
VIII-La prévention de l’ico-immunisation Rhésus
La prévention repose sur l’injection à la femme d’une dose d’immunoglobuines anti-Rh destinées à détruire les éventuelles hématies de groue Rh+ qui auraient pu passer ou pourraient passer dans sa circulation. C’est-à-dire soit après l’acouchement, soit dans des situations à risque (comme un avortement, métrorragies, fausse couche spontanée, interruption de grossesse, grossesse extra-utérine, cerclage, traumatisme abdominal, amniocentèse ou autre prélèvement ovulaire, version par manoeuvres externes, etc.) soit plus récemment à titre préventif au cours de la grossesse vers le 6ème mois.
A-Position du problème
On estime le nombre de grossesses conçues chaque année en France à 1 à 1,1 million, incluant les naissances vivantes (794 000 en 2004), les fausses couches spontanées, les grossesses extra-utérines, les interruptions médicales et volontaires de grossesse. Environ 15 % de la population française étant de groupe RhD négatif, on peut évaluer à 150 000 à 165 000 le nombre de femmes RhD négatif enceintes chaque année. La fréquence du gène RhD étant de 0,6 dans la population française, le nombre annuel des femmes RhD négatif avec foetus RhD positif serait de l’ordre 90 000 (75 000 au-delà de 28 SA).
La prévalence des incompatibilités RhD résiduelles est de 0,9 pour mille, concernant donc 730 à 750 femmes par an en France. Il n’existe pas en France de registre national exhaustif des allo-immunisations anti-D ni de leurs formes graves. Les données parcellaires dont nous disposons permettent d’évaluer à quelques dizaines par an le nombre de décès périnatals liés à ce type d’allo-immunisation.
Environ les trois quarts de ces allo-immunisations anti-D restantes surviennent au décours de l’accouchement, d’une IVG, de fausses couches spontanées ou de GEU, du fait d’une prévention oubliée ou inadaptée. On estime qu’environ 1/4 des allo-immunisations anti-D surviennent actuellement au décours d’une hémorragie foeto-maternelle sans facteur de risque identifiable, surtout au 3e trimestre, et risquent donc d’échapper à une prévention ciblée. En effet, un passage « spontané » d’hématies foetales dans la circulation maternelle survient dans 4 % des cas au premier trimestre, 12 % au 2e trimestre, 45 % au 3e trimestre.
La prévention ciblée seule actuellement pratiquée en France a permis une réduction par un facteur 6 à 10 des allo-immunisations anti-D (d’environ 6 à 10 pour mille à environ 1 pour mille naissances vivantes) en 30 ans, toutes gravités confondues.
Il est néanmoins établi qu’une allo-immunisation résiduelle peut survenir au cours ou au décours de la grossesse malgré cette prévention. Pour cette raison, certains préconisent d’ajouter à cette prévention ciblée seule une prévention systématique au début du troisième trimestre (prévention systématique et ciblée).
Dans tous les cas, une injection d’immunoglobulines est effectuée en cas de situation à risque d’immunisation aux premier et deuxième trimestres et après l’accouchement d’un enfant RhD positif.
Ces deux politiques de prévention au cours de la grossesse ont été évaluées en termes d’incidence d’immunisations anti-D : l’incidence d’immunisation est de 0,8 % à 2,2 % avec une prévention « ciblée seule » contre 0,1 % à 0,7 % avec une prévention « systématique et ciblée ». Ainsi, l’application d’un protocole « systématique et ciblé » permet une réduction de l’immunisation de 60 à 80 % par rapport à une prévention « ciblée seule ». Les doses reconnues comme efficaces pour cette prévention systématique sont de 300 µg en une injection à 28 SA ou 2 injections de 100 µg à 28 et 34 SA.
La prévention ciblée seule actuellement pratiquée en France a permis une réduction par un facteur 6 à 10 des allo-immunisations anti-D (d’environ 6 à 10 pour mille à environ 1 pour mille naissances vivantes) en 30 ans, toutes gravités confondues.
Il est néanmoins établi qu’une allo-immunisation résiduelle peut survenir au cours ou au décours de la grossesse malgré cette prévention. Pour cette raison, certains préconisent d’ajouter à cette prévention ciblée seule une prévention systématique au début du troisième trimestre (prévention systématique et ciblée).
Dans tous les cas, une injection d’immunoglobulines est effectuée en cas de situation à risque d’immunisation aux premier et deuxième trimestres et après l’accouchement d’un enfant RhD positif.
Ces deux politiques de prévention au cours de la grossesse ont été évaluées en termes d’incidence d’immunisations anti-D : l’incidence d’immunisation est de 0,8 % à 2,2 % avec une prévention « ciblée seule » contre 0,1 % à 0,7 % avec une prévention « systématique et ciblée ». Ainsi, l’application d’un protocole « systématique et ciblé » permet une réduction de l’immunisation de 60 à 80 % par rapport à une prévention « ciblée seule ». Les doses reconnues comme efficaces pour cette prévention systématique sont de 300 µg en une injection à 28 SA ou 2 injections de 100 µg à 28 et 34 SA.
Quel que soit le protocole utilisé, il persiste des échecs de la prévention.
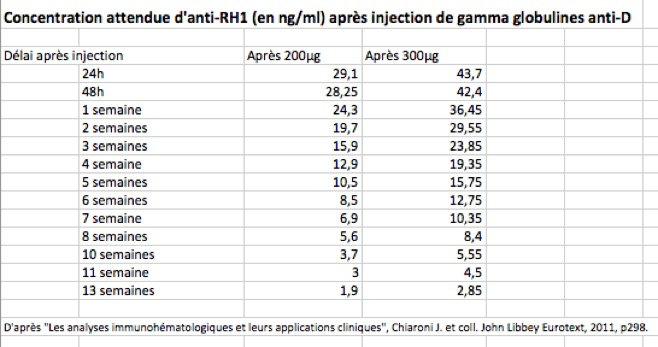
Comment?
La prévention de l’allo-immunisation rhésus ne se conçoit que chez des femmes non encore immunisées mais se trouvant en situation de le devenir. Elle consiste à empêcher la réaction d’immunisation en détruisant les hématies fœtales qui ont pu passer dans la circulation maternelle avant que la réaction immunitaire n’ait eu le temps de se produire. On utilise pour cela des immunoglobulines anti-D, utilisables par voie intraveineuse ou intramusculaire. Elles sont préparées par les centres de transfusion sanguine à partir de plasma de sujets Rh négatif fortement immunisés.
Quand?
L’injection d’immunoglobulines anti-D doit être réalisée chez toute femme rhésus négatif n’ayant pas jusque-là développé d’immunisation rhésus, au décours de toutes les situations risquant de provoquer un passage d’hématies rhésus positif dans son organisme : accouchement d’un enfant rhésus positif, avortement, grossesse extra-utérine, cerclage, métrorragies gravidiques, etc…
Toutes ces situations ont été décrites plus haut.
Si l’injection est faite en cours de grossesse, il faut la renouveler toutes les 6 à 8 semaines jusqu’à l’accouchement.
Après l’accouchement
L’injection d’immunoglobulines doit être faite dans les 72 heures qui suivent l’accouchement ou n’importe laquelle des situations à risques précédemment citées. En cas d’oubli, il ne faut pas hésiter à les administrer quand même, au-delà de 72 heures, car il s’écoule en général plusieurs semaines à plusieurs mois entre le moment de l’introduction de l’antigène rhésus chez la mère et l’apparition dans son sérum d’anticorps anti-D.
La prophylaxie par IgRh ne concerne que les femmes non immunisées qui accouchent d’enfant RhD positif.
Certaines patientes pouvant poser un problème décisionnel sont les suivantes :
les patientes ayant eu une ou plusieurs injections anténatales d’IgRh. Il n’y a pas lieu de s’abstenir sauf si on est en mesure de satisfaire 3 conditions : injection récente datant de moins de 3 semaines pour 200 µg, un test de Kleihauer négatif et une concentration d’anti-D passif supérieure à 6 ng/ml ;
les patientes dont le sérum contient un anti-D faible actif seulement sur hématies-test traitées par protéases. L’abstention est possible si cet anti-D témoigne d’une immunisation authentifiée et régulièrement décelée pendant la grossesse ;
les patientes considérées comme étant Rh négatif mais qui sont découvertes comme étant RhD faible au moment de l’accouchement. Il est possible de ne pas appliquer d’immunoprophylaxie si un nouvel échantillon de sang maternel vient confirmer ce Rh D faible dans le délai de 72 h après l’accouchement ;
les patientes connues comme RhD partiel : l’immunoprophylaxie est à proposer sauf si le nouveau-né RhD positif a le même sérotype D partiel que sa mère ;
les patientes dont le sérum contient un anti-G (pseudo-anti-D+C) doivent recevoir une immunoprophylaxie anti-D si le nouveau-né est Rhésus D positif (RH :1).
Dose standard utilisée
La dose standard utilisée est suivant les pays de 100 à 300 µg d’IgRh. En France, la dose disponible actuellement est de 200 µg (il est recommandé d’utiliser cette dose sans la fractionner) à compléter éventuellement selon le résultat du test de quantification des hématies fœtales.
Bilan biologique préalable à la prévention
Il comprend chez l’enfant le groupe Rhésus, et, chez la mère, une RAI et un test de Kleihauer.
Le groupe rhésus de l’enfant
Il s’impose dans tous les cas même en cas de génotypage fœtal RhD préalable et il permet d’éviter, si l’Ag D est absent, l’administration d’IgRh à la mère. Le phénotypage RhD peut aussi être réalisé sur le sang de cordon dès lors que l’échantillon a été convenablement prélevé (placenta in situ, par ponction de la veine ombilicale, en évitant surtout une ponction après délivrance, en particulier au niveau de la plaque choriale), avec un étiquetage « sang de cordon » associé à l’étiquette maternelle.
NB : Le test direct à l’antiglobuline chez le nouveau-né RH :1 peut-être positif dans 5 à 15 % des cas, suite à l’application d’une prophylaxie systématique du 3e trimestre. Il s’agit d’une positivité faible et sans conséquence (anémie) chez le nouveau-né.
Chez la mère : une RAI et un test de Kleihauer
La RAI : la présence d’antiD passifs n’est pas en soi un critère d’abstention d’immunoprophylaxie rhésus. Seul le dosage des anti-D peut éventuellement l’autoriser.
QUELLE QUANTITÉ ?
On considère que 20 microg d’immunoglobulines anti-D provoquent la disparition d’1 ml d’hématies rhésus positif chez la mère.
Au cours d’un accouchement, dans près de 99 % des cas, le volume d’hématies fœtales passant dans la circulation maternelle est inférieur à 2.5 ml. La dose d’immunoglobulines faite en routine et qui est de 85 ou 100 microg est donc presque toujours suffisante. Il en est de même de la plupart des situations remontrées au cours de la grossesse.
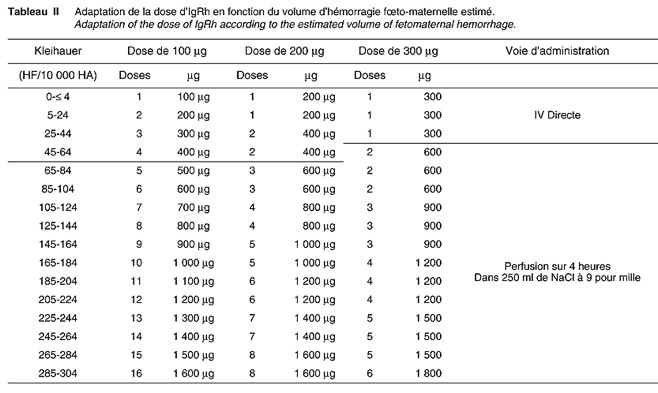
Certains cas rares nécessitent cependant des doses plus importantes et il est prudent de définir la posologie à l’aide du test de Kleihauer. Pour prendre l’exemple le plus courant de l’accouchement, ce test, effectué sur un frottis de sang maternel prélevé après la délivrance, permet de compter les hématies fœtales par rapport aux hématies maternelles. On considère qu’une hématie fœtale pour 10 000 hématies maternelles correspond à 0.5 ml de sang fœtal présent chez la mère. Si le test de Kleihauner est négatif ou positif jusqu’à 5 hématies fœtales pour 10 000 hématies maternelles, la dose habituelle de 100 micro g est suffisante. Au delà il faut appliquer la formule :
100 + (nombre d’hématies fœtales x 5) = nombre de micro g à injecter.
En cas de doute sur l’efficacité il est possible de contrôler la négativation du test de Kleihauer 24 à 48 heures après l’injection de gammaglobulines.
IX-Le génotype Rh sur sang maternel
Le génotypage foetal RhD sur sang maternel a une très bonne sensibilité au-delà de 10 SA, excellente au-delà de 15 SA. En cas de RhD foetal négatif, il est proposé pour l’instant de valider ce premier résultat par un deuxième prélèvement maternel quelques semaines plus tard. En cas de RhD foetal positif, le résultat peut être considéré comme acquis.
L’utilisation systématique du génotypage foetal chez les femmes RhD négatif dont le conjoint est RhD positif permettrait d’éviter les injections d’immunoglobulines anti-D, qu’elles soient d’indication ciblée ou systématique. Environ un tiers des femmes RhD négatif étant enceintes d’enfants eux-mêmes RhD négatif, le nombre d’injections d’immunoglobulines pourrait être diminué d’autant, sans diminution d’efficacité de la prévention.
En France, plusieurs laboratoires spécialisés disposent d’une technique validée de génotypage foetal sur sang maternel. Les éléments qui freinent encore son utilisation à large échelle sont l’absence de standardisation des techniques, l’absence de kit commercial pour la diffusion en dehors de centres très spécialisés et enfin l’absence de remboursement du test. Il apparaît urgent que le génotypage RhD foetal soit inscrit à la nomenclature des actes de biologie médicale.
Dans le cas particulier d’une amniocentèse (ou d’une biopsie de trophoblaste) dans le cadre d’un diagnostic prénatal chez une femme RhD négatif, l’abstention d’immunoprophylaxie est licite en cas de génotype foetal RhD négatif. Le génotypage foetal sur sang maternel étant alors réalisé précocement (avant 12-15 SA en général), la vérification du génotype foetal RhD sur liquide amniotique ou villosités choriales dans les 72 heures suivant le geste permet alors de conforter l’abstention de prévention.
X-RECOMMENDATIONS ACTUELLE (Source: Collège National des Gynécologues Obstétriciens Français)
I. Mesures générales au cours de la grossesse
Une double détermination de groupe sanguin RhD et une recherche d’agglutinines irrégulières (RAI) doivent êtres obtenues dès le premier trimestre de la grossesse chez toutes les femmes.
Si la femme est RhD négatif :
Une information doit être délivrée sur l’immunisation anti-D : dépistage, suivi, prévention. À cette occasion, le groupe RhD du conjoint est à documenter.
Si la femme n’est pas immunisée contre l’antigène D, un contrôle de RAI doit être réalisé au cours du 6e mois de grossesse, idéalement entre 26 et 28 semaines d’aménorrhée.
Lorsqu’une indication d’immunoprophylaxie se présente :
Si le conjoint est RhD négatif et la paternité certaine : la prophylaxie anti-D peut être évitée.
Si le conjoint est RhD positif ou inconnu : la prophylaxie anti-D doit être proposée.
Une information est alors donnée à la patiente et son consentement doit être systématiquement obtenu avant toute administration d’immunoglobulines anti-D.
Avant toute décision d’administrer des immunoglobulines anti-D, on s’assurera de l’absence d’immunisation anti-D par une RAI de moins d’une semaine. Dans les situations d’urgence, le résultat ne doit pas être attendu pour réaliser l’injection.
Lorsque le génotypage foetal RhD sur sang maternel peut être réalisé, il est recommandé de l’appliquer afin de limiter la prophylaxie Rh aux seules femmes enceintes d’enfant RhD positif.
L’efficacité de l’immunoprophylaxie repose sur une posologie d’anti-D adaptée (voir plus loin) et sur l’injection des immunoglobulines dans les 72 heures après un événement potentiellement immunisant. Au-delà, un bénéfice peut être espéré jusqu’à 30 jours.
Lorsque la galénique des immunoglobulines anti-D autorise la voie IM ou la voie IV, la voie intraveineuse sera toujours préférée pour la prophylaxie post-exposition. La voie IV est hautement recommandée lorsqu’on s’approche du délai de 72 heures ou en cas d’hémorragie foeto-maternelle identifiée.
Lorsqu’une nouvelle circonstance anténatale indiquant une immunoprophylaxie ciblée survient après une première administration d’anti-D, on peut s’abstenir de renouveler la prophylaxie dans un délai qui est fonction de la dose antérieurement reçue (9 semaines pour 200 µg, 12 semaines pour 300 µg). L’abstention s’applique :
dans tous les cas où il existe un risque modéré de passage d’hématies foetales;
seulement si le test de Kleihauer est négatif lors d’une circonstance à risque important de passage d’hématies foetales (voir tableau ci-après).
Lors de toute injection d’immunoglobulines, le nom du produit et le numéro de lot doivent être notés dans le dossier patient.
II. Prophylaxie au premier trimestre de la grossesse
Une injection unique de 200 µg d’immunoglobulines anti-D par voie intramusculaire ou intraveineuse est justifiée pour tous les événements détaillés dans le tableau ci-après ;
Il n’y a pas de limite inférieure d’âge gestationnel pour la réalisation de la prévention;
Un test de Kleihauer (quantification des hématies foetales dans le sang maternel) n’est pas nécessaire avant l’injection d’immunoglobulines.

XI-A propos du test de Kleihauer
Le diagnostic repose sur la mise en évidence des globules rouges fœtaux dans la circulation maternelle. Le test de Kleihauer est le test diagnostique le plus simple pour distinguer les hématies fœtales des hématies maternelles. Il est fondé sur la résistance différentielle de l’HbF et de l’hémoglobine adulte (HbA1 et HbA2) à l’acidité. L’examen microscopique permet après élution acide et coloration des lames d’observer et de compter les hématies fœtales intactes parmi les hématies maternelles dénaturées. Ce test présente pour inconvénients principaux d’être opérateur dépendant et soumis aux faux positifs liés à la persistance d’une HbF maternelle (ex. hémoglobinopathie hétérozygote) Des techniques microscopiques et d’automatisation permettent d’améliorer la reproductibilité du test et de diminuer la variabilité des résultats.
La cytométrie de flux permet le tri des globules rouges. L’identification et l’isolement des hématies reposent sur le marquage antigénique des membranes érythrocytaires. Elle permet une analyse quantitative précise surtout pour des HFM supérieuress ou égales à 0,5 %. La mise en œuvre d’un double marquage permet de repérer les faux positifs maternels en utilisant un anticorps dirigé contre les chaînes γ de l’HbF et un anticorps dirigé contre l’anhydrase carbonique exprimée uniquement chez la mère. Pour quantifier spécifiquement une HFM chez un fœtus Rhésus positif il est possible d’utiliser des anticorps anti-D. L
Les résultats des tests diagnostiques sont présentés sous forme de pourcentage le plus souvent (nombre d’hématies fœtales sur 100 hématies maternelles, voire sur 10000). Certains laboratoires calculent directement le volume estimé de l’HFM. Il faut être attentif au libellé du compte-rendu et distinguer le volume de sang total transfusé du volume globulaire transfusé. Le volume de l’HFM représente le double du volume globulaire transfusé si on considère l’hématocrite fœtal égal à 0,5. Le volume de l’HFM est calculé le plus souvent par la formule de Kleihauer :
HFM(ml)=tK×VmHtmHtf=tk×4511tK en centième ; Vm : volémie moyenne maternelle = 5800 ml ; Htm : hématocrite moyen maternel = 0,35 ; Htf : hématocrite moyen fœtal = 0,45
Ainsi, le volume de l’HFM pour un tK de 5 % (=0,05=500 érythrocytes fœtaux/10000 érythrocytes maternels) : HFM=0,05×4511=225ml.
La plupart des auteurs utilise une formule simplifiée où la volémie maternelle est de 5000ml, le rapport des hématocrites égale un et le tK est exprimé en pourcentage :
HFM(ml)=tK×50
Pour un tK de 5 % l’HFM égale : HFM=5×50=250ml.
Quelle que soit la formule utilisée et le test effectué, l’estimation de la volémie maternelle influe beaucoup sur l’estimation de l’HFM [25]. La volémie maternelle pourrait être estimée individuellement par la formule suivante :
Volémie maternelle=65ml/kgdepoidsmaternel+25 %(lié à lagrossesse)
L’INCOMPATIBILITÉ ABO
Généralités
Certaines mères du groupe O possèdent des anticorps anti-A et anti-B appartenant à la classe des IgG et donc capables de traverser la barrière placentaire. Les femmes des groupes A et B possèdent habituellement des anticorps anti-A et anti-B de type IgM qui ne passent pas la barrière placentaire et sont donc sans inconvénient.
L’incompatibilité ABO ne se rencontre donc que chez certaines mères du groupe O dont l’enfant est de groupe A ou B. Elle représente les 2/3 des maladies hémolytiques fœtales maintenant que les incompatibilités rhésus tendent à disparaître. Elles sont par contre beaucoup moins graves.
Conséquences foetales
L’incompatibilité ABO concerne 20 % des grossesses mais une anémie n’apparaît que très rarement. La bénignité de l’affection s’explique par le petit nombre de sites antigéniques A et B présents sur la membrane des hématies.
Il n’existe ni anasarque ni mort fœtale in utero.
À la naissance, les formes asymptomatiques sont fréquentes. Dans les formes patentes, apparaît un ictère précoce, sans hépato-splénomégalie, mais qui, s’il est intense, fait courir le risque d’ictère nucléaire qui doit être prévenu par l’exsanguino-transfusion. Certaines formes légères peuvent se révéler par une anémie tardive.
Contrairement à l’allo-immunisation rhésus, il n’existe pas ici de surveillance sérologique ni d’indication d’accouchement prématuré.
Les incompatibilités dans les groupes rares
La principale cause de ces immunisations est la transfusion sanguine. Les anticorps produits sont souvent des IgM et il n’existe généralement pas de risque de maladie hémolytique chez le fœtus.
Seuls certains anticorps comme les anti-C, anti-Kell et anti-E peuvent cependant provoquer une maladie hémolytique sévère qui devrait nécessiter la même surveillance et les mêmes conduites à tenir que l’allo-immunisation rhésus.