I-Principe de la coeliochirurgie
La coeliochirurgie ou chirurgie sous coelioscopie consiste à accéder à la cavité abdominale sans ouvrir la paroi abdominale. Elle est possible grâce à plusieurs artifices :
■Une « optique » (reliée à une caméra) est introduite dans la cavité abdominale à travers une cicatrice que le chirurgien pratique dans l’ombilic. Cette « optique » est reliée à un « moniteur » (écran) que le chirurgien regarde en opérant.
■Du gaz carbonique (CO2) est ensuite introduit dans la cavité abdominale. La pression positive exercée par ce gaz va soulever la paroi abdominale, créant ainsi un espace entre la paroi et les viscères où le chirurgien peut regarder et où il peut introduire ses instruments pour opérer.
■Enfin, des « trocarts » (sortes de grosses aiguilles de 5 à 12 mm) sont introduits à travers la paroi ainsi soulevée, par lesquels le chirurgien va passer des instruments de 5 à 12 mm de diamètre pour opérer (pinces, ciseaux, instruments de coagulation et de suture, etc.).
La cœlioscopie exige une formation spécifique et une certaine expérience. Elle présente l’avantage de ne créer presque pas de cicatrices, juste des orifices de 0,5mm ou 1cm, et de permettre une rapide réhabilitation des patients.
II-Historique de la coeliochirurgie
Il est bon de rappeler que l’histoire de la coeliochirurgie est avant tout une histoire française. D’abord diagnostique, juste pour voir, elle fut développée dans les années 40 par un français, Raoul Plamer, né à Paris le 29 août 1904.
De tous temps, le médecin a cherché à voir à l’intérieur du corps humain. C’est Philipp Bozzini, habitant de Francfort, qui conçut, en 1806, le premier appareillage destiné à l’exploration visuelle des cavités internes. Un français, Désormeaux, inventa le terme « endoscope » en 1853, et le mot « endoscopie » apparaît dans la littérature en 1878. Au début du XIXe siècle, les appareillages comportaient de savants jeux de miroirs et de lentilles, destinés à amplifier des flammes éclairantes dont on imagine la pauvreté. Quand vint l’électricité ce fut comme un miracle. Dès le début du XXe siècle, on pensa à faire entrer un appareil d’optique dans la cavité abdominale. C’est sur un chien qu’en 1901, Kelling, de Dresde, explora pour la première fois un ventre préalablement gonflé d’air. Il appela cette exploration une Koelioskopie. Jacobaeus, de Stockholm, en 1912 appliqua la méthode à l’homme sous le nom de laparoscopie. Ce mode d’exploration ne connut aucun succès pratique. C’est Raoul Palmer, qui va donner ses lettres de noblesse à l’endoscopie abdominale. Car s’il n’en est pas l’inventeur, il en montrera l’intérêt et sera responsable de la majo- rité des « grandes premières » réalisées par cette méthode. Il ne suffisait pas d’introduire une optique dans le bas ventre pour faire un diagnos- tic. La disposition anatomique des organes génitaux féminins fait que les trompes et les ovaires sont naturellement cachés derrière l’utérus. D’où la déception et le désintérêt des premiers expérimentateurs. Certains eurent l’idée de passer par le cul-de-sac vaginal postérieur. Ce fut la « culdoscopie ». Palmer l’essaya. Sans en minimiser les mérites, il en déplora les insuffisances. Obstiné, et persuadé que la voie abdominale était la meilleure, il persévéra et eut un trait de génie. Une sonde destinée aux explorations radiologiques de l’utérus lui permit de relever l’organe vers l’avant, libérant l’ensemble trompe-ovaire qui devint ainsi spectaculairement « lisible » au travers d’une simple optique trans-ombilicale. Nous sommes en 1943. L’exploration gynécologique non chirurgicale est née. Elle ne cessera, dès lors, de progresser.

Dès 1945, Palmer fit un voyage aux USA pour chercher des optiques meilleures, et ses premiers travaux furent présentés à l’Académie de Chirurgie par Mocquot en 1946, dans un silence glacial. L’opération avait lieu sous anesthésie locale, et il en fut ainsi jusqu’en 1952, période à laquelle les dangers de la narcose commencèrent à diminuer. C’est en 1952 aussi qu’apparut l’éclairage par tige de quartz donnant une lumière enfin suffisante. Perfectionnant sans cesse sa technique et son matériel, il devint vite le numéro un mondial de la méthode. D’autant plus facilement, il faut le reconnaître, qu’il travaillait dans le mépris absolu des chirurgiens de l’époque. « Pourquoi ces acrobaties quand il est si facile d’ouvrir un ventre? » demandaient ses confrères. Sourd aux critiques et aux sarcasmes, inlassablement, Palmer avançait. En 1956, il montra le premier film tourné en intrapéritonéal. En 1958, il mit au point l’électro-coagulation des trompes par voie endoscopique. En 1961, il publia sa technique de prélèvement d’ovocyte à ventre fermé. C’était le premier pas vers la fécondation in vitro qui choquait les esprits de ce temps, et qu’on pratique si bien aujourd’hui. Ce mode opératoire a été longtemps utilisé, jusqu’à ce qu’il soit remplacé par les ponctions écho-guidées. L’Amérique, méprisante mais pragmatique, s’intéressa à ces publications quand elle comprit qu’il devenait possible de réaliser des stérilisations tubaires sans cicatrice et avec vingt-quatre heures d’hospitalisation seulement. A Broca, loin des lieux prestigieux où se font et se défont les carrières officielles, le minuscule laboratoire de Palmer devint le point de ralliement des gynécologues du monde entier. Lui-même commentait ses images en cinq langues devant des praticiens éberlués qui regardaient l’endoscopeur ambidextre manier l’optique d’une main et dessiner de l’autre. Les gros registres des compte-rendus opératoires de Raoul Palmer sont de merveilleux livres illustrés où le lecteur trouve, schématisées, toutes les pathologies du petit bassin. Raoul Palmer nous a quittés le 5 juillet 1985, laissant derrière lui plus de huit cents publications dont l’immense majorité avaient un caractère prémonitoire évident. Il fait partie de la prestigieuse cohorte des novateurs méprisés par leurs contemporains. Jenner, Pasteur, et tant d’autres avant lui, prêchèrent longtemps dans le désert.

C’est un autre français, Hubert Manhes (né à Aurillac en 1938) qui commença à réaliser au début des années 1970 de petites interventions, dans une clinique privée de la ville de Vichy, la clinique de la Pergola, dont les chirurgiens voyaient d’un mauvais oeil un simple gynécologue opérer sans incisions classiques, surtout à une époque où la réputation d’un chirurgien dépendait de la longueur de ses incisions… C’est là qu’il réalisa la première opération d’une grossesse extra-utérine par coeliochirurgie. Très vite l’école de Clermont-Ferrand, dont il se rapprocha rapidement, se mit à développer la pratique coelioscopique de diverses opérations gynécologiques comme les kystes ovariens, jusqu’à la première publication du traitement lapasocopique d’une grossesse extra-utérine en 1972. Parallèlement on vit se développer toute une instrumentation adaptée à cette nouvelle chirurgie.

En 1982, la première appendicectomie sous coelioscopie fut réalisée par le Gynécologue allemand Kurt Semm. Un chirurgien français, Philippe Mouret, installé à la Clinique de la Sauvegarde à Lyon, réalisa la première appendicectomie coelio française en 1983 et surtout, en 1987, en première mondiale, une cholecystectomie par cœliochirurgie. A la fin de l’année, il avait renouvelé l’intervention 15 fois. L’année suivante, un Américain croyait publier une grande première mais Mouret avait déjà 30 observations! Il montra au monde que la coeliochirurgie pouvait sortir du cadre de la chirurgie gynécologique et s’appliquer aux autres pathologie de l’abdomen. Son matériel bientôt équipé d’une caméra, il devient l’initiateur de la « vidéo chirurgie » qui s’étendra à toutes les spécialités chirurgicales. Admiratifs, les Américains parlèrent de la « New French Revolution ». Dès 1990, Mouret s’endetta lourdement pour créer un centre privé de chirurgie ambulatoire mais il n’obtint pas l’autorisation administrative de la Sécurité Sociale d’y opérer et les banques le traînèrent en justice. Condamné, il fut rayé du Conseil de l’Ordre des Médecins. Et, comme on a toujours tord d’avoir raison trop tôt, en 2002, il dut s’expatrier pour aller enseigner ses méthodes au Viêt-Nam, en Inde, et surtout en Italie. Il reçut en 2007, au Japon, le prestigieux prix Honda, avant de mourir d’un cancer en 2008. Le développement universel de la coeliochirurgie contraste avec l’oubli de celui qui en a été le génial instigateur. A partir de la tout le monde s’y mit, y compris d’autres spécialités comme l’urologie, l’orthopédie, etc.

Un autre chirurgien français, Dominique Grousseau, exerçant dans la petite cité de Saint-Junien (Haute-Vienne) réalisa, au CHU de Limoges, la première mondiale d’une opération de sténose hypertrophique du nourrisson par voie coelioscopique, le 26 mai 1990, après avoir développé les instruments spécifiques nécessaires pour des nourrissons de trois semaines. Aujourd’hui un très grand nombre d’opérations gynécologiques sont faites par coelioscopie, peut-être même un peu trop car certaines d’entre elles peuvent avantageusement être faites par voie vaginale, sans aucune cicatrice et de façon plus rapide. La chirurgie, assez lourde de certains cancers pelviens, bénéficie aujourd’hui des abords coelioscopiques.
III-Spécificités et contraintes de la coeliochirurgie
A-Pneumopéritoine et contraintes des pressions
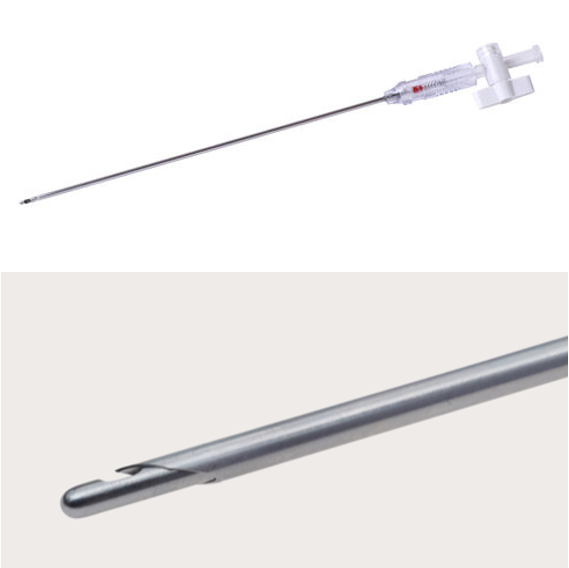
Deux techniques sont possibles pour l’insufflation du gaz : aiguille de Veress et trocart direct (technique de Hasson ou “open cœlioscopy”).
- Aiguille de Veress : Il s’agit de la technique initialement décrite. L’aiguille est insérée à l’aveugle dans l’abdomen et permet l’apport de CO2. L’aiguille présente une canule intérieure mousse qui limite le risque de lésion des organes abdominaux au moment de son insertion.
Cela permet d’obtenir une distension abdominale préalablement à l’insertion des canules, ce qui diminue le risque de trauma aux organes abdominaux lors de l’insertion de celles-ci.
Les complications de cette technique sont la ponction d’un organe ou l’insufflation de gaz dans un organe, une masse ou en sous-cutané. - “Open coelioscopy” – Technique de Hasson : Cette technique est actuellement préférée par de nombreux chirurgiens car elle est plus facile à réaliser.
- La première canule insérée possède un robinet d’insufflation. Elle est mise en place par une minilaparotomie de taille à peine supérieure au diamètre de la canule.
Cela implique de placer la première canule au travers d’une paroi abdominale non distendue. Le risque est de léser un organe (rate, vessie) lors de l’insertion de cette canule. - Si l’incision dans la paroi abdominale est plus grande que la taille de la canule, il risque d’en résulter un défaut d’étanchéité et donc une fuite de gaz ce qui altère la qualité du pneumopéritoine.
C’est le défaut majeur de cette technique, mais la mise en place d’une suture en bourse autour de la canule permet de remédier le plus souvent à une perte d’étanchéité. - Les canules suivantes sont placées sous contrôle visuel après l’insufflation, en orientant l’optique dans l’abdomen vers le point de pénétration, préalablement repéré en enfonçant la paroi avec le doigt.
- La première canule insérée possède un robinet d’insufflation. Elle est mise en place par une minilaparotomie de taille à peine supérieure au diamètre de la canule.
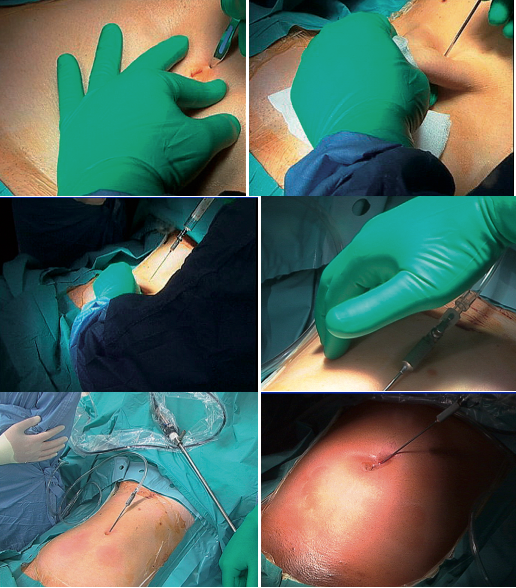
Plusieurs points d’insufflation peuvent être utilisés. La voie transombilicale répond au double intérêt de facilité et d’esthétique; la ponction se fait en sus ombilical ou dans la berge inférieure de l’ombilic, ou hypochondre ou fosse iliaque gauches. Le choix dépend notamment de l’existence de laparotomie antérieure. L’aiguille doit être introduite verticale; lorsque le point de ponction est ombilical, la peau et la paroi antérieure doivent être soulevées chez les femmes maigres pour éviter ainsi une plaie de l’aorte ou de la veine cave inférieure. Une fois les 2 ressauts perçus (aponévrose et péritoine pariétal), il faut vérifier que la mobilité de l’aiguille introduite est aisée.
Il existe divers tests de sécurité selon les habitudes du chirurgien:
– l’aspiration simple ne doit ramener ni gaz ni liquide,
– l’injection de quelques cc de sérum physiologique ne provoque pas de gonflement localisé et ne peut être réaspiré,
-une seringue en verre, munie d’un piston coulissant correctement, est adaptée sur l’aiguille à pneumopéritoine, le piston en position haute. Si celle-ci est en péritoine libre, le piston est attiré vers le bas lorsque l’on soulève la paroi abdominale créant ainsi une pression négative.
on remplit la seringue en verre d’air, qu’on injecte dans l’abdomen; puis on aspire, le piston doit remonter librement quand on le soulève
– l’aiguille de Verres doit pouvoir être mobilisée librement : mouvements de va et vient.
L’insufflation peut commencer; le pneumopéritoine est alors contrôlé par la percussion abdominale devant trouver une disparition immédiate de la matité pré-hépatique et par l’observation d’un gonflement symétrique et progressif.Lors du remplissage, la petite boule de l’appareil doit « flotter » librement dans sa colonne. La PIA ne doit pas dépasser 15 mm Hg. 2 à 4 litres de CO2 sont nécessaires pour entraîner une distension abdominale suffisante.
Par définition, la coelioscopie crée un espace opératoire sans ouvrir la paroi. La pression intra-abdominale (Pression intra-abdominale ) étant physiologiquement négative, la cavité est donc virtuelle. Écarter sans ouvrir, c’est donc mettre la cavité en pression positive.
La pression positive réalisée par l’insufflation de gaz dans la cavité abdominale peut être responsable de complications médicales. Toutefois, si le fonctionnement de l’insufflateur est bien compris et bien utilisé, et surtout, si le chirurgien connaît la physiologie hémodynamique et respiratoire, l’utilisation de la pression positive à bon escient peut devenir un facteur de sécurité. En effet, les fonctions du gaz sont multiples.
– Mise en tension de la paroi abdominale : ceci permet d’éloigner la paroi des gros vaisseaux lors de l’introduction des trocarts.
– Création de l’espace opératoire par écartement des structures les unes des autres : ceci génère la vision et apporte une plus grande sécurité lors de l’application des énergies électriques.
– Infiltration et dissection des plans par le gaz : cette propriété appelée barodissection est particulièrement intéressante car elle facilite souvent la reconnaissance des plans de clivage.
– Barohémostase : grâce à la pression positive régnant dans la cavité, il existe un tamponnement qui protège du saignement, mais qui peut aboutir à un saignement différé si une vérification de l’hémostase n’est pas réalisée à faible pression en fin d’intervention. En effet, si on compare les pressions intravasculaires à la pression du pneumopéritoine, le différentiel est toujours en faveur du vaisseau plutôt qu’en faveur du pneumopéritoine. En conséquence, lors d’une plaie vasculaire, il y a hémorragie. Cependant, pour le réseau capillaire, le différentiel s’inverse et devient favorable au pneumopéritoine. Dans ces circonstances, il existe un tamponnement, qui aboutit à une hémostase. Le coelioscopiste peut augmenter provisoirement la PIA à des fins d’hémostase. Ce fait endoscopique est intéressant car plusieurs facteurs d’hémostase peuvent être associés. Le remplissage du cul- desac de Douglas avec un liquide de lavage chaud associé à une élévation de la PIA aboutit à une hémostase plus efficace. Ce phénomène s’apparente à la compresse laparotomique et doit être utilisé avec l’accord de l’anesthésiste.
l’hyperpression abdominale est responsable de troubles ventilatoires, hémodynamiques et métaboliques :
– troubles ventilatoires : l’ascension diaphragmatique comprime les poumons et réduit l’amplitude de la ventilation,
– troubles hémodynamiques : au cours de l’insufflation péritonéale, le pouls s’accélère et la pression artérielle tend à s’élever avec pincement de la différentielle,
– effets métaboliques : le pneumopéritoine provoque une acidose métabolique dans le territoire veineux cave inférieur. Cette acidose est proportionnelle à la pression intra-abdominale.
Ces notions entraînent des conséquences pratiques:
– la nécessité d’une anesthésie générale et de l’intubation endotrachéale avec ventilation contrôlée.
– le risque proportionnel à la pression intra-abdominale qui ne doit pas dépasser 20 mm Hg, à la vitesse d’insufflation du gaz et à l’inclinaison de la position de Trendelenburg qui ne doit pas dépasser 30°.
– la nécessité d’une exsufflation progressive en décubitus dorsal. En effet, lors de l’exsufflation, le sang veineux stocké retourne brutalement au cœur droit, avec pour conséquences une surcharge myocardique, un apport important d’acide lactique, un embole hypercapnique, pouvant entraîner des troubles du rythme ou des OAP.
– Les troubles du rythme fréquents : ils sont secondaires à une stimulation vagale (manipulation viscérale), à la libération de catécholamines endogènes secondaire à l’hypercapnie, aux stimulations douloureuses (lors d’une anesthésie insuffisante), et enfin à l’hypoxie, que prévient la ventilation artificielle.
– Le danger des cœlioscopies chez des sujets ayant des antécédents cardio-respiratoires.
B-Contraintes de vision
La vision laparoscopique réputée pour être meilleure que la vue laparotomique est vantée comme l’un des atouts majeurs de l’endoscopie. L’opérateur devient capable, grâce à l’endoscope, d’amener son oeil au niveau même de la structure opérée et du champ d’action. C’est un avantage car il permet au chirurgien de virtualiser les difficultés, c’est-à- dire d’éliminer du champ de vision les obstacles en positionnant son oeil endoscopfque et ses instruments en amont de ceux-ci.
Cet avantage important de la technique est aussi la principale source de complications puisque du même coup, le coeliochirurgien perd le contrôle de l’espace situé entre son oeil endoscopique (virtuel) et son oeil réel. Cette vision volontairement limitée peut conduire à deux sortes d’accidents:
– des instruments peuvent être laissés sans contrôle visuel dans la cavité et être responsables d’actions non désirées;
– lors de l’utilisation de l’énergie monopolaire, cette vue limitée peut être responsable de couplages directs entraînant des brûlures inaperçues.
C-Contraintes liées à la manipulation des trocarts
Le premier ensemble fourreau-trocart est introduit dans la cavité abdominale par une petite incision cutanée de la berge inférieure de l’ombilic, puis le mandrin est retiré et remplacé par l’optique du cœlioscope relié à une source de lumière froide.
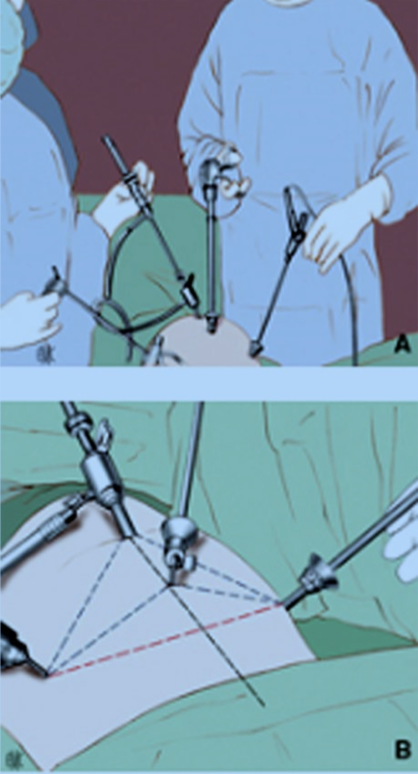
A. L’opérateur principal se place à gauche de la patiente tandis que I »aide est à sa dioite et tient l’optique. La table est baissée au plus bas. B. L’installationcomprend habituellement un trocart transombilical,de 10-12 mm de diamètre au travers duquel est passée l’optique et sur lequel est branchée l’arrivée du gaz, deux trocarts opérateurs de 5 mm de diamètre disposés dans les fosses iliaques et un trocart opérateur placé sur la ligne médiane (tracé pointillé en noir), en général au-dessus de la ligne imaginaire joignant les deux trocarts latéraux (tracé pointillé en rouge). Noter la triangulation des trocarts opérateurs entre eux et avec le trocart supportant l’optique (tracé pointillé en bleu).
Lors de la manipulation de ses instruments à travers la paroi abdominale, le coeliochirurgien doit lutter en permanence contre le point fixe pariétal. Ce point fixe est responsable de la limitation des angles d’attaque des tissus et de la présence d’un point de force important. Ainsi, plus la partie de l’instrument supérieure à la cavité est grande, plus le chirurgien est précis et plus la force appliquée aux tissus est grande. À l’opposé, plus la partie extérieure sera petite, plus la force appliquée sera faible, plus l’imprécision sera grande. L’opérateur doit distinguer les trocarts opérateurs des trocarts d’exposition. Les trocarts opérateurs doivent permettre à l’instrument d’atteindre le site opératoire avec le maximum d’angles d’attaque possible. Ils ne doivent par ailleurs jamais être plusieurs dans l’alignement de l’optique. Cette situation est mieux réalisée par la triangulation des trocartsopérateurs avec le trocart porteur de l’optique et par la triangulation des trocarts opérateurs entre eux. Les trocarts opérateurs sont placés près de la cible. À l’opposé, les trocarts d’exposition doivent être loin de la cible et leur triangulation est moins essentielle. Cette situation est cependant de plus en plus difficile à gérer compte tenu des multiples voies d’abord nécessaires à la chirurgie endoscopique de plus en plus complète.Par ailleurs, la fixité du trocart empêche le chirurgien de produire les mouvements complexes de la main. Le meilleur exemple est donné par la suture. Pour le chargement du tissu par une aiguille au cours d’une laparotomie, le chirurgien réalise un mouvement complexe de la main associant une rotation et une pronation. La fixité pariétale rend cette combinaison impossible. La suture endoscopique répond donc à des impératifs différents de ceux de la suture laparotomique.
D-Contraintes organisationnelles
L’endoscopie, en plus de la paroi fermée, présente d’autres contraintes pour l’application des énergies, comme l’absence d’écarteur vrai. L’application de l’énergie se fait donc dans des conditions de proximité anatomique. L’effet tissulaire doit non seulement être connu, mais doit pouvoir être reproduit de manière exacte.
E-principes d’ergonomie
Afin d’améliorer son efficacité opératoire, le coeliochirurgien doit suivre certaines règles. – Mettre toutes les informations et que les informations nécessaires sur l’écran: il faut donc
-enlever de l’écran la partie du champ opératoire inutile et ne garder que les structures anatomiques opérées et les instruments utilisés sur le moment. Cela permet de se concentrer sur une étape de l’intervention et de virtualiser ainsi les difficultés. Cette attitude procure au chirurgien un avantage psychologique. En revanche, il ne faut jamais quitter les yeux de l’écran!
– Changer son optique de place pour avoir un accès visuel et technique adéquat : cet exemple est illustré par la mise de l’optique en sus-pubien lors de l’accès à la bifurcation iliaque pour un curage lomboaortique. Cependant, l’opérateur doit alors se placer entre les jambes de la patiente pour garder son axe de travail dans l’axe de sa vision, faute de quoi, ilinversera ses mouvements. La règle à respecter est de ne jamais travailler à plus de 90° en dehors de l’axe de vue.
– Utiliser ses deux mains : la coelioscopie moderne a étendu les indications opératoires et impose la technique utilisant les deux mains. L’avantage majeur tient dans l’action concomitante et successive des deux outils. Malheureusement, l’expérience montre que la plupart des endoscopistes n’utilisent en fait qu’un outil à la fois. Si l’on admet qu’un opérateur va se servir le plus souvent d’une pince bipolaire dans une main, et des ciseaux dans l’autre main, on remarque immédiatement qu’aucun des outils n’est destiné à l’exposition.Cependant il faut, pour des raisons d’efficacité et de sécurité, que le coelioscopiste apprenne à exposer avec les ciseaux pendant que la pince coagule, èt à couper avec les ciseaux alors que la pince expose. Techniquement, un outil ne doit jamais être inactif. La multiplication des fonctions ne réside pas uniquement dans les qualités de l’instrument, mais dans les manières de l’utiliser. C’est cette succession d’actions qui permet au chirurgien d’agir sur les tissus dans les meilleures conditions de vue et d’attaque instrumentale. C’est aussi prévenir les complications.
– Optimiser l’utilisation des trocarts : d’une part en plaçant autant de trocarts que de mains disponibles (en général, le trocart optique + trois trocarts opérateurs) et d’autre part en ne condamnant pas de trocart opérateur pour l’écartement fixe des organes. Par exemple, si l’on a besoin de récliner le côlon gauche pour s’exposer pendant un temps suffisamment long de l’intervention, on aura recours à la fixation de ses franges graisseuses à la paroi par un point transpariétal.
– Adopter une position ergonomique : en règle générale, un muscle s’épuise rapidement lorsqu’il est utilisé à plus de 50 % de son amplitude d’action. Selon ce principe, il est donc préférable de travailler autant que possible les coudes le plus proches du corps et les bras à l’horizontale ou vers le bas pour soulager les muscles de l’épaule, en particulier lors des coeliochirurgies longues. Pour ce faire, il est plus aisé à un opérateur de travailler en coelioscopie en étant surélevé par une estrade.
– Ne pas utiliser de manière excessive le lavage : ceci entraîne souvent des inconvénients comme la perte de l’exposition, la perte du plan anatomique du fait d’une infiltration des tissus par l’eau (oedème), la perte de l’efficacité énergétique et finalement une perte de temps.
F-L’équipe médicale et l’environnement
La coeliochirurgie nécessite une interactivité entre l’anesthésiste et le chirurgien. L’anesthésiste peut par exemple retentir sur la vision chirurgicale par le bon endormissement et le bon relâchement du malade (phénomène identique à ce qui se passe lors d’une laparotomie). Le chirurgien peut intervenir sur des données essentielles de l’homéostasie du patient telles que la capnie. Cela passe par la connaissance des appareils et leur utilisation optimale. Le pneumopéritoine est certainement le meilleur exemple de l’interdépendance existant entre l’anesthésiste et le coeliochirurgien. Comme le pneumopéritoine permet la vision et donne les différents avantages que nous avons décrits, la tendance du chirurgien est donc d’augmenter la pression intra abdominale (PIA). L’anesthésiste, au contraire, doit faire face à la compression des gros vaisseaux avec une diminution du retour veineux au coeur, à l’augmentation des résistances vasculaires périphériques, à la diminution des débits régionaux et à l’augmentation des pressions pulmonaires. La tendance de l’anesthésiste est donc de diminuer la PIA.
L’apport technologique considérable autour de l’endoscopie lui confère un rôle biomédical. C’est en effet sur elle que les chirurgiens se déchargent le plus souvent pour le choix, l’entretien et la connexion des appareils. C’est aussi elle qui assure la maintenance des petites pannes quotidiennes. Son intervention au niveau de la sécurité est de plus en plus importante. Elle surveille le bon déroulement de l’intervention, vérifie les paramètres des différents appareils, les modifie à la demande du chirurgien et s’assure de la constance des paramètres de sécurité. Son rôle dans la prévention des complications est donc évident. En fait, on peut dire que comme elle est responsable de la colonne de coeliochirurgie, le coeliochirurgien lui confie sa vue.
Jusqu’à aujourd’hui, les coeliochirurgies étaient réalisées dans les salles conçues pour les laparotomies. La forte pénétration des techniques laparoscopiques dans toutes les disciplines a imposé une nouvelle réflexion sur l’organisation de la salle d’opération.
En effet, les techniques laparoscopiques ont des spécificités.- Environnement technique encombrant mais très important de par son implication dans la qualité de l’acte chirurgical.- Nombreux acteurs actifs pendant l’intervention.
– Travail indirect sur un écran, imposant une ergonomie du placement des chirurgiens. – Travail à ventre fermé et distendu ce qui modifie la hauteur du champ opératoire et impose une installation spécifique sur une table adaptée. .
– Évolution de l’opérateur au sein d’une connectivité spécifique qui doit être comprise pour un résultat optimal.
La salle d’opération doit être vaste et claire. La clarté est indispensable à la surveillance du patient endormi. La couleur des téguments est en effet l’un des paramètres à surveiller pour dépister la survenue de troubles hémodynamiques et respiratoires lors d’une laparoscopie. De plus, le travail à ventre fermé impose dans certaines circonstances (les sutures par exemple) des manoeuvres délicates à l’extérieur de l’abdomen. Ces manoeuvres imposent un éclairage adéquat du champ opératoire. La taille de la salle est également importante pour deux raisons: l’apport d’un matériel supplémentaire et l’agrandissement des espaces opératoires. En effet, bien que les champs opératoires soient les mêmes que lors des techniques conventionnelles, les opérateurs occupent un espace plus large lors de leur placement et sont assez souvent amenés à se déplacer autour du patient.
Le champ opératoire endoscopique est plus élevé que le champ conventionnel. En effet, le pneumopéritoine élève la paroi d’une dizaine de centimètres. Les outils utilisés mesurent en moyenne 43 cm de longueur, la moitié se trouvant à l’extérieur de la cavité. Le champ opératoire se trouve donc surélevé d’environ 30 cm. Il faut donc abaisser la table d’autant. Ce fait est majoré lors des chirurgies pelviennes où la position de Trendelenburg élève encore le champ. La table d’endoscopie doit donc être plus basse que les tables habituelles. L’utilisation d’une estrade par le coeliochirurgien prend ici tout son intérêt.
Idéalement, le patient est placé en décubitus dorsal à plat, jambes écartées. Dans les indications de chirurgie sousmésocolique et pelvienne, il est capital de placer’ les deux bras du patient le long de son corps, d’une part pour faciliter le recul du chirurgien ou de son aide vers la tête du patient et d’autre part justement pour éviter dans ce cas une élongation accidentelle du plexus brachial. Les anesthésistes qui perdent l’accès facile et la surveillance de la voie d’abord veineux sont parfois réticents. L’utilisation de prolongateur veineux permet de remédier à ce problème. La concertation entre opérateur et médecin anesthésiste est primordiale. Par ailleurs, un système antirecul sera mis en place sur le patient dès qu’une position de Trendelenburg est demandée.
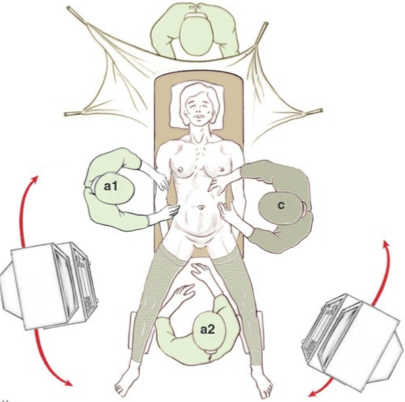
c: chirurgien; a1, a2 : aides.
Le placement des opérateurs dépend des indications et des habitudes. Cependant, les principes généraux restent les mêmes. Par souci de clarté, nous prenons pour le reste de l’exposé l’exemple d’une chirurgie Pelvienne.
L’opérateur et son aide principal se font’ face, l’opérateur se plaçant sur la gauche du malade. Pour un travail confortable de longue durée, l’opérateur doit se tenir droit, les coudes le long du corps. L’axe de la vue doit correspondre à l’axe du travail et doit passer entre les deux mains. La vision endoscopique se faisant par un écran, il faut disposer ce dernier de telle façon que cette règle soit respectée. Ainsi dans notre exemple, l’écran de l’opérateur est au mieux situé au pied droit du patient. En théorie, la fatigue visuelle de la vision sur un écran impose le placement de celui-ci à une distance comprise entre 1,6 fois et 6 fois la longueur de la diagonale de l’écran. L’assistant situé en face de l’opérateur est actif en tenant la caméra dans sa main gauche et en travaillant avec un instrument tenu dans sa main droite. Son confort visuel est donc également important. Au mieux, il doit disposer d’un deuxième écran de vision situé dans notre exemple au pied gauche du patient. Si un troisième opérateur est nécessaire entre les jambes du patient, il regarde soit l’écran de gauche, soit celui de droite. La table d’instruments et l’infirmière instrumentiste trouvent une place logique en arrière et à gauche de l’opérateur.
La plupart des chariots endoscopiques sont composés par l’empilement de l’insufflateur, de la source lumineuse, de la caméra et parfois du système de lavage-aspiration. L’écran est en règle, au sommet de la tour (Fig. 5). Le patient est relié au chariot par une sorte de «cordon ombilical » comprenant: le câble de COz, le câble de la lumière, le câble de la caméra et parfois un câble de lavage et un câble d’aspiration. Dans notre exemple, ce cordon vient du chariot portant l’écran de l’opérateur. Or la longueur de cordon est limitée par la longueur du câble optique qui doit être la plus courte possible pour éviter les pertes lumineuses. La longueur habituelle de ces câbles est d’environ 2 m. À chaque fois que l’opérateur bouge, il faut déplacer le chariot et son cortège d’efférences. Ces déplacements sont difficiles et exposent aux fautes septiques et aux accidents par déconnexion. De plus, ils fragilisent le matériel. Dans ces conditions, il est préférable de dissocier le chariot en deux éléments séparés. D’un côté l’écran, et de l’autre le reste de l’équipement. L’écran est en effet relié à la commande de la caméra par un câble. Au mieux cet écran est porté par un bras rotatif permettant une rotation autour du patient en fonction du placement de l’opérateur. Le reste de l’équipement est idéalement placé en empilement à un endroit où il ne gêne aucun membre de l’équipe médicochirurgicale. Cet emplacement peut être envisagé au dos du rack de l’anesthésie.
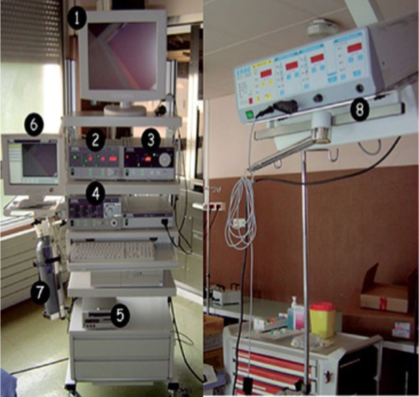
1. Moniteur ; 2. insufflateur électronique ; 3. source de lumière froide ; 4. pompe hydraulique électronique ; 5. enregistreur vidéo numérique ; 6. écran pour la gestion des photos ; 7. bouteille de dioxyde de carbone ; 8. générateur pour l’ électrochirurgie.
G-Contraintes liées au gaz
Le gaz idéal pour l’insufflation devrait avoir les propriétés suivantes : faible absorption péritonéale, effets physiologiques réduits, excrétion rapide après absorption, incombustible, effets minimes après embolisation intravasculaire et solubilité sanguine maximale. L’air et l’oxygène ne peuvent pas être utilisés pour l’insufflation puisqu’ils produisent une combustion lorsque l’énergie monopolaire ou le laser sont utilisés. L’hélium et le nitrogène sont moins solubles que le dioxyde de carbone CO2) et peuvent entraîner des conséquences plus graves si une embolie gazeuse intravasculaire survient. De plus, le prix de l’hélium est peu avantageux. L’argon pourrait avoir des effets hémodynamiques indésirables en particulier sur le flux sanguin hépatique. Bien que le nitrite d’oxyde soit bénéfique pour les procédures requérant une anesthésie locale ou régionale, ou en cas d’insuffisance respiratoire, il est combustible. Le CO2 s’approche du gaz idéal et demeure le plus utilisé en coelioscopie. C’est un gaz semi-inerte économique. Sa diffusion péritonéale n’entraîne pas de risque d’embolie grâce à sa diffusion systémique qui est régulée par le système ventilatoire. Ces qualités en font un gaz peu dangereux. Le pneumopéritoine résiduel de CO2 est éliminé plus rapidement qu’avec les autres gaz diminuant ainsi la durée de l’inconfort postopératoire. Toutefois, le problème majeur du CO2 réside dans son absorption vasculaire significative à travers le péritoine conduisant à une hypercapnie.
La qualité du pneumopéritoine est essentielle à la conduite de la coelioscopie. Il est indispensable de posséder un insufflateur électronique capable de monitorer le débit en fonction de la PIA. Les données actuelles de la physiopathologie hémodynamique ont bien montré qu’au-delà de 15 mmHg les résistances vasculaires périphériques augmentaient rapidement et que l’index cardiaque chutait. La PIA max est donc fixée à 15 mm Hg par l’opérateur. En fonction de cette pression, l’appareil va afficher des débits variant entre 0 et le débit maximal délivré par l’appareil. Les insufflateurs actuels présentent des débits de plus en plus importants. Ces hauts débits ne présentent en théorie aucun effet délétère tant que la PIA reste inférieure à la PIA max. Cependant, il existe deux limitations à ces hauts débits.
– La limitation de la pression à 15 mmHg et le diamètre des trocarts: dans une aiguille de Palmer, il est impossible de faire passer plus de 2,4 l/min à 15 mmHg. Dans un trocart de 10 mm de diamètre, vide de tout instrument, le débit maximal est environ de 6,5 (+/- 0,5) l/min. Il est donc inutile, si l’on conserve la voie traditionnelle de l’insufflation, de posséder des insufflateurs qui ont des débits supérieurs à 10 l/min.
– Le problème de l’hypothermie peut être réel en cas de débit élevé. Il est donc nécessaire de monitorer la température corporelle des patients. Ce fait est majoré par l’utilisation de quantités importantes de liquide de lavage si ce dernier n’est pas amené à la température de 37°C.
Pour toutes ces raisons, l’emploi des hauts débits ne doit pas être systématique mais réservé aux conditions de fuites importantes (aspiration, changement de trocart, etc.). L’affichage de la consommation de gaz semble a priori inutile. Cependant, cette donnée est certainement intéressante chez les enfants et en début d’insufflation lors de toute coelioscopie. En effet la matité préhépatique disparaît dès l’insufflation de 0,3 1 de gaz. La persistance de cette matité doit immédiatement faire évoquer une insufflation prépéritonéale.

Le premier chiffre à gauche indique la pression maximale intra-abdominale exprimée en millimètres de mercure. Le chiffre du milieu correspond au débit exprimé en litres par minute et le nombre de droite au volume de gaz insufflé, exprimé en litres.
H-Les nécessités de la vision
Considérée comme un gadget en 1984, la caméra est devenue un véritable outil chirurgical. Du choix de la caméra et de la source lumineuse et de la connaissance des principes de base de la vision électronique va dépendre la qualité de la vue chirurgicale, et donc de l’acte chirurgical. L’un des avantages de l’approche endoscopique est l’obtention d’une vue meilleure – quasi microchirurgicale – que celle que nous avions par la laparotomie. Or actuellement, cette vue est devenue optoélectronique.Dans cet ensemble, la qualité de l’image obtenue ne dépend finalement que de la quantité de lumière disponible à chaque étape de la chaîne optique et électronique. Cette chaîne peut être artificiellement divisée en trois grands secteurs:
– la production de la lumière: la source lumineuse;
– l’acquisition de l’image: la caméra;
– la transmission de la lumière: l’endoscope et le câble.
Il est clair que la qualité finale est celle du plus mauvais des éléments de la chaîne. Aussi, dans le choix de la source lumineuse et de la caméra, faut-il tenir compte de l’ensemble des autres éléments de la chaîne. La source de lumière froide comporte une production de lumière blanche naturelle à partir de xénon et un ventilateur intégré qui absorbe une grande partie de la chaleur émise. La caméra transforme l’énergie lumineuse en signal électrique qui est ensuite décodé dans les trois couleurs primitives (rouge, vert, bleu) pour donner l’image en couleur sur l’écran du moniteur.
1-La source lumineuse
Les deux principaux types de lumière sont les halogènes et les xénons. Ils se distinguent par la température des couleurs, différence qui se traduit dans le rendu des couleurs qui tirent légèrement sur le bleu pour le xénon. Cependant, la plupart des caméras actuelles analysent et compensent ces variations grâce à une balance automatique des blancs. Toutefois, la qualité d’image obtenue avec le xénon reste supérieure. Certaines sources lumineuses utilisant des longueurs d’onde adaptées permettent d’améliorer la vision laparoscopique de certains changements tissulaires (bénins ou malins) en détectant la fluorescence des tissus soumis à une excitation lumineuse.
Le facteur déterminant pour une bonne vision laparoscopique est représenté par la quantité de lumière disponible à chaque endroit de la chaîne. La puissance de la source est donc le premier élément à considérer. Cependant, l’augmentation de la puissance pose un réel problème quant à la chaleur dégagée. En effet, cette lumière est définie comme une lumière froide. Or, il ne faut pas se méprendre sur cette définition. Une lumière habituelle (ampoule électrique) produit pour 100 % d’énergie utilisée environ 2 % de lumière et 98 % de chaleur. Une lumière dite froide abaisse ce rapport en produisant plus de lumière, mais sans réduire la production de chaleur à zéro. Ce fait implique un dégagement de chaleur important, d’autant plus fort que la source est puissante. Actuellement, les sources sont protégées contre la transmission d’une chaleur trop forte. La dispersion de la chaleur se fait essentiellement au cours du transport, le long du câble, lors de la connexion avec l’endoscope et le long de l’endoscope. Toutefois, certains accidents ont été rapportés par des brûlures dues à la chaleur de l’oeil de l’optique. Un réglage manuel par l’opérateur permet de définir de manière fixe la puissance de la source lumineuse. Cependant, lors de l’utilisation des caméras vidéo, la vision de près est gênée par une lumière trop importante, alors que pour la vision de loin, les images peuvent être sombres. Pour pallier ce problème, la plupart des sources actuelles possèdent une régulation lumineuse.
2-La caméra
Les premières caméras coelioscopiques ont réellement fait leur apparition entre 1984 et 1986. Elles étaient alors d’une sensibilité faible, de l’ordre de 20 lux et d’une définition modeste, de l’ordre de 150000 pixels. Depuis lors, elles ont subi de nombreuses évolutions. En simplifiant, une caméra est définie par les données suivantes.
– La nature du capteur : toutes les caméras actuelles sont équipées de capteurs charge couple device (Charge couple device ). Ce sont des systèmes électroniques qui transforment l’image réelle (photons) en image électronique interprétable sur un écran.
– La sensibilité qui est traduite en lux : le nombre de lux est inversement proportionnel à la sensibilité de la caméra. Ainsi, une caméra de 10 lux possède une sensibilité meilleure qu’une caméra de 15 lux. Autrement dit, moins une caméra possède de lux, moins elle nécessite de lumière pour l’obtention d’une image correcte.
– La définition d’une caméra : elle s’exprime en nombre de pixels, ce qui donne la définition du capteur et qui se traduit par le nombre de points constituant l’image. Plus le capteur possède de pixels, plus la définition de l’image est grande. On peut également exprimer la définition des caméras en nombre de lignes horizontales sur l’écran. Une caméra mono CCD de qualité doit avoir une résolution supérieure à 300 lignes,. un tri CCD peut avoir une résolution supérieure à 600 lignes.
– Le rapport signal/bruit : le signal vidéo produit par la caméra peut présenter un « bruit », qui se présente comme du grain sur l’image. Il est plus important dans les régions sombres ou rouges, ce qui est malheureusement souvent le cas en laparoscopie. Le rapport signal/bruit (rapport signal bruit /signal to noise radio), exprimé en décibels, mesure la quantité de bruit. Plus ce rapport est élevé, plus le bruit est faible.
– La régulation : certaines caméras sont équipées d’un système permettant la vision en faible lumière. Ces systèmes fonctionnent par l’augmentation automatique du gain de la caméra, ce qui est au prix de la détérioration de la qualité de l’image. Il est préférable d’avoir une source de lumière puissante plutôt qu’une caméra à gain automatique. Enfin, les nouvelles caméras sont équipées d’un shutter automatique. Elles sont ainsi capables de réguler leur vitesse d’obturation en fonction de la lumière. Ces shutters sont habituellement réglables de 1/30 à plus de 1/10 000 par seconde. Cette caractéristique permet à la caméra d’évoluer dans toutes les conditions de lumière. Lorsqu’on possède une telle caméra, il n’est pas nécessaire de posséder la régulation lumineuse sur la source.
– L’objectif : la plupart des caméras sont livrées avec des objectifs de 20 à 40 mm de longueur focale. Habituellement, avec une optique de 110°, un objectif de 3S mm permet d’obtenir une image plein écran. Certaines caméras possèdent un zoom. Si le zoom n’est pasindispensable, il offre néanmoins certains avantages comme un grossissement plus important de l’image et l’obtention du plein écran même lors de l’utilisation d’optiques de faible diamètre ou d’angle étroit. Si habituellement un objectif de 3S mm suffit à obtenir le plein écran, certains endoscopes maintiennent un rond noir sur le contour de l’écran. C’est dans ces conditions que le zoom peut s’avérer utile pour rétablir l’image totale. Bien sûr, l’utilisation d’un zoom demande plus de lumière. Si l’on possède ce type de caméra, il faut donc une source de lumière plus puissante.
3-Endoscope, câble et moniteur
Le câble de lumière unissant l’endoscope et la source lumineuse est un élément important de la chaîne car lors de la transmission de la lumière, il est responsable d’une atténuation lumineuse plus ou moins importante, fonction de son type et surtout de son état. Les câbles optiques à fibre sont les plus utilisés. Ils sont constitués d’un faisceau de fibres optiques serti aux deux bouts. Ces câbles véhiculent la lumière grâce à la réfraction lumineuse à l’intérieur des fibres. Ils sont d’une très haute qualité de transmission optique, mais sont fragiles. En effet, au fur et à mesure de leur utilisation, un certain nombre de fibres optiques se cassent. La perte des fibres optiques peut se voir lorsqu’on regarde à jour frisant l’une des extrémités du câble, les fibres cassées sont représentées par des points noirs. Pour améliorer la longévité de ces câbles optiques, il faut les manipuler avec prudence en évitant de les tordre. En fin d’intervention, il est préférable de déconnecter le câble de l’endoscope et d’attendre son refroidissement avant de le manipuler. La plupart des sources de lumière disposent d’une fiche permettant de fixer le câble en attendant le refroidissement.
L’endoscope permet d’amener la lumière à l’intérieur de la cavité par des fibres et ramène l’image par un ensemble de lentilles. Comme tout système optique, il présente un pouvoir d’atténuation lumineuse. L’atténuation lumineuse est inversement proportionnelle au carré du diamètre de la lentille. C’est dire que plus l’endoscope est de petit diamètre, plus il consomme de lumière. La question du choix d’une optique droite ou d’ une optique à 30° est un vaste sujet. En effet, si l’on considère que pour une intervention systématisée telle qu’une intervention gynécologique ou digestive, une optique droite est l’optique de choix, il est sûr qu’une angulation à 30° voire 45° peut s’avérer intéressante pour certaines localisations; c’est le cas par exemple pour la vision de la bifurcation iliaque externe lors des lymphadénectomies coelioscopiques ou le traitement des hernies hiatales. Enfin, ces optiques sont maintenant dites panoramiques, c’est-à-dire que l’angle de vue est de 110°, permettant d’avoir à distance raisonnable une vue globale du champ opératoire.
Le moniteur est un élément important de la chaîne de vision. L’essentiel est de posséder un moniteur capable de restituer toutes les qualités de résolution de la caméra. C’est-à-dire qu’il faut que le nombre de lignes horizontales du moniteur soit au moins égal au nombre de lignes fournies par la caméra. La taille nécessaire pour le moniteur est extrêmement subjective. La taille et la définition sont deux choses différentes. Il est habituel de considérer qu’un moniteur de 44 cm de diagonale autorise une chirurgie de qualité. En fait, quelle que soit la taille choisie, il faut respecter la règle habituelle: l’opérateur doit se situer à une distance maximale égale à six fois cette diagonale.
I-L’instrumentation coeliochirurgicale
1-Les trocarts
Les trocarts sont extrêmement importants. En effet, ce sont eux qui permettent le passage des instruments à travers la paroi.
Ils sont responsables d’un grand nombre d’accidents et doivent être soigneusement choisis. Leur pointe est soit conique soit pyramidale. Schématiquement, les pointes coniques sont atraumatiques mais peu pénétrantes contrairement aux pointes pyramidales qui ont une grande force de pénétration mais du coup sont plus traumatisantes au niveau de la paroi et plus à risque de lésion viscérale. Par ailleurs, il faut que les trocarts aient une valve permettant un passage facile et atraumatique des instruments.
La taille des trocarts est conditionnée par le diamètre des instruments utilisés. La facilité’ serait d’utiliser pour tous les trocarts la taille maximale, permettant grâce aux systèmes de réduction d’utiliser tous les instruments. Le choix se porterait alors sur les trocarts de 10-12 mm. Il ne faut cependant pas accepter cette course vers l’augmentation du diamètre. En effet, parmi les avantages de l’endoscopie, la diminution de la longueur des incisions, et donc des douleurs postopératoires et des séquelles esthétiques, est un élément important. Il ne faut pas non plus négliger le risque d’apparition. des hernies incisionnelles : 0,23 % pour 10 mm, 3,1 % pour 12 mm.
Il faut réfléchir au choix de la taille et du placement des trocarts en fonction du diamètre de l’instrument à passer au travers, mais aussi suivant le rôle de cette voie d’abord, dans la pathologie traitée. Le meilleur exemple est donné par l’emplacement des trocarts au travers desquels seront réalisés les noeuds extracorporels. Pour la réalisation de ces noeuds, il est préférable d’utiliser des trocarts de 10 mm de diamètre. Leur emplacement est choisi en fonction du type d’aiguille utilisé, car l’angle d’attaque des aiguilles au tissu doit être aigu si nous utilisons des aiguilles courbes.

2-Les ciseaux
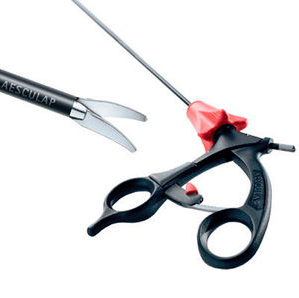
Ce sont des instruments micro chirurgicaux assez fragiles. Beaucoup de ciseaux acceptent une connexion monopolaire. Il faut cependant savoir que la coagulation porte les ciseaux à très haute température et est responsable d’un émoussage plus rapide. Plusieurs formes de ciseaux existent. Les ciseaux droits possèdent deux mors actifs. Ces modèles sont les plus efficaces dans la dissection. Il existe cependant des modèles possédant un mors fixe, qui permet des dissections plus fines notamment lorsque l’une des structures disséquées est vulnérable.
3-Les pinces
Elles permettent la préhension, la présentation, la dissection et éventuellement la coagulation des tissus. Elles sont le plus souvent atraumatiques mais il faut distinguer plusieurs types de pinces.
– Plates fines : issues de la microchirurgie, elles sont peu traumatiques mais tiennent peu les tissus. Ce sont les meilleures pinces de dissection.
– Grip : spécialement conçues pour la chirurgie endoscopique en gynécologie, elles sont considérées comme atraumatiques car leur prise est forte mais fine, évitant le traumatisme des saisies itératives.
– Fenêtrées : spécialement conçues pour la manipulation des anses intestinales, elles permettent une utilisation dans tous les gestes y compris la manipulation des aiguilles.
– À biopsie : elles ont été peu à peu remplacées par les autres pinces.
– À extraction : pinces de 5 ou 10 mm, spécialement conçues pour l’extraction transpariétale des pièces opératoires.
– Babcock : réplique des Babcock laparotomiques, elles sont conçues pour la manipulation des intestins.
– À clip : elles peuvent être réutilisables ou à usage unique. Les clips sont le plus souvent en titane, mais il existe des pinces pour les clips résorbables.

– À suture mécanique : elles sont rotatives avec poignée-pistolet et linéaire. Leurs extrémités actives peuvent être de différentes longueurs. La plus couramment utilisée est celle de 30 mm. Comme pour la laparotomie, le choix de la taille des agrafes dépend de l’épaisseur des tissus. Ces pinces à usage unique sont rechargeables pour permettre plusieurs agrafages, éventuellement de tailles différentes, au cours de la même intervention. Il existe deux types de chargeurs : blanc, ou vasculaire (taille de l’agrafe fermée: 1 mm), et bleu (taille de l’agrafe fermée: 1,5 mm).

4-Les dissecteurs
Ils sont de plus en plus utilisés en coelioscopie. Ils permettent la dissection complète des vaisseaux sur toutes leurs faces.
5-Les porte-aiguilles

Ils sont très proches des porte-aiguilles traditionnels. Ils ont des diamètres variables et l’extrémité active est courbe ou droite. Ils peuvent être à fermeture passive, par ressort, ou active par crémaillère. Certains plus récents ont une poignée palmaire, améliorant la tenue et permettant une ouverture et une fermeture faciles.
6-les instruments à fonctions multiples
Le Triton a été mis au point par Hubert Manhès. Cet appareil original permettait à la fois la section-coagulation des tissus par l’intermédiaire d’une micropointe rétractile, le lavage sous pression et l’aspiration. Actuellement, de nombreux constructeurs fabriquent des instruments multifonctionnels articulés autour des fonctions de lavage-aspiration et électrochirurgicales.
En fait, le nombre des instruments chirurgicaux destinés au chirurgien endoscopique s’accroît de jour en jour. Cependant il faut répéter que le chirurgien expérimenté n’utilise le plus souvent que peu d’instruments; 90% de la chirurgie endoscopique gynécologique peut être réalisée avec cinq instruments: des ciseaux courbes, deux grip-pinces, une bipolaire et un système de lavage- aspiration.
7-Système de lavage-aspiration
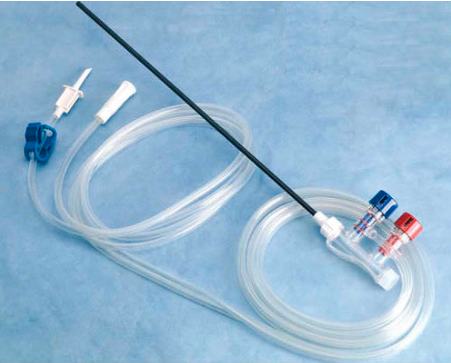
En coeliochirurgie, l’aspiration équivaut à la compresse laparotomique. La canule d’aspiration doit donc être sur le site opératoire en prévision de son utilisation avant les instruments de section et d’hémostase. Elle est en particulier indispensable dans le traitement coeliochirurgical des grossesses extra-utérines et de certains kystes ovariens (tératomes kystiques bénins et endométriomes). En général, le tuyau d’aspiration présente un diamètre de 8-10 mm et se connecte à une poche de recueil avec filtre elle-même branchée sur l’aspiration centrale du bloc. Une dépression de l’ordre de -0,6 bar est habituellement suffisante. Par ailleurs, l’eau assure plusieurs rôles qui sont: la vision, l’hydrodissection, la protection des tissus, l’hémostase (eau à 45 °C), la prévention des adhérences et la réanimation (réabsorption péritonéale). En pratique, l’appareil délivrant l’eau doit avoir une pression d’injection élevée de l’ordre de 1 bar. Le liquide utilisé doit être peu agressif pour les cellules péritonéales soumises au pneumopéritoine. Dans ce contexte, l’utilisation d’un soluté isotonique est préférable.
8-La canulation utérine
La canulation utérine tient une place capitale en laparoscopie gynécologique. Certes, elle nécessite le plus souvent un aide supplémentaire placé entre les jambes de la patiente. Mais elle permet de mobiliser l’utérus en améliorant ainsi de manière considérable l’exposition de l’utérus et des annexes, et en facilitant les gestes de dissection et de section par mise en tension des tissus opérés. De nombreux systèmes peuvent être utilisés. Suivant l’intervention, on choisit une simple canulation à l’aide d’un hystéromètre (stérilisation tubaire, grossesse extra-utérine), le système de Valtchev (épreuve au bleu tubaire) ou le manipulateur utérin de Clermont-Ferrand (hystérectomie)
9-Moyens d’extraction des pièces opératoires
L’extraction de pièces opératoires inférieures à 5 ou 10 mm ne pose aucun problème dans les trocarts correspondants. Les pièces kystiques sont aspirées (en réduisant à l’extrême la contamination péritonéale) et placées dans un sac endoscopique avant extraction sans contamination pariétale. Les pièces solides jusqu’à 3 ou 4 cm sont également ensachées et amenées à la paroi où elles sont morcelées dans le sac sous vision directe. Les pièces solides (fibromes le plus souvent) de plus de 4 cm sont extraites par agrandissement d’une incision abdominale, par colpotomie ou par morcellation intra-abdominale à l’aide d’un morcellateur manuel ou motorisé.

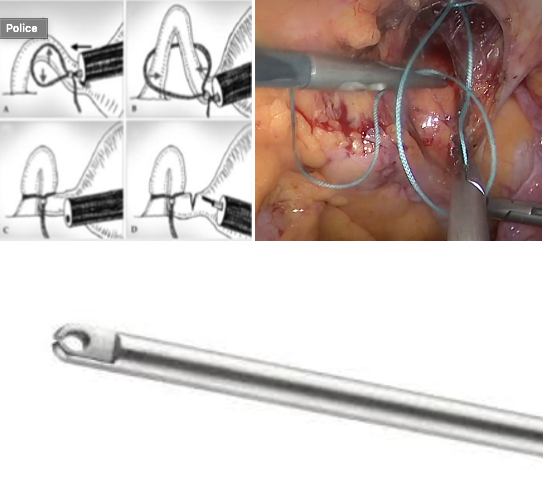
Appelés endobags en anglais, les sacs coelioscopiques sont utilisés en routine pour retirer de manière « propre » soit directement à travers la paroi soit au travers d’un trocart, des masses abdominales telles que les vésicules biliaires, les appendices, les kystes ovariens, les myomes utérins, les ovaires, les trompes, les grossesses extra-utérines ou les ganglions lymphatiques. Ainsi, lors de la manipulation et l’extraction de la pièce opératoire, ils protègent la cavité péritonéale et la paroi de la contamination bactérienne (appendicite, pyosalpinx), chimique (vésicule biliaire, kyste dermoïde), trophoblastique (grossesse extra- utérine) ou tumorale (myome, endométriome, adénopathies métastatiques, cancer ovarien méconnu). Les endobags peuvent être soit tissés, soit en plastique. Les seconds présentent l’avantage par rapport aux premiers d’être non poreux et semblent donc préférables dans la majorité des situations pour les raisons énoncées ci-dessus. De plus, une des rares études ayant comparé les propriétés physiques de ces deux types de sac a montré que les sacs en plastique étaient plus élastiques que les sacs tissés et nécessitaient moins de force pour leur extraction, ce qui au final entraînait moins de rupture du sac. Deux principes d’endobag existent: le sac libre et le panier. Le premier est préconditionné afin d’être introduit par un trocart de 10-12 mm et libéré directement dans la cavité péritonéale. Il faut alors le dérouler, l’ouvrir en écartant les berges de son ouverture circulaire, le caler et y introduire les pièces opératoires à l’aide de deux pinces à préhension, l’une tenant le sac et l’autre tenant la pièce. Pour le fermer, il faut tirer progressivement sur un fil enserrant son ouverture qui agit comme un noeud coulissant et ferme le sac de manière irréversible à mesure que le fil est tiré. Il peut être sorti par l’ouverture pariétale de n’importe quel trocart, qui pourra être agrandie si besoin. Ce système est le moins onéreux mais nécessite un peu plus d’adresse de manipulation de la part de l’opérateur. Le panier, lui, est introduit par un trocart de 10-12 mm. Il possède en général un collet métallique qui s’ouvre et se ferme de manière réversible en actionnant un tracteur externe. L’extraction se fait par le même trocart après avoir fermé le collet et resserré le fil du goulot du sac en tirant sur son tracteur externe.
Parfois, il est difficile de retirer une pièce opératoire sans recourir à une minilaparotomie.
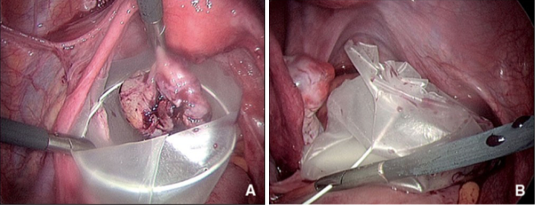
A. Introduction de la pièce opératoire. B. Fermeture du sac.
10– Scalpel endoscopique et morcellateurs
Pour faciliter l’extraction de pièces opératoires d’origine utérine, il existe plusieurs situations où le coeliochirurgien, s’il désire terminer l’intervention en coelioscopie sans convertir en laparotomie ou en voie vaginale, pourra recourir à la technique de morcellation coelioscopique. En cas d’extraction utérine par voie vaginale, le scalpel endoscopique s’avère très utile pour tailler le massif utérin réduisant ainsi son diamètre et facilitant son passage à travers la filière vaginale.
Le morcellateur électrique est en général constitué d’une lame cylindrique tournante, couplée à un moteur, introduite par le trocart de 12 mm. Une pince de Museux de 10 mm introduite à travers le cylindre agrippe la périphérie du myome, et l’amène au contact de la lame, réalisant la découpe progressive d’une carotte de tissu myomateux. Il faut toujours contrôler parfaitement la position de la lame de l’appareil de façon à ne pas risquer d’entailler un organe de voisinage.
J-Les techniques d’hémostase utilisant l’énergie
1-L’électrochirurgie
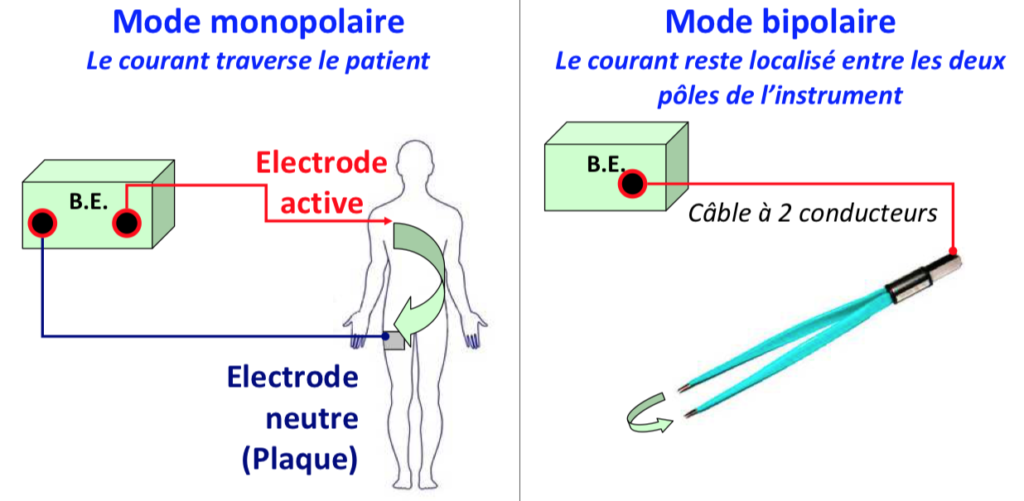
C’est un moyen efficace et économique pour réaliser une section ou une coagulation. Son utilisation est cependant subordonnée à une sécurité optimale pour le patient, les chirurgiens et le personnel de la salle d’opération. Le prix de cette sécurité est la connaissance parfaite de l’énergie utilisée en rendant son effet prévisible, reproductible et efficace. La plupart des générateurs électriques actuels possèdent deux parties distinctes : une partie monopolaire avec deux sous-groupes (un groupe coagulation et un groupe section) et une partie bipolaire. Chacun des blocs est indépendant. Ils peuvent fonctionner séparément ou ensemble. Les conditions créées par l’endoscopie trocarts, absence d’écarteurs, etc.) imposent la maîtrise par le chirurgien de certaines variables.
a-Le mode monopolaire
il impose la mise en place d’une électrode de retour correctement située. Si n’importe quel instrument conducteur peut être utilisé, celui-ci doit être correctement isolé jusqu’à sa partie active, c’est-à-dire la partie qui délivrera le courant électrique au tissu. Dans le mode monopolaire, le chirurgien peut contrôler six paramètres, développés ci-dessous.
Puissance
C’est un facteur important de la sécurité du patient. On ne peut proposer une puissance fixe, tant celle-ci est liée à la taille de l’électrode: plus celle-ci est fine, moins la puissance devra être élevée pour obtenir l’effet voulu. Cependant, nonobstant l’effet électrode et l’effet tissu (plus le tissu est conducteur moins la puissance doit être élevée), il faut garder à l’esprit que si au cours d’une intervention, la coagulation ou la section diminuent sans qu’aucune modification n’aient été portée aux réglages du générateur, plutôt qu’augmenter la puissance, il faut rechercher un défaut apparu sur le circuit électrique (surtout au niveau de la plaque de retour). En pratique, on travaille en électro-cceliochirurgie avec des puissances de l’ordre de 35 à 45 W.
Nature de l’onde électrique
Pour obtenir une section ou une coagulation, le générateur délivre des ondes électriques différentes dans leur rythme et dans leur voltage. Plus le voltage est élevé, plus le risque d’arc électrique est grand, donc plus le danger est élevé pour les patients. Si on compare les différents voltages, on s’aperçoit que la section monopolaire est de bas voltage de l’ordre de 2000 à 3 000 V, alors que la coagulation monopolaire utilise des voltages de l’ordre de 3000 à 9 000 V. Il est clair que si le mode coagulation est utilisé en monopolaire, il faut utiliser la coagulation de plus faible voltage possible, soit la dessiccation encore appelée «coagulation basse tension ». En pratique, on évite tout simplement de travailler en mode coagulation monopolaire.
Forme de l’électrode
L’effet tissulaire est différent suivant qu’on utilise une pointe monopolaire ou une spatule. Plus l’électrode est fine, plus la densité de puissance est grande. Certaines formes d’ondes électriques permettent de « jouer» avec la forme de l’électrode. C’est le cas des courants mixtes. Avec ces courants, plus l’électrode est fine, plus la section est forte, plus l’électrode est large, plus la composante coagulation est favorisée. Certaines électrodes deviennent alors intéressantes. Une pointe fine sera utilisée pour délivrer uncourant de section précis et puissant par exemple nécessaire à la réalisation d’une salpingotomie lors du traitement cceliochirurgical d’une grossesse extra-utérine. La spatule permet, quant à elle, d’appliquer le courant sur une plus grande surface en même temps, permettant d’obtenir un effet coagulant.
Arc électrique
On peut le comparer aux décharges électriques arborescentes émanant de la foudre lors d’un orage. Le pneumopéritoine étant un milieu aérien fermé et humide, le courant électrique peut s’y propager sous la forme d’arc électrique, notamment pour des voltages élevés.
Temps d’application
Le temps d’application du courant monopolaire détermine l’extension de l’effet. Plus celui- ci est long, plus les effets tissulaires sont majorés. Ainsi, une section peut être trop profonde et lors d’une coagulation, les dommages tissulaires périphériques trop importants.
Nature du tissu
Suivant la nature du tissu, le chirurgien modifie les paramètres électriques utilisés. Il est évident qu’un effet de section est plus efficace sur la peau ou le muscle (tissu possédant une composante aqueuse donc agissant comme un conducteur important) que sur la graisse (tissu peu conducteur). Ce phénomène est bien connu lors des incisions pariétales des laparotomies.
Façon d’appliquer l’énergie
Le chirurgien peut, avec un courant donné, privilégier telle ou telle composante de l’effet électrique en modifiant la façon d’appliquer l’énergie. Ce contrôle est évident lors de l’utilisation des courants mixtes. En sélectionnant un courant mixte et en enchaînant les gestes de manière différente, l’effet obtenu s’inverse.
– Pour une section : mettre en tension les tissus, activer le courant puis toucher le tissu;
– Au contraire, avec le même courant, pour obtenir une coagulation : relâcher les tissus, toucher le tissu puis activer le courant.
b-Le mode bipolaire
Lors de son utilisation, les paramètres contrôlables par le chirurgien sont moins nombreux. Cependant, si aucun risque de couplage n’existe, le risque de brûlure de proximité reste réel et impose la maîtrise de cette énergie. La pince bipolaire est un instrument spécifique de ce type d’énergie. En d’autres termes, à l’opposé du mode monopolaire, tout instrument conducteur ne peut être utilisé. Les deux mors de la pince doivent être convenablement isolés l’un de l’autre jusqu’à leur extrémité active. La fermeture de la pince sur le tissu boucle le circuit électrique. Si la pince est fermée sans qu’aucun tissu ne soit interposé, l’activation de la pédale crée un court-circuit avec échauffement de l’extrémité de la pince. Plusieurs facteurs sont tout de même contrôlables. Ils sont développés ci-dessous.
Taille de l’électrode
Il existe plusieurs formes d’extrémité de pince. Les plus connues sont la forme habituelle type Kleppinger, où les deux mors sont crantés et mus par une force élastique, et la pince simple où les deux mors sont lisses et sont rapprochés en fermant la poignée. Dans ce type de pince, il existe deux largeurs classiques: 1 et 3 mm. Plus l’électrode est fine plus la coagulation est précise, moins les dégâts tissulaires périphériques sont importants et moins une puissance élevée est nécessaire. Au contraire, une extrémité large provoque un effet tissulaire important, ce qui peut être le souhait du chirurgien lors de la coagulation d’un vaisseau important. En pratique, il faut savoir qu’il existe un échauffement thermique important jusqu’à 1 cm de part et d’autre de la pince.
Puissance
Du fait du faible risque électrique en mode bipolaire, une forte puissance ne présente pas de danger important. Cependant, il faut comprendre que plus la puissance est grande plus l’impédance entre les mors de la pince va être forte. Une trop forte puissance conduirait à la survenue d’arc électrique et de carbonisation. Ces deux effets augmentent le risque de brûlure de proximité et entraînent l’adhérence des tissus à la pince.
Temps d’application
Le temps d’application du courant détermine l’effet final. Une application trop courte aboutit à une dessiccation (destruction tissulaire) trop faible, une application trop longue provoque l’adhérence des tissus à la pince et une extension des effets périphériques. C’est ainsi que de nombreux générateurs sont pourvus d’un système d’arrêt automatique ou de baisse de puissance automatique. En fait, la technique d’utilisation de la bipolaire doit être stricte. Après avoir appliqué la coagulation, l’opérateur doit couper prudemment le tissu coagulé jusqu’à la rencontre d’un tissu rosé témoignant de l’insuffisance de la dessiccation. Il doit alors, avant de couper plus encore, procéder à une nouvelle application de la pince bipolaire.
Tissu concerné
La coagulation bipolaire entraînant un échauffement important des tissus entre les deux mors de la pince, certains tissus (les veines par exemple) éclatent facilement produisant un effet contraire à celui désiré. Il faut, dans ce cas, appliquer la coagulation avec une puissance faible, en prenant dans la pince une quantité de tissu relativement importante.
c-Complications liées à l’utilisation des bistouris électriques
Complications potentielles de l’utilisation du bistouri électrique :
- Complications de la coagulation bipolaire. Elles sont peu fréquentes car le trajet est parfaitement défini. Les complications sont essentiellement provoquées par l’augmentation inadéquate de la durée de coagulation qui peut entraîner des lésions des tissus voisins. Cette complication survient essentiellement lors d’une coagulation « en masse », sa prévention est donc une dissection parfaite et élective des éléments à coaguler.
- Complications du mode monopolaire. Celles-ci sont bien plus nombreuses que lors de l’utilisation du mode bipolaire. La plus fréquente est un défaut d’isolation de l’instrument servant à la coagulation. Il peut alors de produire des brûlures des tissus voisins en contact avec l’instrument, surtout lorsqu’il n’est pas visible en totalité (ce défaut d’isolation peut être suspecté en cas de nécessité d’augmenter la puissance du générateur en raison d’une coagulation peu efficace), de même lorsque l’électrode est en contact avec un instrument métallique non visible dans le champ optique.
L’existence de courants de fuite diffusant vers des zones de moindre résistance peut entraîner une coagulation des tissus situés à distance de la zone opérée (risque de fistule secondaire) et de la peau du patient si elle est en contact avec un objet métallique.
Le couplage capacitif réalise la reconstitution d’un condensateur par les couches métalliques et isolantes des instruments, ce « condensateur » génère un courant induit qui peut se décharger au contact des tissus entraînant une lésion thermique.
Le bistouri électrique peut aussi entraîner un arrêt du fonctionnement d’un stimulateur cardiaque.
2-Thermofusion-Ligasure
Cette technologie combine le mode bipolaire et l’analyse en temps réel du tissu cible afin de produire une hémostase tissulaire adaptée et définitive. Elle a été développée pour permettre une carbonisation minimale et la réduction des dommages thermiques adjacents par rapport au mode bipolaire classique. Basé sur la coagulation bipolaire, ce système délivre au vaisseau un courant élevé (4 A) et un faible voltage « 200 V). L’élévation thermique engendrée entraîne une dénaturation du collagène et de l’élastine de la paroi vasculaire. La force appliquée aux tissus par les mors de la pince comprime les parois du vaisseau l’une contre l’autre qui fusionnent, ce qui occlut la lumière du vaisseau. Le générateur mesure l’impédance et la résistance au contact de l’électrode et arrête automatiquement de délivrer l’énergie une fois la fusion atteinte. Certains dispositifs disposent d’une lame froide intégrée qui permet de réaliser la section du vaisseau sans avoir à changer d’instrument. Là encore, cela oppose ces instruments aux pinces bipolaires classiques. La lame est activée manuellement après avoir réalisé la coagulation. Etant donné que pour se faire la pince n’est pas relâchée, la lame sectionne uniquement la zone coagulée. Les deux temps de la coagulation-section nécessaires sont respectés. Les plus connus des instruments de thermofusion ont été conçus par la société Valleylab (aujourd’hui Covidien) : il s’agit de la gamme LigaSure. A ce jour, de nombreux dispositifs de tailles et formes variées ont été développés par différents laboratoires permettant leur utilisation en routine dans ungrand nombre d’interventions chirurgicales, ouvertes ou cœlioscopiques. Ce sont des appareils multifonctionnels permettent la dissection des plans tissulaires, la préhension atraumatique des tissus, leur coagulation et, dans le cas de dispositifs avec lame froide intégrée, leur section. Deux tailles de LigaSure® (5 et 10 mm de diamètre). sont disponibles pour l’endoscopie et il existe également un modèle de 10 mm de diamètre avec une lame incorporée pour sectionner le tissu après la coagulation. Le système LigaSure® est acceptable pour la coagulation de vaisseaux allant jusqu’à 7 mm de diamètre.

3-Ultracision
Le développement des bistouris à ultrasons a été généré par le besoin d’une alternative à l’électrochirurgie afin d’améliorer l’efficacité de la dissection cœlioscopique et réduire la morbidité due aux lésions thermiques collatérales. Le système Ultracision® emploie l’énergie ultrasonore pour réaliser la coagulation et la section des vaisseaux. Le principe repose sur la transformation de l’électricité en vibrations ultrasonores à haute fréquence (environ 55 kHz) qui seront transmises à la pince située à l’extrémité de l’instrument. Ainsi, à la différence de l’électrochirurgie, l’électricité ne traverse jamais le corps du patient. C’est l’énergie mécanique produite par les vibrations ultrasonores du dispositif qui va entrainer le processus simultané de coupe et de coagulation. La coagulation se fait par la dénaturation des liaisons d’hydrogène et des protéines du vaisseau entraînant la formation d’un coagulat qui va occlure la lumière du vaisseau. Les températures atteintes sont de l’ordre de 50 à 100°C contre 150°C en moyenne pour la coagulation bipolaire. Le bistouri est relié au générateur par le transducteur piézo-électrique. C’est ce dernier qui est responsable de la transformation de l’électricité en vibrations ultrasonores. L’activation du bistouri se fait via une commande manuelle (1 bouton avec 2 crans d’activation ou 2 boutons séparés) ou pédestre (2 pédales), selon les dispositifs. Un seul des deux mors de la pince vibre sous l’effet des vibrations ultrasonores, l’autre mors reste fixe.
Les différents effets tissulaires induits par les bistouris à ultrasons diffèrent au cours du temps et de la montée en température:
*Dans un premier temps, le phénomène de cavitation peut se produire (50°C).
La cavitation correspond à la vaporisation des fluides du tissu ciblé. Les liquides intracellulaires sont vaporisés de part et d’autre du mors vibrant et cette expansion de vapeur d’eau entre les plans tissulaire entraine l’écartement de ces derniers. La cavitation facilite donc la dissection. La cavitation est favorisée lorsque la pression exercée par les mors du bistouri est faible et/ou que la fréquence de vibrations est basse.
*Dans un second temps, c’est la coagulation (60-100°C).
Le mécanisme de base de la coagulation est similaire à l’électrochirurgie: les vaisseaux sont comprimés et occlus par des protéines dénaturées. Ce qui diffère, c’est la manière dont les protéines sont dénaturées. Dans le cas de dispositifs à ultrasons, les vibrations brisent les liaisons hydrogène entre les chaines de collagène et les protéines de la matrice extracellulaires. Celles-ci se fragmentent et se dissolvent dans l’eau, produisant ainsi un gel hémostatique au sein du vaisseau. De façon générale, les protéines commencent à se dénaturer à partir de 60°C environ. La chaleur étant délivrée graduellement par le bistouri à ultrasons et restant inférieure à 100°C, cela permet la création du gel hémostatique insoluble et réduit le risque de lésions thermiques latérales.
*Enfin, dans un troisième temps, intervient la section (100 -150°C).
Le mécanisme de coupe fait suite à la coagulation. Il diffère de l’électrochirurgie puisque les tissus sont sectionnés mécaniquement par une lame vibrant à une fréquence de 55 kHz sur une distance d’environ 80 à 100μm. Lorsque le mors vibre, le liquide cellulaire est comprimé puis décomprimé par la lame à la fréquence ultrasonique. Quand le liquide est décomprimé, une pression négative est générée et le liquide s’étend. Des milliers de bulles d’air se forment alors dans le liquide. Et lorsqu’il est comprimé à nouveau, ces bulles éclatent en émettant une onde de choc suffisamment puissante pour fragmenter le tissu cible.
Au cours de l’utilisation, la lame active doit être positionnée en dessous du tissu cible et le mords opposé doit être au-dessus. Le tissu ciblé est saisi et doucement levé pour le tendre entre les mords du dispositif; cela applique une tension et facilite la section et la coagulation. Plus la tension appliquée sur le tissu et la puissance réglée sera importante, plus la coupe sera rapide. A l’inverse, pour favoriser plutôt l’hémostase, le réglage de puissance et la tension appliquée sur le tissu cible devront être moindres. En raison de la diffusion thermique latérale, une distance de quelques millimètres entre le lieu de saisi et les organes fragiles doit être respectée. Le chirurgien doit aussi penser lors des manipulations que la lame active des ciseaux ultrasoniques reste chaude après usage (même après arrêt de l’appareil), elle peut donc endommager des tissus sains ou les mains des opérateurs en cas de contact involontaire.
Ces procédés ultrasonores, qui existent en modèles de 5 et 10 mm de diamètre, présentent plusieurs avantages par rapport aux systèmes classiques d’électrochirurgie: moindre dispersion d’énergie thermique aux tissus environnants avec un moindre risque de lésions de proximité, double action de coagulation et section des tissus ce qui apporte le bénéfice d’un outil multifonction en diminuant le trafic des instruments à travers les trocarts, et absence de production de fumée donc meilleure vision et moindre toxicité péritonéale. L’effet obtenu est contrôlé par le chirurgien qui ajuste la puissance du générateur, l’épaisseur de la prise, la pression des mors et le temps d’application. Ce système est acceptable pour le traitement de vaisseaux mesurant jusqu’à 3 mm de diamètre alors que les clips (titane ou plastique), les agrafes, les pinces bipolaires ou les instruments de thermofusion pouvaient être utilisés sur des vaisseaux allant jusqu’à 6-7 mm de diamètre.
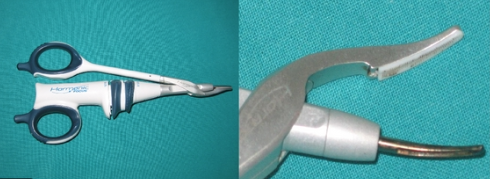
K-Les procédés mécaniques
1-Les clips à hémostase
La pose de clips en titane sur les vaisseaux crée une obstruction mécanique et pose peu de problème pour les tissus environnants lorsqu’ils sont appliqués avec précision. Toutefois, même s’ils conduisent à la formation d’un joint fiable, ils comportent le risque de se déplacer lors de la manipulation des tissus. Leur utilisation implique une dissection très précise des vaisseaux et ils peuvent gêner la suite de la dissection du fait de leur volume. Les clips en plastique sont confectionnés avec une surface crantée pour surseoir au problème de déplacement mais ils présentent les autres inconvénients sus-cités.

2-les agrafes
Les agrafeuses permettent l’hémostase par mise en place automatisée de plusieurs rangées d’agrafes sur le tissu ciblé. Ces rangées peuvent être linéaires ou circulaires, selon le type d’agrafeuse. La taille des agrafes utilisées dépend de l’épaisseur du tissu ciblé et de la présence de vaisseaux sanguins. Elles peuvent être résorbables ou non. Certaines agrafeuses permettent de réaliser la section tissulaire directement après agrafage grâce à la présence d’une lame froide à activation manuelle dont la trajectoire est localisée au cœur des lignes d’agrafes. Après utilisation, les agrafeuses doivent être rechargées. De façon générale, l’indication majeure des agrafeuses est la résection de tissu (appendicectomie, sleeve-gastrectomie ou tumorectomie par exemple) ou la réalisation d’une jonction entre deux conduits (exemple de l’anastomose termino-terminale entre le colon et le rectum lors d’une colectomie gauche).
3-les ligatures
Il existe des boucles de fil préformées (exemple EndoloopTM). Ces dispositifs peuvent être utilisés pour ligaturer un vaisseau ou un conduit, mais cela nécessite de relâcher brièvement ce dernier le temps de positionner la boucle. La pression exercée doit rester douce de façon à ne pas scier le vaisseau ou le conduit. Le noeud peut également êtreréalisé en extra-corporel et glissé dans l’abdomen à l’aide d’un pousse-noeud. Le plus souvent les noeuds sont réalisés dans la cavité abdominale à l’aide de deux pinces, créant une boucle, comme cela se fait hors du ventre. cette technique nécessite un peu d’entrainement.