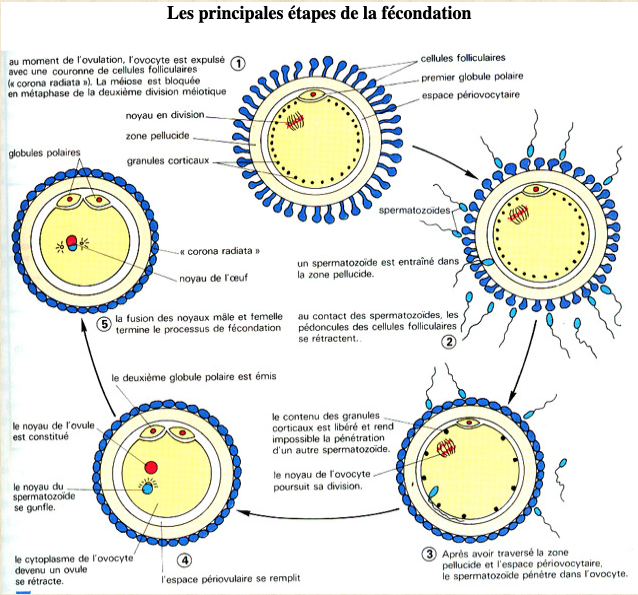
Le premier stade du développement est la formation d’un embryon. Il s’agit d’une structure microscopique qui se forme et se développe à l’intérieur du corps de la femme.
L’embryon humain est le résultat de la rencontre et de la fusion de deux cellules reproductrices: l’ovocyte produit par l’ovaire de la femme et un spermatozoïde apporté par l’homme au cours du rapport sexuel. La pénétration d’un spermatozoïde dans l’ovocyte, constitue la fécondation. Cette rencontre est l’étape initiale de la formation d’un embryon. Quelques notions d’anatomie de l’appareil génital chez la femme et chez l’homme sont nécessaires pour comprendre le mécanisme de la fécondation.
Les organes de la reproduction
A-Chez la femme
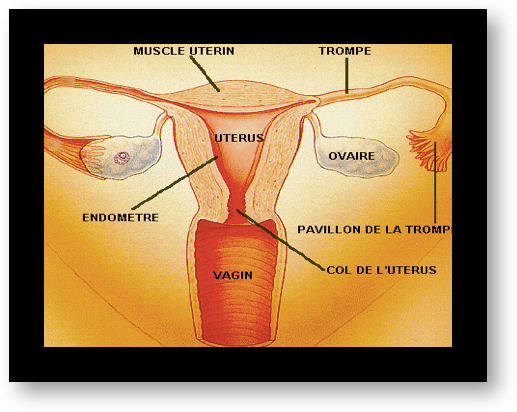
Chez la femme, les organes de la reproduction sont les ovaires (aussi appelés gonades), l’utérus avec ses trompes et le vagin. Les cellules reproductrices appelées gamètes féminins ou ovocytes se développent dans les ovaires. Il y a deux ovaires, un droit et un gauche. L’ovaire produit des follicules, un par cycle, devenant mature et lorsqu’il se rompt à la surface de l’ovaire provoque l’ovulation.
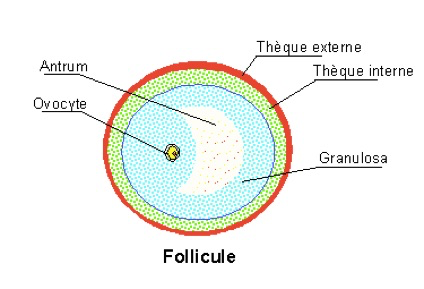
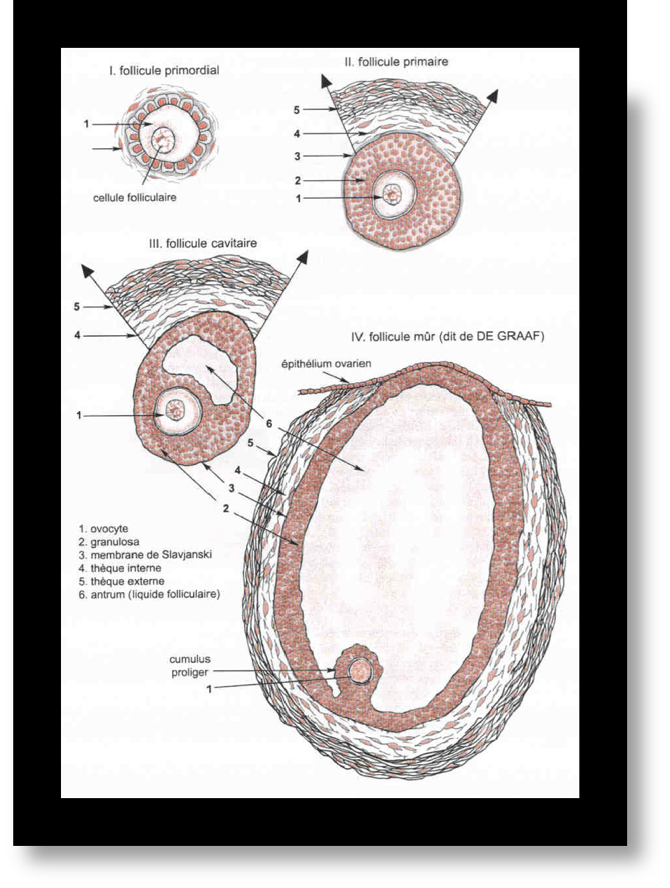
La structure du follicule doit être connue
Chaque follicule est constitué d’une cellule germinale qui donnera l’ovocyte destiné à la fécondation. Cette cellule germinale est entourée de eux couches cellulaires : la granulosa et la thèque en périphérie. La thèque se différenciera ensuite en thèque interne et thèque externe (Fig1).
Les trompes
sont des tubes très fins qui recueillent les ovocytes expulsés par les ovaires lors de l’ovulation.La rencontre de l’ovocyte avec le spermatozoïde se fait à l’intérieur des trompes. L’embryon ainsi formé migre à l’intérieur des trompes jusqu’à l’utérus où il va s’implanter. Cette migration est favorisée par les mouvements de petits cils à l’intérieur des trompes et nécessite donc une intégrité de la muqueuse tubaire. Des anomalies de cette muqueuse peuvent arrêter la progression de l’œuf fécondé et favoriser l’implantation anormale, dans la trompe, de l’embryon : c’est une grossesse extra-utérine.
L’utérus
est un organe creux en forme de poire (Fig.2). Sa partie basse, plus étroite, constitue le col, sa partie haute plus large est appelée le corps de l’utérus. Le col est traversé par un canal, le canal cervical par lequel les spermatozoïdes émis lors du rapport sexuel remontent vers les trompes. Des petites glandes situées dans la paroi du col sécrètent un liquide visqueux appelé glaire cervicale qui favorise la sélection des spermatozoïdes mobiles. La glaire ne doit pas être trop épaisse sinon les spermatozoïdes ne peuvent pas la traverser. La glaire change de consistance au cours du cycle normal de la femme et sa qualité est influencée par les sécrétions hormonales. Elle ne se laisse traverser par les spermatozoïdes que quelques jours par mois, ceux pendant lesquels la fécondation a le plus de chances de se produire.
B-Chez l’homme
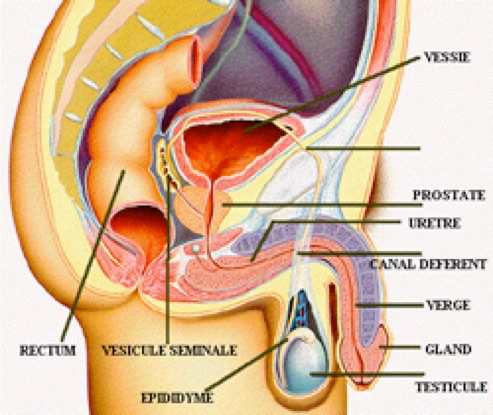
Les testicules
Les testicules sont des organes pairs et symétriques situés à l’extérieur du pelvis afin d’être à une température inférieure à celle de l’abdomen (2°C en moins). Chaque testicule adulte mesure environ 3 cm de haut, 2 cm de large et 5 cm de profondeur pour un poids d’environ 18 g. (Fig.3)
Les testicules comportent une coque lisse et blanc nacré appelée albuginée, elle est épaisse, solide et inextensible. Sur ses faces latérale et caudale, le testicule est entouré par une « cavité vaginale testiculaire ».
Au sommet du testion retrouve l’epididyme séparé du testicule par le «sillon épididymaire». À son pôle caudal, le testicule est fixé au scrotum par le gubernaculum testis.
L’épididyme
L’épididyme est un conduit de 6 mètres de long mais qui est pelotonné donnant une structure en forme de virgule
Les spermatozoïdes immatures et pratiquement immobiles qui quittent le testicule séjournent un certain temps dans l’épididyme pour un parcours sinueux qui prend 20 jours environ pour faire ces 6 mètres. C’est au cours de ce trajet qu’ils deviennent mobiles et féconds. Quand la stimulation sexuelle conduit à l’éjaculation, le muscle lisse des parois de l’épididyme se contracte vigoureusement, ce qui expulse les spermatozoïdes présents dans la queue de l’épididyme vers un autre segment des voies spermatiques, le conduit déférent.
Le canal déférent
Le canal déférent mesure 45 cm de long. Il s’étend vers le haut à partir de l’épididyme et passe dans le canal inguinal pour entrer dans la cavité pelvienne. Il se courbe ensuite au-dessus de l’uretère, avant de redescendre le long de la face postérieure de la vessie. Son extrémité terminale s’élargit pour former l’ampoule du conduit déférent et s’unit au conduit excréteur de la vésicule séminale pour former le court canal éjaculateur. Chaque canal éjaculateur pénètre dans la prostate, où il déverse son contenu dans l’urètre. La principale fonction du canal déférent est de conduire les spermatozoïdes vivants de leurs sites de stockage, l’épididyme et la portion distale du conduit déférent, jusqu’à l’urètre. Au moment de l’éjaculation, les épaisses couches de muscle lisse de ses parois créent des ondes péristaltiques qui poussent rapidement les spermatozoïdes vers l’urètre.
L’urètre
L’urètre est la portion terminale des voies spermatiques. Il fait partie du système urinaire et du système génital : selon les circonstances, il transporte l’urine ou le sperme jusqu’à l’extrémité du pénis.
Les glandes annexes
Les glandes annexes sont les deux vésicules séminales, les deux glandes bulbo-urétrales et la prostate. Ces glandes produisent la majeure partie du sperme (composé des spermatozoïdes et des sécrétions des glandes et des conduits annexes).
Les vésicules séminales
Les vésicules séminales reposent sur la paroi postérieure de la vessie. Ce sont d’assez grosses glandes, chacune ayant approximativement la forme et la longueur d’un doigt (5 à 7 cm). Leur sécrétion, qui constitue environ 60 % du volume du sperme, est un liquide alcalin visqueux et jaunâtre renfermant du fructose (un sucre), de l’acide ascorbique et des prostaglandines. Les spermatozoïdes et le liquide séminal se mélangent dans le canal éjaculateur et pénètrent ensemble dans l’urètre prostatique au moment de l’éjaculation.
La prostate
La prostate est une glande unique de la grosseur et de la forme d’un marron ; elle entoure la partie supérieure de l’urètre, située directement sous la vessie. La sécrétion de la prostate forme jusqu’à un tiers du volume du sperme et joue un rôle dans l’activation des spermatozoïdes.
Les glandes bulbo-urétrales
Les glandes bulbo-urétrales (glandes de Cowper) sont de petites glandes de la grosseur d’un pois situées sous la prostate. Elles produisent un épais mucus translucide qui s’écoule dans l’urètre spongieux. Cette sécrétion est libérée avant l’éjaculation; on pense qu’elle neutralise l’acidité des traces d’urine encore présentes dans l’urètre.
Le pénis
Le pénis est l’organe de la copulation, destiné à déposer les spermatozoïdes dans les voies génitales de la femme. Le pénis comprend une racine fixe, et un corps mobile se terminant par une extrémité renflée, le gland du pénis. La peau du pénis est lâche et glisse vers l’extrémité distale pour former un repli de peau appelé prépuce autour de l’extrémité proximale du gland.
Le sperme
Le sperme est le liquide blanchâtre légèrement collant qui renferme les spermatozoïdes et les sécrétions des glandes accessoires. Ce liquide est le milieu de transport des spermatozoïdes; il contient des nutriments ainsi que des substances chimiques protégeant et activant les spermatozoïdes, en plus de faciliter leurs déplacements. Les spermatozoïdes mûrs possèdent peu de cytoplasme et de réserves de nutriments.Le fructose présent dans la sécrétion des vésicules séminales constitue presque leur seul combustible. La quantité de sperme projetée à l’extérieur de l’urètre au cours d’une éjaculation est relativement petite (de 2 à 6 ml), mais chaque millilitre contient entre 50 et 100 millions de spermatozoïdes.
Le rapport sexuel
Le pénis (ou verge) est l’organe qui permet le rapport sexuel, ou coït. Lors du rapport, les tissus qui le composent se remplissent de sang. La verge s’allonge, devient rigide et la pénétration dans le vagin devient possible. Le sperme est émis au fond du vagin près de l’orifice du col utérin, c’est l’éjaculation.
A chaque rapport sexuel, l’homme éjacule dans le vagin des millions de spermatozoïdes qui devront traverser la glaire du canal cervical, passer le col de l’utérus puis remonter jusqu’aux trompes où s’effectuera la rencontre avec l’ovocyte. Un seul spermatozoïde, parmi des millions, pénétrera dans l’ovocyte.
Fonctionnement de ces organes chez la femme
Le fonctionnement des organes génitaux n’est pas autonome ; il est très étroitement contrôlé à distance, par le cerveau et par diverses glandes qui sécrètent des hormones. Ces mécanismes de contrôle sont essentiels à connaître parce qu’ils donnent aux médecins les moyens qui leur permettent d’intervenir en cas de dérèglement.
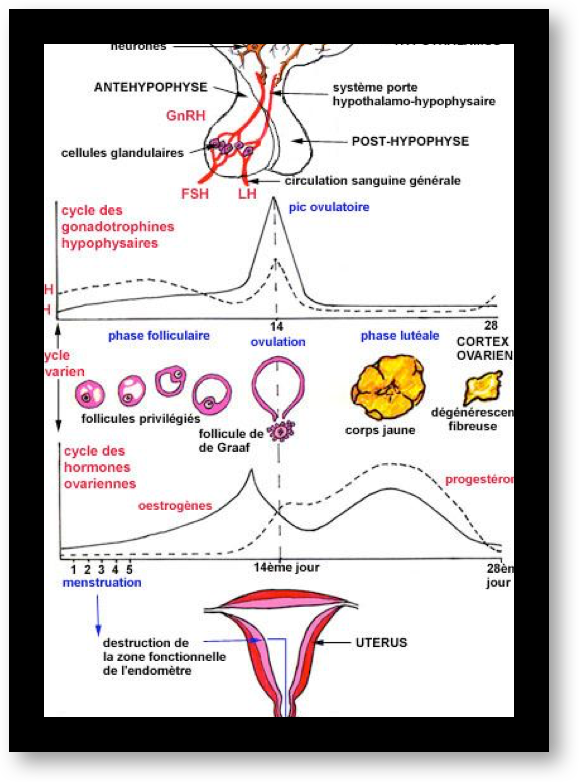
Le cycle menstruel correspond à l’ensemble des modifications qui rendent l’appareil génital féminin périodiquement apte à l’installation d’une grossesse. Les règles ou menstruations sont la partie la plus visible d’une cascade d’actions hormonales. Les cycles menstruels qui apparaissent à la puberté traduisent une activité des ovaires. Cette activité est régulée par des hormones sécrétées par une petite glande située sous le cerveau, l’hypophyse, qui est elle-même sous la dépendance de l’hypothalamus.
Les ovaires sécrètent principalement des estrogènes, de la progestérone, des androgènes.
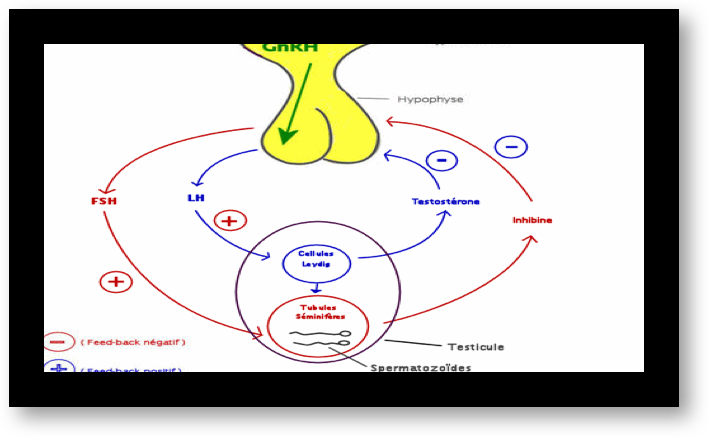
L’hypophyse secrète des « gonadotrophines », hormones qui vont agir sur les gonades (Fig.4). Il y a deux gonadotrophines, désignées par les abréviations d’origine anglaise : FSH et LH. Elles sont transportées, dans le sang circulant, de l’hypophyse jusqu’aux deux ovaires où elles provoquent divers effets, suivant une séquence bien établie.
L’hypothalamus qui est situé à la base du cerveau libère lui ce que l’on appelle une neuro-hormone : qui porte différents noms désignant la même chose : le Gn-RH (gonadotropin releasing hormon) ou LH-RH ou encore FSH-LH-RH. Ce Gn-RH agit sur l’hypophyse.
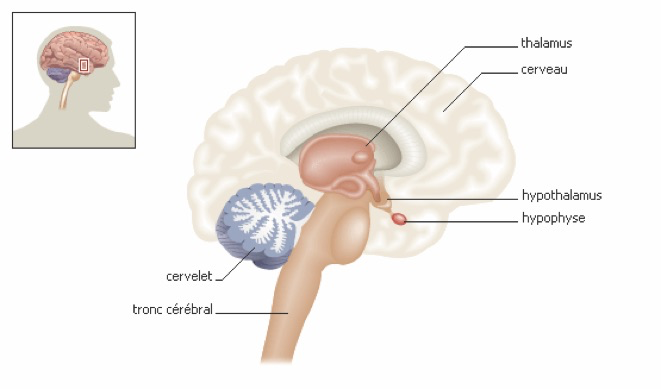
La sécrétion de Gn-RH est pulsative et si cette pulsativité disparait, l’effet sur les sécrétions hypophysaires s’arrête. Ce phénomène est utilisé dans certains protocoles de fécondation in vitro. L’activité de l’hypothalamus est contrôlée de manière complexe par l’action rétro-active des hormones ovariennes, des hormones hypophysaires, par l’hypothalamus lui-même mais aussi par le système nerveux : action de la dopamine, de la noradrénaline, de la sérotonine, des peptides cérébraux, des endorphines, etc. cela peut expliquer des cas d’aménorrhée d’origine psychogène.
La sécrétion des gonadotrophines hypophysaires, FSH et LH est sous la dépendance, non seulement du Gn-RH hypothalamique, mais aussi des autres hormones hypophysaires (comme celles qui contrôlent les surrénales, la thyroïde, la prolactine) et surtout des hormones ovariennes, principalement estrogènes et une hormone ovarienne particulière, l’inhibine.
Au cours de la première partie du cycle, l’hypophyse sécrète de l’hormone FSH et, un peu plus tard, l’hormone LH. L’augmentation brutale de la concentration en hormone LH dans le sang (le pic de LH) entraîne l’ovulation. Ces hormones provoquent la sécrétion d’estrogènes et de progestérone par les ovaires.
Ces deux dernières ont un effet inhibiteur sur l’hypophyse ; la fabrication de FSH et LH est interrompue. Mais, sans ces deux hormones, la fabrication des estrogènes et de la progestérone s’interrompent. Finalement, suite à cette interruption, l’inhibition de l’hypophyse est levée… et le cycle peut recommencer (Fig.5).
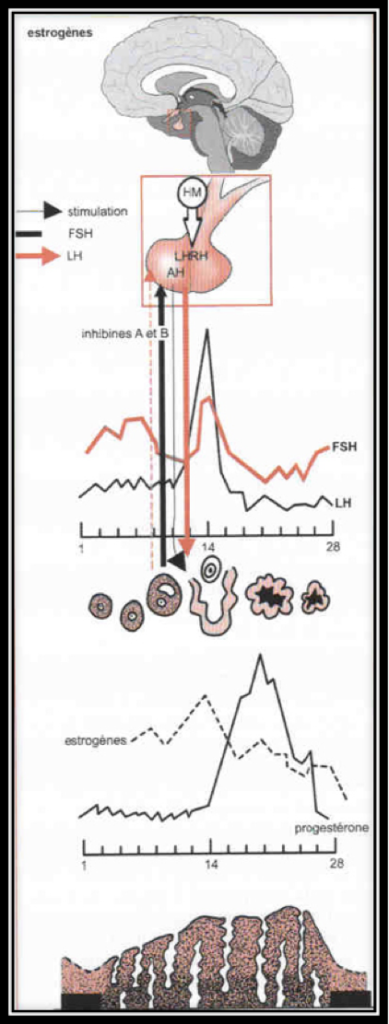
Les seules hormones ovariennes sécrétées lors de la première moitié du cycle féminin sont les estrogènes. Celles-ci provoquent une croissance en épaisseur de l’endomètre. Son épaisseur est mesurable en échographie. L’estradiol sécrété par le follicule est transporté jusqu’à l’hypophyse. En fonction du taux d’estradiol, l’hypophyse libère une quantité plus ou moins importante de FSH qui va, à son tour, réguler l’activité de l’ovaire. Ce phénomène de rétrocontrôle est
communément appelé feed-back. La croissance et le développement du follicule dépendent de la présence de FSH, de LH et des estrogènes.
L’ovulation est annoncée par un pic d’estradiol, aussitôt suivi par le pic de LH (Fig.6 et 7). Lorsque l’ovulation survient, la rupture folliculaire réduit momentanément les capacités sécrétoires du follicule, d’où une baisse sensible du niveau des estrogènes. Dès l’ovulation faite, le corps jaune qui se forme après l’ovulation dans l’espace libéré par l’ovocyte à la surface de l’ovaire est responsable de la sécrétion d’estrogènes et de progestérone qui apparait seulement maintenant (Fig.8). C’est la progestérone qui est responsable de l’augmentation de température observable en deuxième partie de cycle sur une courbe de température. Cette action synergique des estrogènes et de la progestérone ont une action bien précise sur l’endomètre qui pour faire court va devenir apte à l’éventuelle implantation d’un œuf. S’il n’y a pas d’implantation le corps jaune va involuer après une durée de vie remarquablement fixe de 12 à 14 jours à l’issue desquels il provoque une chute brutale des taux d’estrogènes et de progestérone elle-même à l’origine de la menstruation. Par contre, s’il y a implantation d’un œuf dans l’endomètre ainsi préparé, les cellules du trophoblaste entourant cet œuf sécrètent de l’HCG (Human Chorionic Gonadotropin) dont la détection est à la base des tests de grossesse. Cet HCG a des effets biologiques comparables à la LH (d’où son utilisation dans le déclenchement artificiel de l’ovulation). Le corps jaune va alors être sauvé de sa disparition programmée grâce aux effets de l’HCG. Il va secréter des quantités croissantes d’estrogènes et de progestérone. Endomètre et embryon sont ainsi maintenus en place par ces hormones. Le rôle du corps jaune va être capital pour le maintient de la grossesse pendant les deux premiers mois. Ensuite, ce sera les sécrétions hormonales provenant du placenta qui prendront le relai et permettront la poursuite de la grossesse.
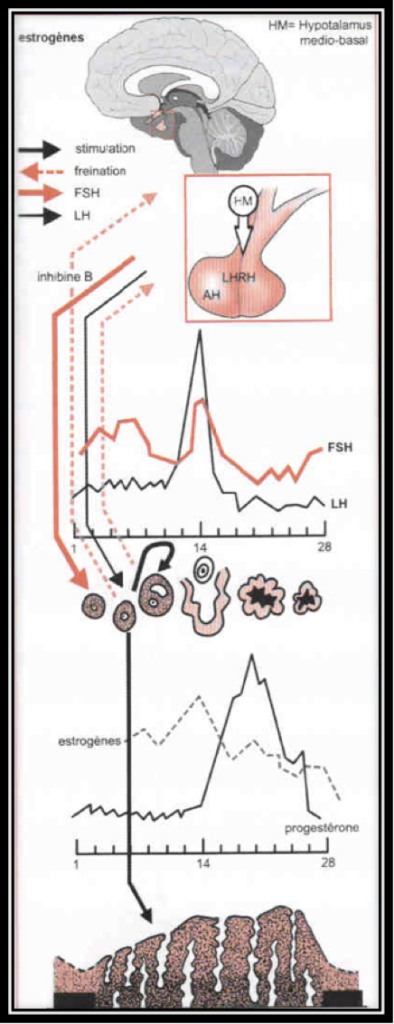
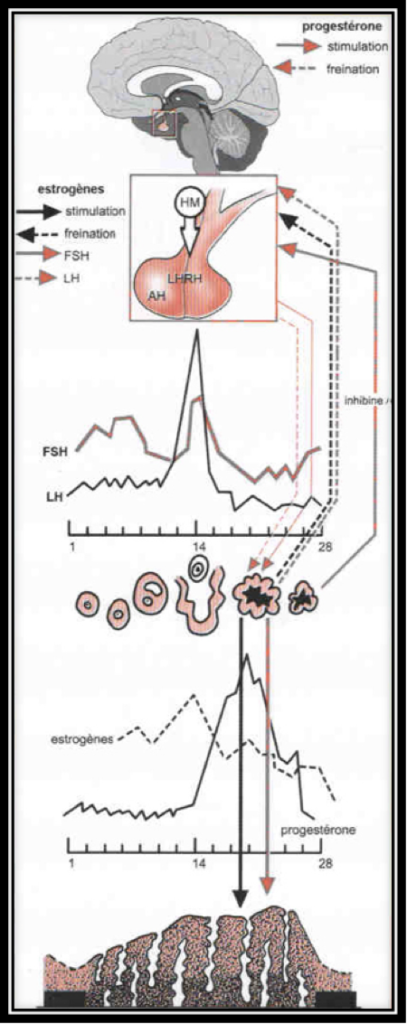
La destinée des follicules ovariens
Dès la naissance, les ovaires ont déjà leur stock définitif d’ovocytes. C’est le capital folliculaire qui représente 250000 à 500000 ovocytes dans chaque ovaire. Ce nombre diminue ensuite lentement pour atteindre 25000 vers l’âge de 37ans. Ensuite la disparition des follicules s’accélère à nouveau et leur nombre devient quasiment nul à la ménopause, vers 50ans. Il est important de remarquer que dans ce phénomène, naturel, de disparition des follicules, l’ovulation lors des cycles menstruels n’intervient que pour une part infime. En effet, pour chaque cycle, le follicule qui va atteindre son plein développement, provient d’une cohorte de 400 à 500 follicules qui ont débuté leur croissance trois cycles plus tôt. Cette cohorte voit son effectif diminuer progressivement par atrésie jusqu’à compter une dizaine de follicules qui sont utilisables (on dit recrutés) à la fin du cycle précédent. Un seul donnera une ovulation, les autres disparaissant. C’est donc environ 20000 follicules qui seront « puisés » dans le stock au cours des environs 400 cycles qui se dérouleront en moyenne au cours de la vie génitale. Cela représente très peu comparé au capital initial. Par extension, l’hyperstimulation des ovaires provoquée lors des fécondations in vitro ne peut en aucun cas contribuer notablement à l’épuisement du capital folliculaire. La disparition de 99,8% de ce capital est du à d’autres phénomènes d’atrésie cellulaire dont la cause initiale n’est pas connue. En d’autres termes, sur les 500000 à 1000000 d’ovocytes que possède chaque femme à sa naissance, seuls quelques centaines deviendront fécondables.
Dominance folliculaire, durée de la phase folliculaire et ovulation
Le follicule appelé « follicule dominant », est le seul qui arrivera à maturation au cours de chaque cycle. Il contient l’ovocyte susceptible d’être fécondé lors d’un cycle naturel (Fig.9). Exceptionnellement, il arrive que plusieurs «follicules dominants», se développent, ce qui explique la possibilité de grossesses multiples spontanées.
Il est important de comprendre que ce follicule dominant est issu d’un petit groupe de follicules recrutés, on vient de le dire, à la fin du cycle précédent, entre le 25ème et le 28ème jour, sous l’effet d’une augmentation de la concentration plasmatique de la FSH. A ce stade, ils mesurent entre 2 et 5mm. Cette notion a des implications dans la notion de « réserve ovarienne » visible en échographie en début de cycle, et dans certains protocoles de stimulation pour fécondation in vitro.
Le follicule dominant est en principe sélectionné dès le début de la phase folliculaire, c’est-à-dire entre le premier et le cinquième jour du cycle. Et son diamètre varie entre 5,5 et 8,2mm. Sa taille est déjà légèrement supérieure à celle des autres follicules qui vont grossir plus lentement. Devient dominant, le premier follicule capable de synthétiser les estrogènes et sa croissance pré-ovulatoire s’accélère grâce à l’effet « boule de neige » des estrogènes sur la synthèse des récepteurs à la FSH. Sous l’effet de la FSH, il grossit donc et les cellules folliculaires qui le composent sécrètent un liquide, le liquide folliculaire, stocké au centre du follicule. L’ovocyte apparaît alors excentré à l’intérieur du follicule qui fait saillie à la surface de l’ovaire. Le follicule peut atteindre un diamètre de 2 cm. C’est alors qu’intervient l’autre gonadotrophine, la LH. Son arrivée jusqu’au follicule dominant provoque l’ouverture du follicule à la surface de l’ovaire. L’ovocyte est expulsé, entouré de quelques cellules : c’est l’ovulation.
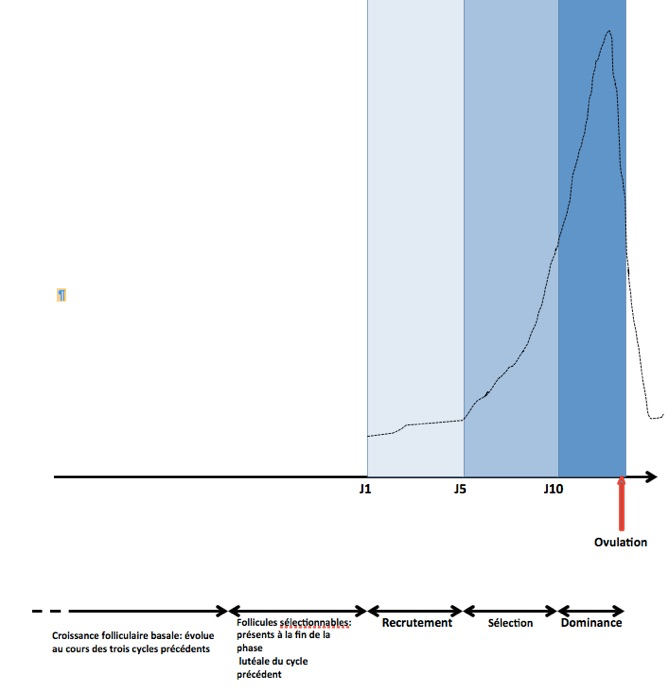
Il est important de s’attarder quelques instants sur cette notion de « dominance» qui est d’une grande importance pratique dans la surveillance des protocoles de stimulation ovarienne (Fig.10). Le follicule appelé à être dominant est donc sélectionné de J1 à J5. Dès le milieu de la phase folliculaire, de J6 à J10, il atteint 13mm et devient le seul capable de poursuivre son développement malgré la baisse des taux de FSH. Il bénéficie également d’un effet FSH-like de la LH qui contribue à accroître sa taille et à stimuler sa sécrétion d’estradiol. La décroissance des taux de FSH en milieu de phase folliculaire est à la base du phénomène de dominance du follicule le plus sensible ainsi que de l’atrésie (=la disparition progressive) de tous les autres follicules recrutés au niveau des deux ovaires. Arrivé à maturité, à peu près au milieu du cycle, ce follicule qui mesure entre 20 et 28mm de diamètre fait saillie à la surface de l’ovaire et il est bien visible à l’échographie.
Une autre notion est importante à comprendre. Nous venons de dire que le follicule dominant est en principe sélectionné dès le début de la phase folliculaire, c’est-à-dire entre le premier et le cinquième jour du cycle. Mais ce n’est pas toujours le cas. Il faut savoir que si la deuxième partie du cycle peut être plus courte que 14 jours, la première partie est fixe ; elle dure 13 jours. Or il apparait souvent, notamment sur les courbes de température que cette première phase du cycle est plus courte avec une ovulation paraissant survenir plus tôt. Cela est simplement du au fait qu’elle peut commencer plus tôt, c’est-à-dire avant les règles.
Classiquement, l’avancement du cycle menstruel a été calculé en référence au début des règles (jours des règles). Malheureusement cependant, les règles ne sont pas une référence physiologique. En effet, les règles, dernier épisode du cycle précédent, n’ont rien à voir avec le nouveau cycle menstruel qui commence. Le repère que les règles constituent n’offre donc pas d’information précise sur l’avancement fonctionnel réel de la phase folliculaire débutante. Au 3e jour du cycle, au début des traitements d’HOC (hyperstimulation ovarienne contrôlée) (pour la FIV notamment), l’avancement du processus de maturation folliculaire est en fait variable.
En réalité, le début fonctionnel de la phase folliculaire est lié à une légère élévation de la FSH, ou « signal FSH », qui survient pendant la période intercycle. Cette élévation de la FSH initie la croissance de l’ensemble des follicules dotés de récepteurs à la FSH qui constituent la cohorte des follicules stimulables, visibles en échographie sous l’appellation de follicules antraux.
Le signal FSH intercycle, qui culmine souvent au 3e jour du cycle (dans les cycles de 28 jours), peut survenir un peu plus tard en cas de cycles longs ou, plus tôt en cas de cycles soi-disant courts. L’amplitude du signal FSH intercycle, + 2,5 mUI/ml en moyenne, est trop faible pour être identifiée par une simple prise de sang. Pratiquement, il est donc difficile de savoir quand survient le signal FSH intercycle et quand la phase folliculaire débute réellement.
C’est le taux d’estradiol qui contrôle les taux de FSH en fin de cycle. Ainsi, il a été montré qu’un apport en E2 initié au premier jour des règles ou mieux, 3 jours avant celles-ci, prévient la survenue du signal FSH intercycle et le recrutement folliculaire qui suit. L’élévation de FSH ne commence alors qu’à l’arrêt de l’estradiol et culmine 3 jours plus tard. Cette notion permet de synchroniser la survenue du pic de LH qui a lieu 13-14 jours après l’arrêt d’estradiol, alors que ce dernier avait été poursuivi pendant 7-14 jours après les règles.
La synchronisation du signal FSH peut également être programmée par la prise ponctuelle de pilule contraceptive commencée au 2e jour des règles et continuée pendant 7 à 14 jours (ou plus si nécessaire). Après l’arrêt de la pilule contraceptive, la FSH s’élève plus lentement qu’après la prise d’E2 et culmine au 5e jour après l’arrêt. La pilule offre l’avantage de ne commencer le traitement de synchronisation qu’après la survenue des règles (2ème jour).
En résumé, le véritable début du cycle, donc de la véritable phase folliculaire commence à l’état physiologique, 3 jours après le signal FSH intercycle, et non pas toujours au début des règles, et l’ovulation survient 13 jours après. Ce signal FSH initie le recrutement folliculaire puis par suite la dominance aboutissant à un follicule mûr.
Les notions qui précèdent sont fondamentales pour bien comprendre les mécanismes des différents protocoles de stimulation en FIV.
Le follicule mûr se rompt 37 à 40 heures après la décharge pré ovulatoire de LH et de FSH et libère l’ovocyte entouré d’une couche de cellules appelée la corona radiata (Fig.11). L’ovocyte ainsi libéré de l’ovaire est capté par les trompes dans lesquelles il va rester quelques heures jusqu’à une fécondation éventuelle. S’il n’y a pas fécondation, il se résorbe et est éliminé.
L’ovocyte est une cellule sphérique contenant essentiellement du matériel génétique, équivalent à celui du spermatozoïde, sous la forme de chromosomes, et des substances (protéines et ARN) indispensables au déroulement de la fécondation et des premiers stades du développement embryonnaire. Cette cellule est bien plus volumineuse que le spermatozoïde, puisque son diamètre est de 1/10 de mm environ, et elle est immobile. Elle est entourée de sa corona radiata.
Fonctionnement chez l’homme
Alors que la femme possède tout son stock d’ovocytes pour toute sa vie (jusqu’à la ménopause) depuis la naissance, chez l’homme, les spermatozoïdes sont produits dans les tubes séminifères de façon continue, depuis la puberté jusqu’à un âge très avancé. Il n’y a théoriquement pas d’arrêt total de la formation des spermatozoïdes chez l’homme. C’est la FSH, la même hormone hypophysaire que chez la femme, qui stimule la production des spermatozoïdes.
Les cellules reproductrices ou gamètes masculins sont les spermatozoïdes, produits dans les testicules. Cette production a lieu dans des tubes très fins, les tubes séminifères, dont l’épithélium est constitué de deux types de cellules : les cellules de Sertoli qui ont un rôle nutritif et de soutien et les spermatogonies qui sont les cellules souches de la lignée germinale.
Les spermatogonies se multiplient par simple division cellulaire et se renouvellent constamment. A partir de la puberté, certaines spermatogonies continuent de se multiplier pour conserver le nombre de cellules germinales souches, d’autres se transforment en spermatocytes I qui vont subir la mitose réductionnelle de la méiose pour donner les spermatocytes II. Ces spermatocytes II vont donner les spermatides après avoir subi la mitose équationnelle. Les spermatides, qui sont en réalité des spermatozoïdes immatures, vont subir une phase de maturation, appelée spermiogenèse, pour donner naissance aux spermatozoïdes. Cette dernière phase permet au spermatozoïde d’acquérir les outils nécessaires à la fécondation (acrosome, flagelle) et de modifier son noyau.
La spermatogenèse débute à la puberté et est permanente. Il faut environ 72 jours pour qu’une spermatogonie donne naissance à un spermatozoïde.
Une fois leur formation achevée, les spermatozoïdes sont éliminés dans un canal collecteur, l’épididyme, dans lequel ils finissent leur maturation. Lors de l’éjaculation, les spermatozoïdes (ainsi que les sécrétions de l’épididyme) vont passer dans les canaux déférents, se mélanger avec les sécrétions des vésicules séminales puis de la prostate ce qui permet la formation du sperme. Le canal déférent a une paroi épaisse que le médecin peut facilement identifier par simple palpation au-dessus des bourses. Le sperme passe ensuite dans l’urètre et est éjaculé vers l’extérieur au niveau du gland.
Entre les tubes séminifères, il existe d’autres cellules regroupées en petits amas et dont le rôle est de sécréter des hormones mâles, la testostérone principalement ; ce sont les cellules de Leydig. Il s’agit de substances qui, passant dans le sang, vont agir à distance sur d’autres tissus vivants, ou organes, pour faire apparaître les signes physiques distinctifs du sexe masculin : stature, pilosité, voix, etc.
Le sperme n’est pas uniquement constitué de spermatozoïdes. Au fur et à mesure de leur transport dans l’épididyme et le canal déférent, diverses glandes y déversent leurs sécrétions : la prostate et les vésicules séminales.
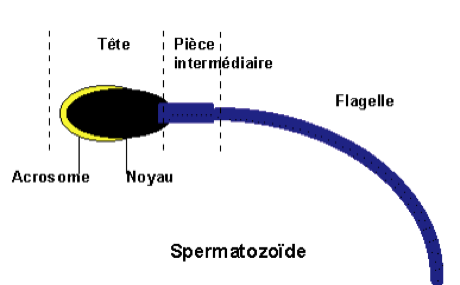
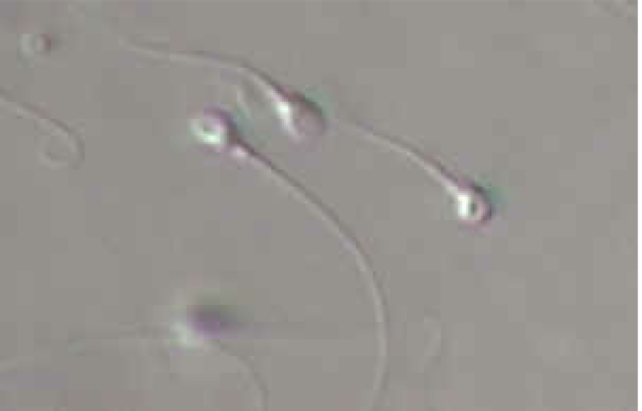
Le spermatozoïde (Fig.12 et 13) est une cellule de forme particulière comportant une tête et un flagelle. La tête contient le noyau cellulaire qui est constitué par l’ADN ainsi qu’une sorte de sac, appelé acrosome, contenant les enzymes nécessaires à la traversée des enveloppes de l’ovocyte lors de la fécondation.
Le flagelle est animé de mouvements qui permettent au spermatozoïde de se déplacer.
Une pièce intermédiaire réunit le flagelle à la tête.
Le spermatozoïde est une cellule très petite : la tête mesure 5µm de longueur et le flagelle 50µm (sachant que 1 µm= 1/1000 de mm)
La production des androgènes est assurée par les cellules de Leydig (petites cellules situées au niveau des testicules) qui sécrètent principalement la testostérone à partir du cholestérol. Cette testostérone, une fois synthétisée, quitte rapidement le testicule (qui ne peut en stocker qu’une faible quantité), par un système complexe de tubules, pour atteindre la circulation sanguine.
Les principales fonctions des androgènes se résument comme suit:
– initiation et maintien de la spermatogénèse ;
– développement des caractères sexuels masculins ;
– assurer la fonction sexuelle après la puberté (libido).
Tout comme les ovaires, les testicules sont sous le contrôle des hormones FSH et LH qui vont stimuler la spermatogenèse et la synthèse des androgènes (Fig.14). Par contre, ici le fonctionnement n’est pas cyclique mais continu.
De plus, les testicules sont contrôlés par la température. En effet, la position externe des bourses permet de maintenir les testicules à une température d’environ 35° et non de 37° comme le reste du corps. Cette faible température est indispensable à la spermatogenèse et toute élévation thermique peut bloquer celle-ci.
Les caractéristiques sexuelles secondaires mâles (voix, pilosité, barbe, musculature et organes génitaux) se développent grâce à l’action de la testostérone. À la puberté, l’hypothalamus stimule l’hypophyse qui déclenche la sécrétion de l’hormone FSH qui stimule la production de cellules sexuelles (spermatozoïdes) et de l’hormone LH qui stimule la production des hormones sexuelles (testostérone).
Comment s’effectue la fécondation ?
Pour qu’il y ait fécondation, il faut qu’ovocyte et spermatozoïdes se rencontrent au bon moment. Il faut au moins une trompe fonctionnelle qui ne gêne pas leur rencontre. Le rapport sexuel doit se produire lors de la période d’ovulation. L’ovocyte n’est fécondable que dans les 24 heures qui suivent l’ovulation. Les spermatozoïdes sont susceptibles de rester fécondants dans les voies génitales de la femme, pendant quatre à cinq jours. Ceci fait qu’une femme est fécondable quelques jours par mois seulement.
Il faut aussi que l’ovocyte et les spermatozoïdes soient de bonne qualité. De plus, un nombre de spermatozoïdes suffisant présentant une mobilité correcte est nécessaire à la rencontre des gamètes.
La fécondation a normalement lieu dans les trompes où l’ovocyte reste quelques heures après l’ovulation (Fig.15). La remontée des spermatozoïdes vers les trompes est rendue possible par le flagelle, un long cil mobile, dont il se sert comme d’une godille pour avancer à travers la glaire cervicale d’abord, puis à travers l’utérus et la trompe (Fig.18). Le rôle de cette glaire cervicale est capital (Fig.16 et 17). Sécrétée par le col utérin sous l’effet des estrogènes, elle a une structure glaireuse et filante propice à l’ascension des spermatozoïdes essentiellement dans la période pré ovulatoire et ovulatoire. Ensuite sous l’influence de la progestérone sécrétée par le corps jaune, elle devient coagulée, épaisse, difficilement franchissable par les spermatozoïdes.
Tous les spermatozoïdes déposés dans le vagin (il y en a des millions) n’atteignent pas les trompes, loin de là. On estime à 150 000 environ ceux qui atteignent l’extrémité de la trompe où se trouve l’ovocyte.
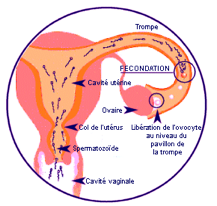
Fig.18-Cheminement des spermatozoïdes jusqu’à leur rencontre avec l’ovocyte dans le tiers externe de la trompe
Evolution de l’ovocyte et fécondation
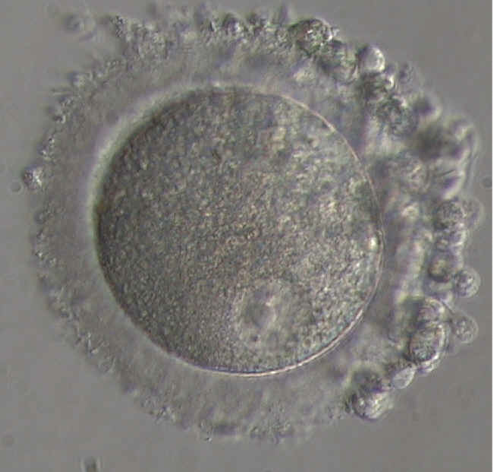
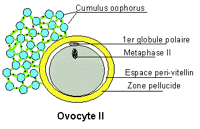
Pendant sa phase de croissance à l’intérieur de l’ovaire, l’ovocyte, qui à ce stade est appelé ovocyte de type I, va acquérir le matériel cellulaire nécessaire aux premières étapes du développement embryonnaire (Fig.19). A cette croissance, fait suite une étape de maturation, d’une durée de 36 heures, permettant la formation d’un ovocyte mature ou ovocyte de type II (Fig.20 et 21). La maturation de l’ovocyte est déclenchée par le pic de LH. Elle va permettre à l’ovocyte de devenir fécondable par un spermatozoïde. L’ovocyte est une grosse cellule sphérique, immobile, mesurant environ 140µ de diamètre en fin de phase de croissance. Elle est entourée d’une enveloppe translucide, formée de protéines : la zone pellucide. A l’extérieur de la zone pellucide, l’ovocyte est inclus dans une masse cellulaire, appelée cumulus oophorus, dont la couche en contact avec la zone pellucide est nommée corona radiata. On distingue donc deux types d’ovocyte : l’ovocyte I et l’ovocyte II.
-L’ovocyte de type I, ou ovocyte immature, dont le noyau est bloqué en prophase de 1ère division de la méiose (vésicule germinale) et qui n’a pas de globule polaire.
– de type II, ou ovocyte mature, dont le noyau est bloqué en métaphase de 2ème division de la méiose et qui possède un globule polaire dans l’espace séparant la zone pellucide et l’ovocyte (espace péri-vitellin).
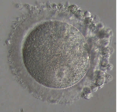
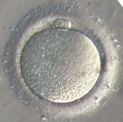
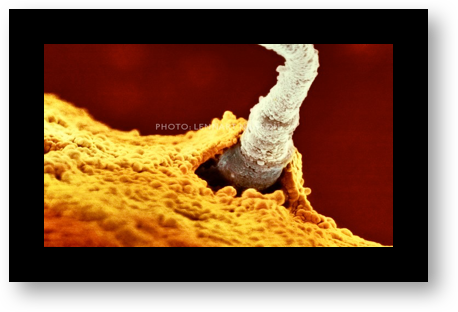
L’ovocyte est protégé par une enveloppe translucide (la zone pellucide) à laquelle s’attachent quelques dizaines de spermatozoïdes. Parmi ceux-là, un seul pénétrera dans l’ovocyte (Fig.22). Aussitôt après, la zone pellucide se transforme pour devenir une barrière infranchissable. Les autres spermatozoïdes n’ont plus aucune chance d’y pénétrer.
Une fois la membrane pellucide franchie, le spermatozoïde arrive dans l’espace péri-vitellin situé entre elle et l’ovocyte. Il s’immobilise contre l’ovocyte et leurs membranes fusionnent : la membrane plasmique du spermatozoïde s’intègre à celle de l’ovocyte, tandis que la membrane acrosomique et le flagelle sont incorporés au cytoplasme. La pénétration du spermatozoïde déclenche dans l’ovocyte un ensemble de processus appelés activation. Cette activation rend la paroi de l’ovocyte imperméable aux autres spermatozoïdes, mais elle est aussi responsable de la reprise de la division méiotique de l’ovocyte qui était bloquée en cours de division depuis la vie intra-utérine. Cette division se termine avec l’expulsion du deuxième globule polaire. L’ADN maternel est alors partagé à égalité entre l’ovocyte et le globule polaire qui contiennent chacun la moitié du capital chromosomique. En revanche la presque totalité du cytoplasme reste dans l’ovocyte dont les éléments serviront au développement embryonnaire précoce.
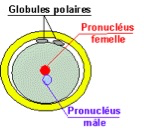
Le noyau du spermatozoïde perd son enveloppe dès son entrée dans l’ovocyte. Ce dernier renferme alors deux pronoyaux qui s’entourent d’une membrane : un pronucleus d’origine mâle et un pronucleus d’origine femelle (Fig.23 et 24).
La synthèse d’ADN débute alors simultanément dans les deux pronuclei mâle et femelle dès qu’ils sont complètement formés. Puis les deux pronuclei migrent vers le centre de la cellule, leurs parois disparaissent, ils fusionnent, les chromosomes se répartissent et s’apparient selon les règles de la division cellulaire mitotique, marquant le début de la première division cellulaire (Fig.26). La première division cellulaire se produit 25 heures après le premier contact entre les gamètes, faisant passer ce que l’on appelle maintenant le zygote au stade de deux cellules dites aussi « blastomères » (Fig.25).
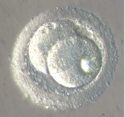
Le zygote – selon la définition: la première cellule de l’embryon – ne subit qu’un cycle cellulaire incomplet (Fig.27 et 28).
Cela vient du fait que l’ovule n’achève les dernières étapes de sa maturation qu’au moment où le spermatozoïde l’a pénétré. Le zygote se forme donc selon un mode légèrement différent de celui que l’on pourrait supposer. Les informations génétiques des deux parents ne sont pas directement mises en commun lors de la pénétration du spermatozoïde pour être dédoublées ensembles et finalement séparées par une mitose. En réalité, les informations génétiques aussi bien paternelles que maternelles sont d’abords dédoublées dans deux pronuclei indépendants; elles y sont également recondensées en chromosomes pour s’aligner juste ensuite sur le plan équatorial de l’appareil microtubulaire de division.
Il n’y a pas de fusion des deux pronuclei après qu’ils se soient rapprochés au maximum; une mise en commun des chromosomes des deux pronuclei à l’intérieur d’une seule membrane nucléaire n’a pas lieu. Au contraire, les membranes des deux pronuclei se lysent et les chromosomes des deux pronuclei s’arrangent sur le plan équatorial de l’appareil microtubulaire.
L’arrangement des chromosomes paternels et maternels ensembles dans un appareil microtubulaire commun marque le début du zygote, la première cellule du nouvel organisme; celle-ci possède un génome individuel (2n4C).
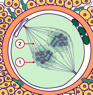
L’appareil microtubulaire de division s’est formé 22 heures après la fécondation.
La membrane nucléaire des deux pronuclei se lyse. Ceci indique sans équivoque que le zygote s’est formé.
1: membrane nucléaire du pronucleus en cours de lyse
2: Microtubules de l’appareil microtubulaire de division.
Que se passe-t-il après la fécondation ?
L’ovule fécondé, que l’on appelle le « zygote », se divise pour former deux, puis quatre, puis huit cellules, de plus en plus petites, appelées blastomères. C’est la segmentation. Il y a 2 cellules au bout de 20 heures, 4 cellules au bout de 40 heures (Fig.29), puis 8 (Fig.30), etc. Le stade à 30 cellules au 3ème ou 4ème jour porte le nom de morula (Fig.31); le stade à 200 cellules, au 6ème ou 7ème jour porte le nom de blastocyste (Fig.32). La taille de l’embryon qui est à son début de 1/10 de mm atteint alors 2/10 de mm. On a coutume de donner le nom d’embryon à ces différents stades.
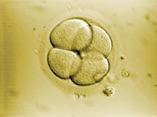
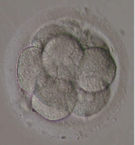
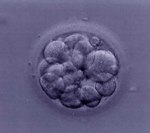
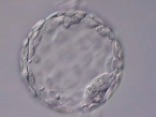
Il ne reste pas dans les trompes. Il est normalement entraîné vers l’utérus par les contractions des parois de la trompe. Pendant que le zygote se déplace à travers la trompe, l’utérus se prépare à recevoir le blastocyste. Sous l’effet de la progestérone, sécrétée par le corps jaune, la couche interne de la paroi de l’utérus, l’endomètre, s’est épaissie pour accueillir le blastocyste. Une semaine environ après la fécondation, le blastocyste s’implante dans l’endomètre : cette phase est nommée nidation (Fig.33). A partir de ce stade, l’embryon se développe rapidement dans la cavité liquidienne qui l’entoure et le protège. L’utérus prend du volume… jusqu’à l’accouchement.
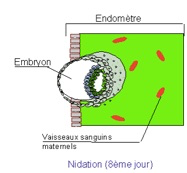
On observera que pour que la nidation se produise, il doit y avoir un synchronisme parfait entre le développement embryonnaire et l’état de l’endomètre.
Il peut arriver que le blastocyste ne s’implante pas là où il devrait, c’est-à-dire dans l’utérus. Il reste quelquefois dans les trompes ; il arrive même, exceptionnellement, qu’il se fixe dans la cavité abdominale, en dehors des trompes et de l’utérus. On parle dans tous ces cas de grossesses extra-utérines (GEU). Ce sont des grossesses qui ne peuvent pas aboutir et qui peuvent donner lieu à des complications graves. Ce sont des urgences chirurgicales qu’il faut essayer de dépister et de traiter.