La chimiothérapie
La chimiothérapie est un traitement à base de médicaments visant à détruire préférentiellement les cellules cancéreuses. En effet les cellules cancéreuses sont des cellules jeunes, en voie de multiplication rapide et sont dont en priorité sensible à ces traitements plutôt que les autres cellules du corps. C’est donc un traitement général qui agit dans tout le corps et peut ainsi détruire des cellules cancéreuses métastatiques même invisibles avec nos examens actuels. Ces médicaments sont administrés en perfusion et parfois en comprimés.
ON DISTINGUE DEUX TYPES DE CHIMIOTHÉRAPIE
-La chimiothérapie dite adjuvante est réalisée après la chirurgie. Elle a pour buts de réduire le risque de métastases.
-La chimiothérapie dite néo-adjuvante est proposée avant la chirurgie, dans le but de réduire le volume d’une grosse tumeur (en général au-delà de 3cm, mais cela dépend aussi du ratio entre la taille de la tumeur et le volume mammaire) afin d’éviter une mastectomie et de permettre un traitement conservateur du sein. En cas de chimiothérapie néoadjuvante, Il est nécessaire de réaliser une IRM mammaire et une TEP-TDM au 18 F-FDG avant le début du traitement. De plus, afin d’éviter la disparition du lit tumoral en cas de bonne réponse, un clip sera placé par une technique percutanée.
LES INDICATIONS DE LA CHIMIOTHÉRAPIE
La décision de faire ou non une chimiothérapie est difficile à prendre car on sait qu’actuellement environ 30% des chimiothérapies sont inutiles mais réalisées dans le doute. Pour prendre cette décision, on dispose classiquement de recommandations (ou « guidelines ») qui émergent de plusieurs sociétés américaines et européennes, et qui reposent sur de nombreux critères : nature de la tumeur, identité de la tumeur, taille, virulence, âge de la patiente, etc. (Voir: Histologie et facteurs pronostics).
Or, il apparaît qu’en suivant ces recommandations on réalise ainsi beaucoup trop de chimiothérapies parce qu’il est extrêmement difficile de savoir, notamment chez les femmes atteintes de petites tumeurs, si celle-ci sera utile ou non. Et dans le doute, on choisit de faire une chimio. C’est ainsi qu’au final, 25 à 30% de chimio inutiles sont réalisées. Or il existe aujourd’hui un test (Oncotype DX) qui permet d’estimer la probabilité d’une récidive du cancer du sein et le bénéfice d’une chimio. Ce test, dénommé Oncotype DX, permet d’obtenir trois catégories de réponses :
Le risque est élevé : on doit faire une chimiothérapie qui va apporter un bénéfice important.
Le risque est intermédiaire : le test n’apporte aucune information particulière.
Le risque est faible : il n’y a pas d’intérêt à faire une chimiothérapie chez cette patiente, elle ne va pas améliorer son pronostic.
Voir la page consacrée à ce sujet dans ce site: la génomique des cancers du sein.
LA POSE D’UNE CHAMBRE IMPLANTABLE
Les produits de chimiothérapie sont irritants pour les veines. On utilise donc le plus fréquemment possible, une chambre de perfusion ou port-à-cath (PAC). Il s’agit d’un tuyau stérile, glissé dans une veine profonde de la base du cou (jugulaire ou sous-clavière). Celui-ci est relié à un petit boîtier (chambre) placé sous la peau, juste sous la clavicule. La mise en place de la chambre de perfusion se fait en salle d’opération par une incision de 2 à 3 cm, sous anesthésie locale. Ensuite, il suffira de piquer à travers la peau et d’introduire l’aiguille dans le boîtier relié à la veine pour les perfusions à venir. Le PAC ne demande aucun entretien particulier. Les bains et douches peuvent être pris dès cicatrisation.
Mise en place d’une chambre:
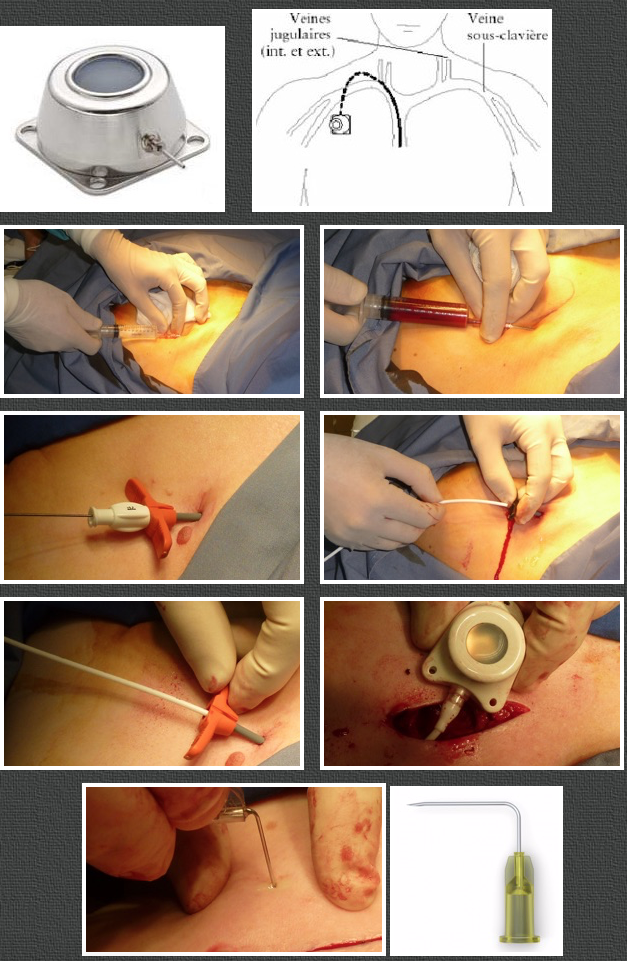
La chambre est ponctionnée exclusivement à l’aide d’une aiguille spéciale dite aiguille de Huber comme ci-dessus.
INDICATIONS ET PROTOCOLES DE LA CHIMIOTHERAPIE ADJUVANTE
Les indications et le choix de la chimiothérapie dépendent du résultat des différents facteurs pronostiques. Voir: Histologie et facteurs pronostiques et La génomique.
A-Concernant la chimiothérapie adjuvante
1-Cancers HER2+++
a-Cancers pT1aN0: en l’absence de consensus, chimiothérapie et/ou Trastuzumab sont discutés au cas par cas.
b-Pour les cancers pT1b à pT3 et pN0 à pN3, il existe une indication de chimiothérapie et de trastuzumab
c-En cas de cancer HER2+++, mais égale- ment RH positif, le traitement antihormonal proposé sera le même que celui des patientes luminales B.
d-Pour ces cancers HER2+++, on propose les protocoles suivants:
-3-4 (F)EC ou (F)AC + 3-4 D(C)T
3-4 (F)EC ou (F)AC + 12 wPT
En deuxième choix : 4-6 DCT
6 DAC puis T
6 DCbT
Concernant ces abréviations:
F : 5 Fluorouracile (500 -750 mg/m2), E : Epirubicine 75-100 mg/m2, C : cyclophosphamide (500-750 mg/m2, D : Docetaxel (75-100 mg/m2), P : Paclitaxel hebdomadaire (80-90 mg/m2), A : Doxorubicine (adriamycine 50-60 mg/m2) Cb : carboplatine (AUC 5-6), T : trastuzumab à débuter après les anthracyclines
Par ailleurs, le Trastuzumab sera poursuivi au total sur une durée d’un an.
2-Cancers luminaux (RH+)
a-Luminal A: il s’agit de cancers RE +++ et RP +++, grade I ou II, Ki67 inférieur à 15-20% et/ou prolifération faible. Une chimiothérapie est recommandée dans une de ces situations : pN2 ou +, pN1 et pT2 ou + , pN0 et pT≥ 3cm, ou s’il existe d’autres facteurs de risque comme un risque élevé déterminé par une signature génomique ou un âge jeune (≤ 35 ans).
Les situations rares où une tumeur de grade I serait associée à un Ki67 élevé ou à l’inverse une tumeur de grade III à un Ki67 bas, seront discutées au cas par cas.
b-Luminal B: il s’agit de cancers RE +, RP +/-, grade II ou III et Ki67 > 15-20% et/ou prolifération élevée), une chimiothérapie est recommandée dans une de ces situations : pN1 ou +, grade II et pT≥ 2, grade III et pT≥ 1.
c-Triples négatifs: en cas d’histologie classique, la chimiothérapie est discutée au cas par cas si < 5mm) . En cas d’histologie type adénoïde kystique : pas de chimiothérapie si pN0.
d-Pour les cancers HER2- on propose les protocoles suivants:
3-4 (F)EC ou (F)AC + 3-4 D(C)
3-4 (F)EC ou (F)AC + 12 wP
4-6 DC
6 DAC
B-Concernant la chimiothérapie néo-adjuvante
Si l’on envisage une chimiothérapie néo-adjuvante, il faut réaliser en premier lieu un bilan d’extension comportant une IRM et une TEP-TDM au 18 F-FDG à la recherche de métastases et de l’extension ganglionnaire.
1-Les indications de la chimiothérapie néo-adjuvante
Il y a aujourd’hui trois grands types d’indications de chimiothérapie néoadjuvante :
– les tumeurs inflammatoires ou localement avancées, inopérables d’emblée ;
– les tumeurs opérables d’emblée mais volumineuses, non accessibles à un traitement conservateur, donc relevant à priori de la mastectomie mais pour lesquelles on souhaite réaliser tout de même un traitement conservateur après la réduction tumorale due à la chimiothérapie; sachant qu’il faut en fait tenir compte de la comparaison entre la taille de la tumeur et le volume du sein.
-les tumeurs d’emblée métastatiques chez qui l’on souhaite voir rapidement l’efficacité de la chimiothérapie sur la tumeur et les métastases.
– et plus récemment, pour des tumeurs plus petites, dans le but d’évaluer in vivo la sensibilité de la tumeur aux drogues utilisées. En évitant bien sûr les tumeurs dont on connaît d’avance la mauvaise réponse à la chimiothérapie comme les tumeurs fortement RH +, ou de grade I et les carcinomes lobulaires inltrants. Cette indication n’a toutefois rien d’obligatoire et devrait rester dans le cadre d’essais thérapeutiques.
2-Inconvénients de la chimiothérapie néo-adjuvante
a-Fragmentation et réduction de la cellularité cancéreuse au sein de la tumeur initiale. Cela peut donner une impression radio-clinique de disparition tumorale complète alors que la réalité tissulaire est différente. C’est naturellement ces cas qui sont associés au taux le plus élevé de faux négatifs des marges en extemporané et donc de réinterventions. Le problème est qu’en peropératoire le chirurgien ne voit rien et ne palpe rien de spéci que, la radio de pièce reste grossière et l’examen extemporané peu fiable. Le seul progrès notable de ces dernières années est venu de l’analyse préopératoire par IRM. Deux IRM doivent être réalisées idéalement pour bien évaluer cette réponse tumorale, l’une initialement et l’autre en préopératoire immédiat.
b-Une réponse excellente avec disparition clinique et radiologique de la tumeur pose paradoxalement des difficultés. Il faut donc poser un clip radio-opaque au centre de la tumeur, sous guidage radiologique ou échographique, avant qu’elle n’ait totalement disparu (en règle générale, lorsque la taille descend en dessous de 2 cm).
Il est possible d’envisager un traitement anti-hormonal néoadjuvant notamment en cas de cancer luminal A voire B s’il existe une contre-indication à la chimiothérapie.
V-LE DÉROULEMENT DE LA CHIMIOTHÉRAPIE
Chaque cycle ou cure de chimiothérapie, se compose d’un ou de plusieurs jours de traitement, espacés d’une à quatre semaines d’intervalle. Le rythme et la durée de votre traitement seront déterminés par votre médecin. Le traitement se déroule le plus souvent par cure, espacées de 3 semaines. Il s’administre en perfusion. Les chimiothérapies orales (par comprimés) sont utilisées en cas de récidive. Le jour de la chimio, on voit d’abord le médecin avec les résultats de sa prise de sang afin de vérifier que tout va bien (les chimios diminuent en effet les globules…). Puis, la perfusion a lieu dans une salle où se trouvent généralement d’autres malades. Elle dure environ 2h pendant lesquelles vous êtes surveillée par une infirmière. Avant la séance, on peut vous proposer de porter un casque réfrigérant (et parfois des moufles, selon le produit utilisé) afin de réduire le risque de perdre des cheveux et d’atteinte des ongles. Prévoyez un châle car on a froid, et de la lecture ou de la musique pour vous occuper.
LES EFFETS SECONDAIRES DE LA CHIMIOTHÉRAPIE
Les effets secondaires de la chimiothérapie dépendent du protocole utilisé. Parmi ceux qui sont les plus fréquents :
1-Les nausées et les vomissements peuvent apparaître selon les produits et le protocole utilisés mais ne sont pas systématiques.
Les traitements anti-nauséeux spécifiques limitent leur apparition et sont utilisés en prévention avant chaque injection de chimiothérapie.
Les corticoïdes sont souvent utilisés et ne nécessitent pas de régime sans sel car le traitement est de courte durée.
Les nausées et vomissements induits par la chimiothérapie surviennent dans les heures suivant la perfusion, mais peuvent aussi persister pendant quelques jours. Ils sont augmentés par l’anxiété et l’appréhension, et, parfois, réapparaissent avant l’injection de produit ou au moment du retour sur les lieux du traitement, par anticipation. Une ordonnance de médicaments adaptés vous sera prescrite pour prévenir et soulager ces nausées.
La chimiothérapie peut aussi entraîner un goût métallique dans la bouche et le désintérêt pour certains aliments. Certaines précautions peuvent vous aider à limiter ces effets secondaires bien connus: avant le traitement, prenez un repas léger, buvez des boissons fraîches et gazeuses, Privilégiez des repas de petite quantité, une alimentation tiède ou froide, évitez le tabac, l’alcool, une alimentation trop riche et épicée, et si vous avez des nausées, essayez les sodas à base de coca. Si les nausées et les vomissements persistent, parlez-en à votre médecin qui pourra adapter le traitement.
2-Cheveux et ongles
La plupart des médicaments utilisés dans les chimiothérapies entraînent une chute des cheveux (alopécie), trois ou quatre semaines après le début du traitement. Cette perte de cheveux n’est pas définitive et la repousse débute dès que la chimiothérapie est terminée. La chute des cheveux est brutale et pour éviter un trop grand traumatisme psychologique, il vaut mieux prévoir une perruque avant que les cheveux ne tombent. La perruque prescrite par le médecin est remboursée en partie (sur la base d’un forfait) par la sécurité sociale. La chute des cheveux peut être limitée par le port d’un casque pendant la séance de chimiothérapie. Cette précaution reste parfois insuffisante. Pour ne pas fragiliser les cheveux, il est recommandé d’utiliser des shampoings très doux, de ne pas brosser ses cheveux énergiquement, de sécher les cheveux à faible température, de ne pas utiliser de rouleaux, d’éviter les colorations et les permanentes.
En fait, tous les poils, cils, sourcils, barbe, moustache, poils pubiens ont tendance à tomber pendant une chimiothérapie, mais ils repoussent ensuite.
Les ongles peuvent également devenir cassants, striés ou colorés. Pour les protéger, nous conseillons une application de vernis avant la perfusion.
3- Les muqueuses
La peau devient souvent très sèche et il ne faut donc pas hésiter pas à utiliser des produits hydratants.
La chimiothérapie entraîne parfois une irritation et une inflammation de la muqueuse de la bouche et favorise la survenue d’aphtes et de mycoses (infections dues à des champignons). Ces troubles sont décrits sous le terme de « mucites » et seront traités par des bains de bouche adaptés, prescrits par le médecin. Des règles d’hygiène simples aident à prévenir leur apparition. Les caries constituent de véritables foyers d’infection. Ainsi un brossage des dents après chaque repas avec une brosse douce, au moins six bains de bouche quotidiens prescrits par le médecin vous permettront de garder une bouche saine. Il est aussi recommandé d’éviter les aliments acides comme le citron, le vinaigre, la moutarde et de réduire la consommation d’alcool.
La chimiothérapie favorise aussi la réapparition de boutons de fièvre. Si vous avez des poussées fréquentes d’herpès, signalez-le à votre médecin. D’autres troubles cutanés peuvent survenir tels que rougeurs, éruption, troubles de la pigmentation, œdèmes.
De façon beaucoup moins fréquente, la chimiothérapie peut entraîner une sécheresse du nez, des hémorroïdes ou des conjonctivites.
4-Troubles intestinaux
Certaines chimiothérapies peuvent entraîner une constipation et d’autres, une diarrhée. Si les conseils diététiques ne suffisent pas, le médecin pourra ajouter un traitement simple.
Si vous avez de la fièvre, consultez immédiatement votre médecin.
5-Troubles sanguins
Toutes les chimiothérapies ont une toxicité sanguine liée à l’atteinte des cellules de la moelle osseuse qui produisent les globules et les plaquettes du sang.
> La baisse des globules blancs correspond à la leucopénie. Les globules blancs appelés aussi leucocytes sont les plus fragiles. Il existe plusieurs sortes de globules blancs et en particulier les polynucléaires neutrophiles qui permettent à l’organisme de se défendre contre les infections. Une baisse des polynucléaires neutrophiles ou neutropénie, augmente donc le risque de fièvre et d’infections.
> Si vous n’avez pas de fièvre, la prise d’antibiotique n’est pas nécessaire ; il suffit de prendre certaines précautions : éviter les transports en commun, les lieux publics, le contact avec des personnes qui ont un rhume, une grippe ou tout autre infection.
> Si vous avez plus de 38°C de fièvre, vous devez consulter en urgence votre médecin traitant ou un médecin hospitalier. Une prise de sang avec numération formule sanguine (NFS) permettra de savoir si vos globules blancs ont beaucoup baissé et des antibiotiques seront aussitôt prescrits. Si la baisse des globules blancs est très importante, une hospitalisation immédiate peut s’imposer afin d’administrer des antibiotiques en perfusion.
Les doses de chimiothérapie peuvent alors être revues et adaptées à la cure suivante pour éviter que la baisse des globules blancs ne se reproduise. Des médicaments, appelés facteurs de croissance, qui stimulent le développement des globules blancs, peuvent parfois être associés à la chimiothérapie et administrés en injections sous-cutanées à domicile.
> La baisse du nombre des globules rouges et de l’hémoglobine définit l’anémie. L’anémie modérée n’entraîne aucun symptôme. L’anémie importante peut être à l’origine de fatigue, pâleur, palpitations, essoufflement à l’effort, et parfois étourdissements. Il faut systématiquement signaler ces troubles au médecin car une transfusion de sang ou des piqûres d’érythropoïétine (EPO) peuvent s’avérer nécessaires. L’EPO stimule la fabrication des globules rouges.
La baisse des plaquettes correspond à une thrombopénie. Ce phénomène est plus rare, exposant à des hémorragies presque toujours sans gravité. Elle peut nécessiter une transfusion de plaquettes.
> La baisse simultanée des trois types de cellules sanguines (globules rouges, globules blancs et plaquettes) s’appelle une aplasie.
6-Troubles sexuels et gynécologiques
Chez la femme non ménopausée, la chimiothérapie entraîne souvent, une irrégularité des règles, parfois même leur arrêt. Néanmoins, une contraception efficace reste indispensable pendant la durée de la chimiothérapie. Le plus souvent, les règles réapparaîtront dans les mois qui suivent la fin de la chimiothérapie. L’arrêt peut être définitif chez les femmes à partir de 40-45 ans.
Chez la femme ménopausée, le traitement hormonal substitutif de la ménopause doit être arrêté. Des troubles de la libido sont possibles durant le traitement de chimiothérapie.
7-Autres troubles
Certains produits de chimiothérapie ont des effets secondaires plus particuliers comme, des crampes et douleurs dans les jambes, des fourmillements. Plus rarement une diminution de la sensibilité des pieds et des doigts, une baisse de l’audition, ou de la salivation peuvent aussi apparaître.
Votre médecin vous préviendra de ces effets indésirables bien connus aujourd’hui. Ils disparaissent le plus souvent après l’arrêt des traitements. Une surveillance de la fonction cardiaque est parfois indiquée.
La chimiothérapie ne modifie pas vos capacités de raisonnement, de mémorisation et n’a aucun impact sur les gestes simples de la vie quotidienne.
La radiothérapie
On trouvera ci-après le résumé des recommandations actuelles pour la radiothérapie dans le cadre des cancers du sein.
Pour les carcinomes in situ
-Carcinome canalaire in situ (CCIS)
.Après une chirurgie conservatrice, l’irradiation de la glande mammaire est indiquée.
.Après une mastectomie avec des berges d’exérèse saines, il n’y a pas d’indication pour une radiothérapie adjuvante de la glande mammaire.
Pour les CCIS, il n’y a jamais d’indication d’irradiation des aires ganglionnaires.
-Pour les carcinomes lobulaires in situ (CLIS)
Pour les carcinomes lobulaires in situ pléïomorphes, l’indication de l’irradiation de la glande mammaire en traitement complémentaire d’une chirurgie conservatrice peut être discutée dans le cadre d’une RCP.
En dehors de ces formes particulières, il n’existe pas d’indication à la radiothérapie dans les CLIS.
Pour les carcinome infiltrants non inflammatoires
a-Radiothérapie locale
-Radiothérapie après mastectomie totale
.Une irradiation de la paroi thoracique est indiquée en présence d’un ou plu‐ sieurs facteurs de risque de récidive. Les principaux facteurs actuellement reconnus incluent la taille et le grade histologique de la tumeur, l’infiltration de la peau ou de la paroi thoracique, la présence d’une lymphangite carcinomateuse sous cutanée, l’atteinte des berges d’exérèse, l’indication de l’irradiation ganglionnaire associée, la présence d’emboles lymphatiques et/ou sanguins et l’âge jeune de la patiente.
-Radiothérapie après chirurgie conservatrice
.Une irradiation de la glande mammaire est toujours indiquée en complément de la chirurgie. Elle diminue le risque de récidive loco-régionale de 70 % et réduit le risque de mortalité à long terme.
.Une irradiation additionnelle du lit tumoral (boost) réduit le risque de récidive locale, elle est donc indiquée en présence de facteurs de risque de récidive identifiés, quel que soit l’âge. L’irradiation du lit tumoral, de 10 à 16 Gy en 5 à 8 fractions, est facilitée par le repérage du lit tumoral par des clips chirurgicaux.
b-Radiothérapie des aires ganglionnaires
-Envahissement ganglionnaire axillaire prouvé histologiquement et > 2 mm: une irradiation du sommet de l’aisselle incluant la région sus‐claviculaire est indiquée.
-Envahissement ganglionnaire axillaire de 0,2 à 2 mm (micrométastases) ou < 0,2 mm (cellules isolées): les données actuellement disponibles sur l’irradiation ganglionnaire ne permettent pas de valider son indication chez ces patientes.
-Absence d’envahissement ganglionnaire axillaire
Bien que communément proposée, les données actuellement disponibles sur l’irradiation de la chaîne mammaire interne pour les tumeurs du quadrant interne ne permettent pas de valider formellement son indication chez ces patientes.
Pour les tumeurs des quadrants externes, l’irradiation des aires ganglionnaire n’est pas indiquée.
c-Irradiation axillaire
L’irradiation axillaire majore le risque de complications locorégionales.
Après chirurgie de l’aisselle, son indication est limitée et doit être posée en RCP en tenant compte du nombre de ganglions examinés et du nombre de ganglions atteints ainsi que la présence éventuelle d’une extension extraganglionnaire.
Radiothérapie après traitement systémique néoadjuvant
Les indications de la radiothérapie après un traitement systémique néoadjuvant suivi d’une chirurgie reposent sur les critères pronostiques initiaux et non sur les résultats anatomopathologiques définitifs.
En présence de facteurs de risque initiaux, une radiothérapie adjuvante locorégionale est systématiquement indiquée.
En cas de mastectomie, elle inclut la paroi thoracique ; en cas de chirurgie conservatrice, la glande mammaire et le lit tumoral.
Quelle que soit la chirurgie, l’irradiation systématique de la chaîne mammaire interne et du creux sus claviculaire est indiquée.
L’indication de la radiothérapie se discute dans certains cas particuliers, notamment en cas de petit volume mammaire, en l’absence de facteurs de risque initiaux (taille tumorale < 30 mm, faible grade histologique, N0 clinique).
Après chirurgie conservatrice :
-L’irradiation de la glande mammaire et du lit tumoral est systématiquement indiquée.
-L’irradiation des aires ganglionnaires est à discuter en RCP.
Après mastectomie : la radiothérapie de la paroi et des aires ganglionnaires (chaîne mammaire interne – creux sus claviculaire) est à discuter en RCP.
Situations particulières
-En cas de cancer métastatique d’emblée, une irradiation locorégionale doit être envisagée.
-Quand un traitement chirurgical est indiqué mais n’a pu être réalisé, quel qu’en soit le motif, une irradiation du sein et de la tumeur en place ainsi que l’ensemble des aires ganglionnaires est indiquée.
-Après une chirurgie oncoplastique, l’irradiation du sein et du lit tumoral est systématique comme après toute chirurgie conservatrice.
-Après reconstruction mammaire, l’irradiation de la paroi thoracique n’est pas contre‐indiquée et doit être posée selon les risques de récidive.
Un âge avancé n’est pas un facteur limitant à l’indication de la radiothérapie.
Délais
Un retard dans l’initiation de la radiothérapie peut être associé à une augmentation du risque de récidive locorégionale.
– En l’absence de chimiothérapie adjuvante, le délai de mise en route de la radiothérapiene doit pas dépasser 12 semaines après chirurgie.
-Après une chimiothérapie adjuvante, il est recommandé de ne pas débuter la radiothérapie au-delà de 6 mois après la chirurgie et au-delà de 5 semaines après la chimiothérapie.
-La réalisation d’une reconstruction mammaire immédiate ou la prescription d’une thérapie ciblée ne doivent pas modifier ces délais.- Modalités de l’irradiation
Modalités
a-Le schéma de référence, pour tous les volumes traités est de 50 Gy en 25 fractions sur 33 jours.
b-Les données actuellement disponibles sur les schémas d’administration hypofractionnés ne permettent pas à ce jour de valider formellement leur indication. C’est le concept d’irradiation partielle accélérée du sein (IPAS) permet de proposer, chez les patientes présentant un cancer du sein de stade précoce à faible risque de récidive locale, une irradiation focalisée de courte durée (quelques heures à 5 jours de traitement) sans sur-risque de récidive locale.
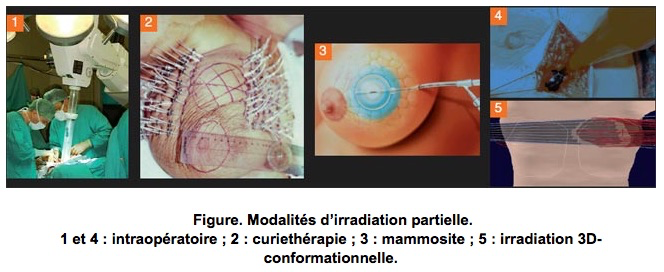
c-La radiothérapie per-opératoire
Afin de limiter les effets indésirables et minimiser l’impact de la maladie et des traitements sur la vie des patientes, l’heure est à la recherche de ce que l’on appelle la désescalade thérapeutique. Il s’agit d’obtenir les mêmes résultats en termes de guérison en utilisant moins de traitements et/ou des traitements moins lourds, moins longs et/ou moins invasifs, etc.
Dans ce contexte général, une nouvelle approche est testée depuis plusieurs années, dans la prise en charge des cancers du sein traités par chirurgie conservatrice. Il s’agit de la radiothérapie peropératoire qui consiste à délivrer, pendant l’intervention chirurgicale, une dose de rayons directement sur le lit tumoral. Cette nouvelle technique permet d’éviter 5 à 6 semaines de radiothérapie après la chirurgie (comme c’est le cas actuellement), les déplacements et la fatigue qu’elles engendrent. Elle permet également de limiter les effets secondaires puisque la zone traitée est extrêmement ciblée et les tissus sains sont épargnés.
En pratique, une fois que le chirurgien a procédé à l’ablation de la tumeur, la sonde de radiothérapie est positionnée directement au contact des tissus et délivre une dose de rayons pendant une trentaine de minutes. Tout se passe donc au bloc opératoire. Dans certains cas, cette unique séance de radiothérapie suffira. Dans d’autres cas, elle sera suivie de 5 à 8 séances complémentaires (versus 25 séances).
Cette technique est aujourd’hui en phase d’expérimentation. Elle est proposée dans certains centres, à des femmes âgées de plus de 60 ans, présentant une petite tumeur canalaire infiltrante hormonodépendante et ne surexprimant pas HER2, sans ganglions lymphatiques envahis.
7-Séquelles
La radiothérapie peut entraîner des séquelles à long terme (esthétiques, fonctionnelles, cardiovasculaires et pulmonaires). Elle doit donc être conduite avec une grande rigueur afin de limiter l’irradiation des tissus sains, cibler parfaitement le volume traité et répondre à des critères d’assurance qualité.
L’hormonothérapie
‘hormonothérapie consiste à empêcher les actions des estrogènes qui sont des hormones ayant un effet stimulant sur le cancer.
L’hormonothérapie ne peut être indiquée qu’en cas de tumeur hormonosensible (exprimant au moins un des 2 récepteurs hormonaux). C’est-à-dire que l’étude immunohistochimique de la tumeur doit montrer la présence de récepteurs aux estrogènes ou/et à la progestérone: tumeur RE+ ou/et RP+. Une hormonothérapie adjuvante est systématiquement prescrite pour les tumeurs exprimant une positivité significative pour au moins l’un des récepteurs hormonaux (exception faite de quelques tumeurs d’excellent pronostic).
On distingue :
1- Les traitements qui bloquent les effets des estrogènes. Ce sont:
a-Les antiestrogènes : les SERM (Selective Estrogen Receptor Modulator) dont le chef de file est le tamoxifène, utilisé depuis plus de 30 ans. ce produit va prendre la place des estrogènes au niveau des récepteurs et peut être prescrit chez toutes les femmes ménopausées ou non (action par compétition). Il est actuellement commercialisé sous deux noms : Nolvadex® ou Tamoxifène®, mais c’est le même médicament. Il se prend en comprimés à la dose de 20mg/jour.
b-Les antiaromatases : ce sont des traitements qui suppriment la production d’estrogènes à partir des androgènes (produits par les glandes surrénales). Dans un certain nombre de cellules de l’organisme, dont les cellules adipeuses (cellules de la graisse) et présentes au niveau des seins, il existe une enzyme permettant la transformation des androgènes en estrogènes (aromatase). Les antiaromatases empêchent l’action de l’aromatase, c’est-à-dire que les androgènes ne se transforment plus en estrogènes. Ces traitements ne peuvent être administrés que chez les femmes ménopausées et une ostéodensitométrie sera réalisée avant le début du traitement.
Les anti-aromatases les plus utilisés en France sont:
–Le létrozole (Femara®). Indiqué chez les femmes ménopausées ayant préalablement reçu un traitement adjuvant standard par tamoxifène pendant 5 ans en prolongation du traitement adjuvant du cancer du sein à un stade précoce (pour une durée d’au moins 2 ans).
–L’anastrozole (Arimidex® ). Indiqué dans le traitement du cancer du sein chez la femme ménopausée ayant des récepteurs hormonaux positifs, en traitement adjuvant.
–L’exémestane (Aromasine®). L’exemestane est indiqué désormais dans le traitement hormonal adjuvant du cancer du sein invasif à un stade précoce exprimant des récepteurs aux estrogènes selon un schéma séquentiel combinant le tamoxifène puis l’aromasine. Chez les patientes traitées depuis 2 à 3 ans avec succès par tamoxifène, le traitement séquentiel a été plus efficace qu’un traitement par tamoxifène poursuivi pendant 5 ans. Le profil de tolérance de ces deux stratégies thérapeutiques est différent.
Les données cliniques actuelles ne permettent pas de positionner le traitement séquentiel par rapport à un traitement par inhibiteur de l’aromatase pendant 5 ans ou par rapport à un traitement par tamoxifène 5 ans puis par létrozole (FEMARA) .
Ce sont des inhibiteurs de 3ème génération. Ces trois médicaments sont prescrits sous forme de comprimés à raison d’un par jour.
2- Les traitements qui suppriment, chez les femmes non ménopausées, la synthèse des estrogènes:
-Les analogues du Gn-RH.
-La castration chirurgicale (ovariectomie bilatérale).
-La castration radiothérapique (irradiation des ovaires).
L’hormonothérapie, qu’il s’agisse de la suppression ovarienne, des antiestrogènes et/ou des antiaromatases, est utile pour diminuer le risque de récidive locale dans le sein opéré, le risque d’atteinte au niveau de l’autre sein, le risque d’avoir une évolution générale sous forme d’une métastase à distance. Cela n’est vrai, bien sûr, que chez les patientes hormonosensibles, c’est-à-dire dont la tumeur présente des récepteurs aux estrogènes et/ou à la progestérone. Il est habituel d’administrer l’hormonothérapie après la chimiothérapie et la radiothérapie si elles sont indiquées.
En cas de tumeur lentement évolutive, chez une femme âgée, exprimant des récepteurs hormonaux, une hormonothérapie exclusive peut être décidée. En cas de cancer infiltrant et volumineux et/ou inflammatoire, un traitement systémique néoadjuvant est parfois indiqué en vue d’une réduction première du volume tumoral. Il peut être discuté en cas de cancer d’emblée inopérable, ou selon la taille de la tumeur pour permettre l’accès à une chirurgie partielle.
Le tamoxifène est en général bien toléré. Cependant, quelques effets secondaires apparaissent parfois. Certains ressemblent aux symptômes de la ménopause, notamment les bouffées de chaleur, présentes une fois sur deux.
Avant la ménopause, le tamoxifène bloque quelquefois les règles ou les rend irrégulières. Il provoque parfois également des kystes fonctionnels de l’ovaire sans gravité.
Chez la femme ménopausée ou non, le tamoxifène peut entraîner des saignements parfois dus à un épaississement de la muqueuse sans gravité. Toute perte de sang doit vous amener à consulter votre médecin.
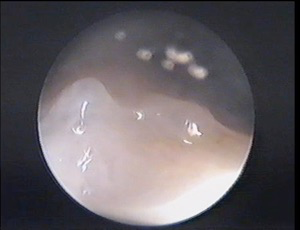
Le tamoxifène augmenterait le risque de cancer de l’endomètre (muqueuse de l’utérus). Ce risque est faible. Des cancers de l’utérus ont surtout été décrits lorsque le tamoxifène a été prescrit à des doses supérieures à celle de référence. Le bénéfice du tamoxifène est supérieur à ce risque. Le tamoxifène peut favoriser l’évolution d’un fibrome ou d’une endométriose qui existait avant la ménopause. Il est conseillé d’effectuer une surveillance gynécologique régulière mais ces risques ne justifient cependant pas une échographie du pelvis systématique. Le plus souvent ses effets au niveau de l’endomètre consistent à la création d’une atrophie endométriale et une telle atrophie est au contraire protectrice contre le cancer de l’endomètre. Cette atrophie recouvre des microkystes ce qui donne un aspect épaissi et irrégulier de l’endomètre en échographie ce qui à longtemps fait croire à des hyperplasies (qui elles favorisent ce cancer). D’où la légende du «médicament contre le cancer qui donne le cancer!». Ces aspects sont mieux connus depuis que l’on pratique des hystéroscopies diagnostiques. Cet examen permet de voir l’aspect typique des endomètres sous Tamoxifène, c’est-à-dire un aspect de reliefs kystiques sous un endomètre atrophique:
Quel que soit l’âge, le tamoxifène provoque parfois :
– une prise de poids. Plus que le traitement hormonal lui-même, c’est la survenue brutale d’une ménopause qui peut induire une prise de poids. D’autres facteurs associés sont aussi parfois impliqués, comme par exemple le stress, l’anxiété ou encore les traitements par corticoïdes lors de la chimiothérapie.
– des pertes vaginales ;
– plus rarement, des douleurs articulaires et une chute de cheveux (jamais importante).
Dans de rares cas, le tamoxifène peut entraîner :
– des accidents thromboemboliques (embolie pulmonaire ou phlébite profonde). Chez les femmes qui présentent des antécédents thromboemboliques et des facteurs prédisposants (obésité, alitement prolongé, varices très développées), une évaluation et une discussion du rapport entre les bénéfices (efficacité du traitement par anti-œstrogènes) et les risques (troubles thromboemboliques) avec le médecin est nécessaire pour décider du choix du traitement. Une surveillance attentive est par ailleurs recommandée chez ces patientes.
– d’anomalies au niveau du foie : hépatites modifications des enzymes hépatiques, etc.
– des complications oculaires, notamment des cataractes et altération de la rétine (rétinopathie) ;
– des malformations fœtales (on dit qu’il est tératogène).
L’hormonothérapie n’est pas une contraception et le Tamoxifène peut favoriser une grossesse (éffet stimulant sur les ovaires). Bien qu’elle puisse perturber les règles, il est conseillé d’avoir un moyen de contraception durant le traitement. Chez les femmes traitées pour un cancer du sein, la pilule avec des oestrogènes est contre-indiquée.
Pour la femme ménopausée sous traitement hormonal substitutif, le traitement de la ménopause sera arrêté car les traitements à base d’oestrogènes sont contre-indiqués en cas de cancer du sein.
Les anti-aromatases entraînent aussi des effets secondaires. Il peut s’agir :
de bouffées de chaleur,
de sécheresse vaginale,
de douleurs articulaires à type de raideurs articulaires matinales (au niveau des poignets surtout),
d’une fatigue intense,
d’une perte de dynamisme,
et très rarement des thromboses.
Il existe par ailleurs un risque important de décalcification osseuse, voire d’ostéoporose et de fractures osseuses. C’est la raison pour laquelle, avant le début du traitement, une ostéodensitométrie osseuse est couramment effectuée. Elle permet d’évaluer la densité osseuse de départ et d’apprécier le risque de fracture. C’est l’évaluation de la balance bénéfice/risque qui orientera le choix ou non d’un traitement par antiaromatases. Si tout va bien et que les anti-aromatases sont prescrits, une surveillance par ostéodensitométrie est réalisée à intervalles réguliers et un traitement est mis en route le cas échéant. Le médecin peut conseiller d’augmenter la consommation quotidienne de calcium et de vitamine D. En cas d’ostéoporose avérée, une consultation spécialisée doit être envisagée.
Il est conseillé d’assurer une surveillance gynécologique régulière pendant la durée du traitement par hormonothérapie.
Les thérapies ciblées
Des découvertes récentes ont permis la mise au point de nouveaux médicaments dont la façon d’agir est sensiblement différente de la chimiothérapie : ils ne s’attaquent plus à l’ADN des cellules cancéreuses, mais limitent ou arrêtent leur développement.
On parle de thérapies ciblés car ils visent une cible bien identifiée et les mécanismes grâce auxquels la tumeur se développe et se multiplie. Ces traitements privent la tumeur d’éléments nécessaires à son développement.
Il en existe actuellement trois sortes:
1-Les thérapies ciblées anti-HER2
Une surexpression de HER2 s’observe dans 20 à 30 % des cancers primitifs du sein. Des études montrent que la survie est plus courte chez les patientes dont les tumeurs surexpriment HER2 que chez celles dont les tumeurs ne présentent pas cette surexpression. On utilise chez ces patientes des molécules soit par voir intraveineuse ou sous cutanée:
-le trastuzumab (nom commercial Herceptin®, aussi Kadcyla® qui st du trastuzumab emtansine);
-le pertuzumab (nom commercial Perjeta®),
Ces produits sont prescrit en association avec la chimiothérapie, si possible poursuivi pendant la radiothérapie et après la radiothérapie pour une durée totale de traitement qui est actuellement de 1 an après la fin du traitement local.
Le Trastuzumab est cardiotoxique (myocardiopathie, insuffisance cardiaque sont possibles dans moins de 5% des cas) et on conseille une échographie cardiaque avant le début du traitement puis en fonction des symptômes observés.



2-La thérapie ciblée anti-VEGF s’adresse aux patientes en situation métastatique en association avec une chimiothérapie par paclitaxel. Son seul représentant est actuellement le Bevacizumab (Avastin®) en intraveineux. Avastin est indiqué en association au paclitaxel en traitement de première ligne du cancer du sein métastatique, mais compte tenu du faible gain de survie sans progression et de l’absence d’amélioration de la survie globale avec l’association bevacizumab/taxane versus taxane, l’intérêt de l’ajout de bevacizumab au paclitaxel est aujourd’hui moins bien établi.
Cet intérêt est limité aux patientes négatives aux récepteurs HER2, aux œstrogènes et à la progestérone.
3-La thérapie ciblée anti mTOR
La protéine mTOR est une sérine-thréonine kinase c’est-à-dire qu’elle catalyse, lorsqu’elle est activée, la phosphorylation de deux acides aminés sérine et thréonine sur des protéines cibles intra-cellulaires. l’activation de mTOR aboutit à la progression du cycle cellulaire de la phase G1 à S et donc à la prolifération cellulaire.
La rapamycine est une substance d’origine bactérienne découverte pour la première fois dans le sol de Rapa-Nui (l’île de Pâques). Elle possède des propriétés immunosuppressives qui en font l’un des médicaments utilisés pour limiter les risques de rejets en cas de greffe. La rapamycine une fois liée au FKBP12 est un inhibiteur de la mTOR. Elle interrompt la transduction des signaux mitogènes par l’inhibition des cyclines nécessaires au passage de la phase G1 à S et par l’inhibition de la synthèse des protéines nécessaires à la progression du cycle cellulaire. L’inhibition de mTOR aboutit donc au blocage du cycle cellulaire en phase G1.
Le traitement consiste en la prise orale de comprimés d’afinitor® en association avec un traitement antihormonal (femara®). En effet, Afinitor® est indiqué dans le traitement du cancer du sein avancé avec récepteurs hormonaux positifs, HER2/neu négatif, en association avec le traitement anti-hormonal, chez les femmes ménopausées sans atteinte viscérale symptomatique dès récidive ou progression de la maladie et précédemment traitées par un inhibiteur non-stéroïdien de l’aromatase.Ce traitement peut entrainer des Inflammations buccales, un risque accru d’infection, de toux , de diarrhées, de nausées, fatigue, éruption cutanée,baisse des globules, élévation de la glycémie et du cholestérol.
4-Inhibiteurs de la protéine-kinase
-Le Lapatinib, commercialisé sous le nom de Tyverb®, appartient à un groupe de médicaments appelés inhibiteurs de la protéine kinase. Ces composés agissent en bloquant des enzymes connues sous le nom de protéines kinases, dont certaines sont des récepteurs situés à la surface des cellules cancéreuses, comme l’HER2. En bloquant ces récepteurs, le lapatinib contribue à limiter la division et le développement des cellules cancéreuses.
Le lapatinib est utilisé pour certains cancers du sein métastatique HER2 positifs. Il se présente sous forme de comprimés.
-L’Evérolimus, commercialisé sous le nom d’Afinitor®, il appartient au groupe des médicaments appelés inhibiteurs de protéines kinases. L’évérolimus agit en se fixant sur une protéine à l’intérieur de la cellule tumorale pour bloquer un des mécanismes de prolifération et de division cellulaire.
Ce traitement, qui se présente sous forme de comprimés, peut être utilisé en association avec certaines hormonothérapies pour prendre en charge des cancers du sein métastatiques avec des récepteurs hormonaux positifs.
Les Biphosphonates
Les biphosphonates font partie de l’arsenal thérapeutique en cas de métastases osseuses par leur action anti-ostéoclastique. Il faut rappeler que ces métastases sont responsables de complications qui altèrent la qualité de vie des patients.
Les produits
On distingue trois générations de biphosphonates. La première, les non-amino-biphosphonates (étidronate, clodronate) sont des analogues cyto- toxiques de l’ATP rendant non hydrolysables les cellules qui les incorporent. La seconde génération correspond aux amino-biphosphonates (pamidronate, alendronate) qui sont 100 à 500 fois plus puissants grâce au groupement amine. Les biphosphonates de 3ème génération (ibandronate, zolédronate) ont une action 10 à 20 fois plus puissante que la génération précédente par la méthylation du groupe amine.
Les biphosphonates les plus utili- sés sont le clodronate (Clastoban®, Lytos®), le pamidronate (Aredia®), le zolédronate (Zometa®), l’ibandronate (Bondronat®). Le zolédronate est actuellement le traitement de référence.
Le clodronate et l’ibandronate sont disponibles sous forme orale. L’ibandronate est également disponible en perfusion. Le pamidronate et le zolédronate n’existent qu’en perfusion et sont les molécules les plus utilisées en pratique. Les formes orales sont prescrites essentiellement pour les patients ayant un traitement au long court ne nécessitant pas d’hospitalisations (telle que l’hormonothérapie). Le confort de vie est privilégié mais il faut cependant surveiller la tolérance digestive. L’efficacité du clodronate semble moins bonne que celles des biphosphonates sous forme intra-veineuse. Dans le cancer du sein, on conseille une injection de pamidronate (90 mg/2h) ou de zolédronate (4 mg/15min) toutes les 3 ou 4 semaines chez les patients ayant des lésions osseuses mises en évidence sur les radiographies stan- dards, la scintigraphie, le scanner ou l’IRM.
Les indications
Les biphosphonates sont indiqués chez les patientes ménopausées ayant un cancer luminal. Ces produits concernent:
· le traitement de l’hypercalcémie maligne;
· le traitement palliatif de l’ostéolyse maligne, avec ou sans hypercalcémie, en complément du traitement spécifique de la tumeur primitive.
L’effet antalgique des biphosphonates est constaté dans 50% des cas dès la deuxième perfusion.
De nombreuses études ont montré l’efficacité des biphosphonates à réduire les évènements osseux: fracture, tassement vertébral, hypercalcémie, compression médullaire, et pour certains auteurs une accentuation de la douleur. Leur incidence peut atteindre 30% des patients porteurs de métastases osseuses.
Malgré ces résultats encourageants, aucune étude n’a démontré de bénéfice en terme de survie globale sur le cancer.
les effets secondaires
L’injection de zolédronate et de pamidronate peut être suivi de fièvre, d’arthralgies, de myalgies, et d’une augmentation transitoire de la douleur dans 1 à 18% des cas . Depuis quelques années, des cas d’ostéonécrose de la mâchoire ont été rapportés imposant une vigilance particulière.