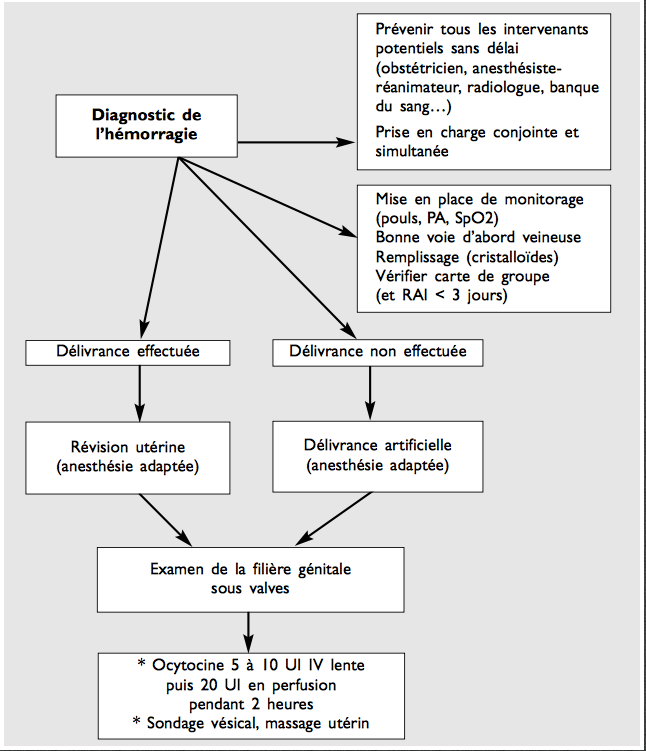
La mortalité maternelle reste très élevée dans le monde, aux environs de 127 000 décès par an et l’hémorragie en est la principale cause, représentant 24 % des cas.
Définition
L’hémorragie de la délivrance est définie par l’OMS comme une hémorragie
-d’origine utérine,
-survenant dans les 24 heures suivant l’accouchement,
-et dont la perte sanguine est égale ou supérieure à 500ml.
Elle concerne 5% des accouchements et représente en france la première cause de mortalité maternelle (1/100000 naissances).
Ces hémorragies qui sont d’origine utérine et liées à la délivrance, sont une partie des hémorragies dites contemporaines de la délivrance telles que les plaies du col ou les plaies vaginales qu’il est important de reconnaître.
La délivrance physiologique «normale»
La délivrance évolue cliniquement en trois phases :
— une phase de rémission clinique ;
— une phase de migration du placenta ;
— une phase d’expulsion
1-La phase de rémission clinique
Cette phase correspond à la rétraction passive de l’utérus. Elle dure en moyenne 5 à 15 minutes et ne devrait pas dépasser une demi-heure.
C’est une période d’attente au cours de laquelle :
-on s’assure de l’absence d’hémorragie. L’accoucheur ne doit pour cela pas quitter l’accouchée. La perte de sang considérée comme physiologique, et que l’on a tendance à sous estimer, ne doit pas être supérieure à 500 cc ;
-on contrôle par le palper abdominal la bonne tonicité utérine.
2-La reconnaissance du passage du placenta dans le vagin
Elle se fait sur trois signes :
-Le globe de sécurité
Après une ascension momentanée correspondant au passage du placenta dans le segment inférieur, le fond utérin redescend et, sous l’effet de la rétraction utérine, est perçu au palper sous la forme d’une masse dure, à peu près à hauteur de l’ombilic. La perception de ce globe est le garant d’une bonne hémostase ; c’est le «globe de sécurité» de Pinard. L’utérus rétracté est en règle incliné à droite.
-La manœuvre de refoulement du corps utérin
Le cordon s’abaisse hors de la vulve. Si alors on refoule le corps utérin vers le haut par une pression à travers la paroi abdominale, le cordon ne remonte pas dans le vagin, alors qu’il remonterait si le placenta était encore adhérent au corps utérin.
-Le toucher vaginal
Il permet la constatation directe du placenta dans le vagin et précise la position de l’insertion du cordon.
3- L’expulsion
C’est la période d’intervention. Il faut :
-Exprimer le placenta hors du vagin
La manœuvre sera très douce afin de ne pas déchirer les membranes qui sont encore en partie adhérentes. Elle comporte deux gestes simultanés :
-un mouvement de piston : la main empaumant le fond utérin, elle le redresse dans l’axe du vagin et le refoule vers le bas de manière douce, suffisante et continue , extériorisant le placenta comme un piston ;
-une tension sur le cordon accompagne ce mouvement. Il est interdit de tirer sur le cordon. Il suffit de diriger son expulsion en exerçant une simple tension, soit vers le bas si le toucher a montré que l’insertion du cordon se trouve en avant sous la symphyse, soit vers le haut si l’insertion est en arrière.
Le placenta est recueilli dans un plateau, de telle manière que l’extraction des membranes dernières puisse s’effectuer par le seul poids du délivre, en «bavant» hors de la vulve. Si les membranes ont tendance à se déchirer, il ne faut surtout pas tirer mais les reprendre à l’aide d’une pince et effectuer des mouvements de torsion pour extraire les derniers fragments.
Puis il faut vérifier d’un coup d’œil l’absence d’hémorragie et xaminer le placenta afin de vérifier son intégrité au niveau des membranes, la main introduite dans le sac qu’elle déplisse et au niveau de la face maternelle, à la recherche d’un cotylédon absent qui se traduirait par un aspect non jointif des cotylédons voisins, laissant voir la plaque choriale. Le diagnostic est plus difficile à la périphérie du placenta. Une telle constatation impose la réalisation immédiate d’une révision utérine ;
4-La surveillance ultérieure
La surveillance de l’accouchée doit se poursuivre pendant deux heures en salle de travail en observant :
— le pouls ;
— la tension ;
— la coloration ;
— l’écoulement sanguin vulvaire ;
— la persistance du globe de sécurité.
5-En conclusion, la délivrance physiologique doit réunir 4 conditions:
-délivrance complète (c’est-à-dire qu’il ne manque ni cotylédon ni membrane à l’examen du placenta,
-vacuité utérine complète,
-bonne rétraction utérine,
-coagulation sanguine normale.
Les principales causes des hémorragies de la délivrance
1-L’atonie utérine est la cause la plus fréquente. Elle se manifeste par une mauvaise rétraction utérine avec absence du globe utérin de sécurité. Les facteurs favorisants sont: le travail prolongé ou trop rapide, la surdistension utérine (gémellaires, hydramnios, macrosomie foetale), l’âge maternel supérieur à 39 ans (dégénérescence fibreuse du myomètre), un utérus fibromateux ou malformé, l’utilisation récente de tocolytiques, l’anesthésie par les halogénés.
2-La rétention placentaire, qui peut être partielle ou totale.
3-Les troubles de la coagulation: coagulation intravasculaire disséminée (CIVD) et/ou fibrinolyse. Ils peuvent être la cause ou la conséquence de l’hémorragie. Cause, notamment dans les situations de prééclampsie, d’infections graves, d’hématome rétroplacentaire, ou bien souvent conséquence car si l’hémorragie n’est pas prise en charge assez rapidement elle provoque une perte des facteurs de coagulation.
4-L’inversion utérine est exceptionnelle. C’est une inversion de l’utérus en doigt de gant favorisée par l’atonie utérine, une traction excessive sur le cordon ou une expression trop foret sur le fond utérin.
5-Le placenta accreta est une anomalie de l’implantation du placenta. Les villosités placentaires pénètrent dans le myomètre et il n’y a pas de plan de clivage entre l’utérus et le placenta. les villosités peuvent parfois pénétrer la totalité du myomètre voire atteindre les organes de voisinage: on parle alors de placenta percreta. Le problème est que dans ces cas la délivrance est impossible, qu’elle soit naturelle ou manuelle. Les facteurs favorisant du placenta acreta sont: les antécédents de césarienne, de curetages, la grande multiparité, l’âge maternel supérieur à 35 ans, le tabagisme, les antécédents de myomectomie, la présence d’un placenta praevia.
La prise en charge de ces hémorragies
Une hémorragie de la délivrance est une urgence obstétricale qui engage le pronostic vital de la patiente. Et tout va dépendre de la rapidité de sa prise en charge.
On peut distinguer trois degrés successif dans la prise en charge auxquels on recours si nécessaire et dans l’ordre.
A-Premiere étape
1-Assurer la vacuité de l’utérus, c’est-à-dire révision utérine en urgence ou si la délivrance n’est pas faite: délivrance artificielle suivie d’une révision utérine. Il est délicat de faire ces geste sans anesthésie. C’est pourquoi la perte de temps est bien moindre (quasi nulle) si la patiente avait une péridurale. Dans le cas contraire une anesthésie générale est nécessaire avec tous les risques qu’elle comporte en urgence. C’est cet argument qui devrait justifier l’adoption de la péridurale, bien avant la lutte contre la douleur qui, elle, n’est pas vitale.
2-Examen sous valves du col et du vagin à la recherche de lésions hémorragiques de la filière génitale. Elles sont souvent sous-estimées en cas d’hémorragie après nais- sance par manœuvres instrumentales (forceps et spatules en particulier). Elles peuvent siéger à tous les niveaux, de l’utérus au périnée. Elles peuvent concerner tous les niveaux de la filière génitale : rupture utérine, thrombus vaginal, déchirures du col, déchirures vaginales, vulvaires et périnéales.
La rupture utérine se voit surtout en cas d’accouchement par voie basse sur utérus cicatriciel. L’hémorragie n’étant pas toujours extériorisée, la rupture utérine doit être recherchée en cas d’instabilité hémodynamique non expliquée par les pertes objectivées.
Les déchirures du col de l’utérus peuvent survenir lors d’efforts expulsifs ou de manœuvre instrumentale sur un col incomplètement dilaté. Les déchirures vaginales, vulvaires et périnéales doivent êtres suturées rapidement.
Le thrombus vaginal, ou hématome paravaginal, est souvent non extériorisé lorsque la muqueuse vaginale est intacte. Il constitue une hémorragie interne pouvant être massive, fusant en rétropéritonéal. Les signes révélateurs peuvent être une douleur intense à la levée de la péridurale (hématome sous tension), un hématome des grandes lèvres, une hypotension, voire un état d’agitation non expliqué.
3-Favoriser la rétraction de l’utérus: massage utérin et ocytocyques par voie veineuse. L’ocytocine est préconisée de première intention en cas de surve- nue d’une HPP : 5 à 10 UI en IV lente suivie d’une perfusion d’entretien : 5 à 10 UI par heure pendant 2 heures. L’ocytocine est un puissant vasodilatateur qui peut être source d’hypotension artérielle si la volémie est insuffisante et/ou en cas d’injection en IVD rapide. L’injection sur voie périphérique doit être la règle. Les bolus peuvent provoquer des douleurs transitoires au point de perfusion.
4-Et en parallèle des gestes de réanimation:
-pose d’une 2ème voie veineuse de bon calibre,
-scope cardiotensionnel,
-oxygénothérapie, mise en position de Trendelenbourg (tête plus basse que les jambes),
-prise de sang pour premier bilan biologique: NFS, groupe, agglutinines, plaquettes, TP, TCA, fibrine, PDF, D-dimères,
-compensation des pertes sanguine par solutés de macromolécules, transfusion sanguine si nécessaire (au dessous de 8g d’hémoglobine) et prise en charge d’une éventuelle coagulopathie associée.
Puis est mis en place une surveillance rapprochée (globe utérin, arrêt des saignements) avec quantification des pertes sanguines à l’aide d’un dispositif de recueil.
On notera que tous ces gestes qui doivent être urgents et quasiment simultanés nécessitent la présence rapide d’un personnel suffisant, y compris anesthésique.
La transfusion de globules rouges a pour but avant tout de maintenir l’oxygénation tissulaire. Les globules rouges sont indispensables à la formation du caillot. Devant la surestimation possible du taux d’hémoglobine en cours d’hémorragie, la difficulté d’évaluer les pertes sanguines souvent sousestimées, du retard fréquent de la transfusion encore observé lors de la dernière enquête de mortalité, la tendance actuelle est de recommander de maintenir le taux d’hémoglobine (Hb) à 10 g/dl tant que l’hémorragie persiste. La transfusion de plasma frais congelé a pour but d’apporter des facteurs de coagulation et du fibrinogène, indispensables à la formation du caillot.
Les données actuelles de la littérature sont en faveur de l’administration précoce de plasma frais avant les résultats des examens biologiques afin de limiter, voire prévenir la coagulopathie de l’hémorragie massive, espérant ainsi réduire l’importance et la gravité de l’hémorragie. Cependant, la transfusion de plasma frais congelé a des limites : délai d’obtention long (décongélation et acheminement), apport faible de fibrinogène, risque de complications graves (syndrome de détresse respiratoire aigüe,oedème pulmonairelésionnel lié à la transfusion, syndrome de défaillance multiviscéral).
La transfusion de plaquettes est classiquement recommandée de façon à maintenir un taux supérieur à 50 000/mm3. Les plaquettes sont indispensables à la formation du caillot. Pour les mêmes raisons que pour les facteurs de coagulation, l’administration précoce et plus importante de Pt pourrait constituer une bonne stratégie.
Autre problème: le fibrinogène. Le fibrinogène est transformé en fibrine indispensable à la stabilisation du caillot par activation de la cascade de coagulation. Le fibrinogène est le facteur le plus augmenté en fin de grossesse (4 à 7 g/l) et le plus consommé au cours de ces hémorragies. La concentration de fibrinogène plasmatique à la phase initiale de l’hémorragie est le seul paramètre indépendant qui prédise de la sévérité d’une hémorragie du post-partum et toutes les patientes qui ont un taux de fibrinogène < 2 g/l évolueront vers une forme grave.
De nombreuses études suggèrent l’intérêt de la correction précoce de l’hypofibrinogénémie par l’administration de concentrés de fibrinogène.
Le Clottafact®, immédiatement disponible, n’expose pas au risque de surcharge et peut être administré précocément en attendant le plasma frais congelé et les plaquettes (Clottafact® 1,5g fibrinogène poudre/flacon dans le réfrigérateur du bloc). Il faut 2 flacons = 200 ml = 3g pour augmenter le taux plasmatique de 1G/l.
Place du facteur VII activé recombinant (FVIIa rec) Novoseven®
Le FVIIa rec est un puissant activateur de la coagulation. Son efficacité dans les hémorragies du post-partum est reconnue en France depuis 2008 et son administration est réglementée par un protocole thérapeutique temporaire reconduit en 2012. Une étude regroupant 272 patientes à partir de 6 séries publiées et 3 registres internationaux, montre qu’une dose moyenne de 80 µg/kg de FVIIa rec permet de réduire, voire d’arrêter le saignement dans plus de 85 % des cas d’HPP, au prix de 2,5 % d’événements thromboemboliques (Franchini, 2010). Encore plus récemment, une étude prospective randomisée, non encore publiée, étudiant l’efficacité et la tolérance du FVIIa rec administré précocement quand l’HPP devient résistante à la sulprostone, retrouve une réduction de 40 % de recours aux thérapeutiques invasives (93 %/52,4 % ; n = 84 p < 0,0001) ; 2,4 % d’ETE étaient observés (Aya, 2013).
D’autres études sont nécessaires pour préciser tant l’efficacité en termes de réduction du taux d’hystérectomies que le risque thromboembolique réel.
En attendant et en pratique
• Novoseven® poudre, 1 mg/ml de FVIIa après reconstitution, disponible à la pharmacie.
• 60 à 90 µg/kg IVL sur 5 min (4 à 6 mg pour 70 kg).
• Après échec de la sulprostone et des thérapeutiques invasives.
• APRÈS tentative de correction de l’hémostase, de l’hypothermie et de l’acidose.
• Si possible avant l’hystérectomie.
• Prévention et surveillance survenue d’ETE en post-partum +++
• 620 € le mg (> 2 500 €/70 kg).
B-Deuxième étape
Il est mis en oeuvre si l’hémorragie persiste alors que le premier temps a été réalisé correctement.
On utilise le Nalador® (Sulprostone) qui est une prostaglandine, en l’absence de contre-indication (pathologies cardiaques, antécédents d’asthme, troubles sévères de la fonction hépatique, diabète décompensé, antécédents comitiaux). La posologie habituelle est d’une ampoule de 500μg sur 5 heures à la seringue électrique. En cas d’atonie sévère, il est possible de réaliser une dose de charge par l’administration d’une ampoule de 500μg sur une heure (250μg sur 20 minutes puis 250μg sur les 40 minutes suivantes. Il est déconseillé de dépasser la posologie de 500μg sur une heuresous peine de voir des effets secondaires (nausées, vomissements, bronchospasme, ischémie myocardique). Une hyperthermie supérieure à 39°, non infectieuse, accompagne souvent l’administration de Nalador® . L’efficacité de ce traitement sur l’atonie utérine est bonne sil est commencé tôt. On considère qu’un délai de mise en route supérieur à 30 minutes multiplie par 8 les risques d’échec.
En même temps, on recherche un trouble de la coagulation entretenant la mauvaise contractilité utérine (CIVD, fibrinolyse réactionnelle, perte de facteurs de coagulation). La CIVD est définie par un TP<50%, un fibrinogène <1g/l et des plaquettes <50000. Une fibrinolyse peut être associée et les bilans doivent être interprétés de façon cinétique. On va administrer:
-du fibrinogène (Clottagen® ) si la taux plasmatique est <1g/l ou si le temps de coagulation sur tube sec est supérieur à 7 minutes. On le donne à 0,1g/kg.
-du plasma frais congelé qui apporte les facteurs de coagulation consommés (V, VIII, I) et les inhibiteurs (antithrobine, protéine C, protéine S). On vise à obtenir un facteur V à 30%.. La posologie est de 20ml/kg.
Le facteur VII activé recombinant (rFVIIa, NovoSeven) est un médicament procoagulant très puissant qui active directement le facteur X à la surface des cellules, notamment des plaquettes, conduisant à la génération de thrombine et à l‘activation de la coagulation à l‘endroit de la brèche vasculaire. Il a été développé pour le traitement des hémorragies chez les patients hémophiles ayant des anticorps contre les facteurs VIII et IX. Cet agent a ensuite été utilisé dans de nombreuses autres indications (hémorragies majeures au cours d‘interventions chirurgicales, de poly-traumatismes, dans certains cas de thrombopathie, throm-bopénie, etc.). Pour les hémorragies du post-partum, des résultats intéressants en termes d‘épargne transfusionnelle, de morbidité et de mortalité maternelles ont été décrits. De nombreux cas ont été publiés décrivant l’utilité du rFVIIa dans les hémorragies sévères du post-partum, permettant d‘éviter des hystérectomies d‘hémostase. Toutefois, sa place par rapport à d‘autres procédures telles que l‘embolisation artérielle ou la ligature vasculaire n‘est pas encore clairement établie. Il est possible qu‘une utilisation relativement précoce du rFVIIa puisse permettre d‘épargner des transfusions, mais aussi de diminuer le recours à des actes invasifs, d‘éviter des transferts de patientes instables vers un centre de référence et de diminuer la mortalité. Les doses habituellement employées varient entre 60 et 120 [μg/kg ; l‘injection peut être répétée trois heures plus tard en cas de persistance de l‘hémorragie. Une étude multicentrique est actuellement en cours dont le but est de mieux définir le moment optimal de l‘utilisation de cette substance et d‘évaluer les rapports bénéfice/risque et coût/efficacité.
Le rôle du fibrinogène semble aussi important dans la gestion des hémorragies du post-partum. Comme pour le rFVIIa, des études sont en cours pour déterminer si l‘administration précoce de fibrinogène en cas d‘hémorragie du post-partum chez des patientes est efficace.
-L’apport de plaquettes est justifié si elle sont inférieures à 50000. La posologie est de 1 concentré standard pour 10 kg de poids.
-L’activité fibrinolytique circulante est traitée en cas de défibrinogénation prouvée biologiquement (baisse du temps de lyse des euglobulines, Augmentations des PDF et des D-dimères et baisse du fibrinogène. On utilise l’Exacyl® à la dose de 4g puis 1g/heure pendant 6 heures.
L‘effet secondaire le plus redouté de deux agents, fibrinogène et rFVIIa, est une complication thrombotique veineuse, le post-partum étant une période à haut risque. Il est donc important de prescrire une prophylaxie antithrombotique adéquate à ces patientes dès que le problème hémorragique est maîtrisé.
Une antibiothérapie à large spectre est par ailleurs administrée.
C-Troisième étape
Si l’hémorragie persiste malgré les temps précédents effectués correctement, on va avoir recours soit à l’embolisation, soit à la mise en place d’un ballonet de compression type ballonet de Bakri, soit à la chirurgie.
1-L’embolisation délective des artères utérines. C’est une technique de radiologie interventionnelle qui consiste au cathétérisme sélectif des artères utérines par voie fémorale avec l’envoi de particules embolisatrices résorbables destinées à obturer la lumière artérielle. Ce type de technique n’est cependant pas disponible partout 24 heures sur 24 et elle nécesite que la patiente soit en bon état hémodynamique, ce qui n’est pas toujours le cas lorqu’on en arrive à cette étape, pour un geste qui dure de une à trois heures.
L‘embolisation est réalisée par abord transfémoral droit ou gauche à travers un introducteur 5 French. Au début du geste, l‘artériographie pelvienne au moyen d‘un cathéter Pigtail placé dans l‘aorte permet d‘analyser l‘anatomie artérielle et peut parfois mettre en évidence une vascularisation collatérale de l‘utérus par les artères ovariennes ou par les artères cervico-vaginales.
Après cathétérisme sélectif des artères iliaques internes par voie ipsi- et controlatérale, on réalise des sérigraphies en projections antério-postérieures et obliques avec un produit de contraste iodé et non ionique (figure 1). Le saignement peut être visible comme une extravasation intra-utérine de produit de contraste. Cependant, l‘hémorragie utérine du post-partum étant souvent diffuse, la visualisation directe du site d‘hémorragie n‘est pas possible dans plus de la moitié des cas. Ainsi, l‘embolisation bilatérale est souvent nécessaire en utilisant des particules absorbables de gélatine (Gelfoam) qui permettent une occlusion temporaire des différentes branches utérines. Lors d‘un choc hémorragique avec administration de drogues vasoconstrictives, les artères pelviennes ont souvent tendance à se mettre en spasme transitoire. Dans ces cas, il convient de réaliser une embolisation sélective avec un microcathéter coaxial de moins de 3 French. Si le cathétérisme sélectif n‘est pas possible, l‘embolisation semi-sélective du tronc antérieur de l‘artère iliaque interne avec de grosses particules absorbables est acceptable. A noter que le cathétérisme sélectif peut être difficile ou impossible après échec ou tentative d‘une ligature artérielle chirurgicale.
Si la patiente présente toujours des signes d‘hémorragie active au terme de l‘embolisation utérine, il faut chercher activement les collatérales ovariennes ou cervico-vaginales qui participent à la vascularisation utérine et les emboliser de manière sélective. L‘introducteur artériel est laissé en place en cas de coagulation intravasculaire disséminée ou s‘il y a un risque de récidive hémorragique.
2-Le ballonet de Bakri
Le principe du tamponnement intra-utérin repose sur la possibilité de compression intra-cavitaire pour effectuer une pression hémostatique. Autrefois effectuée par l’introduction des mèches dans la cavité utérine, elle a été tentée depuis une dizaine d’années par la mise en place de ballonnets gonflés en intra-utérin. Les parois du ballonnet s’appliquant sur le myomètre permettant d’obturer les vaisseaux notamment au niveau du lit placentaire et du segment inférieur.
Le ballonnet de Bakri est une sonde en silicone porteuse d’un ballonnet pouvant être gonflé jusqu’à 800 cc avec du sérum physiologique. Son extrémité distale comporte un double œillet permettant l’écoulement du sang au-dessus de la sonde vers une poche de recueil.
En cas d’hémorragie après un accouchement par voie basse, la sonde est introduite dans l’utérus jusqu’en butée sans nécessité de recourir à une anesthésie. La position de la sonde peut être vérifiée par l‘échographie puis le ballonnet est gonflé jusqu’à 250 à 500 cc en fonction de la résistance constatée et de l’efficacité.
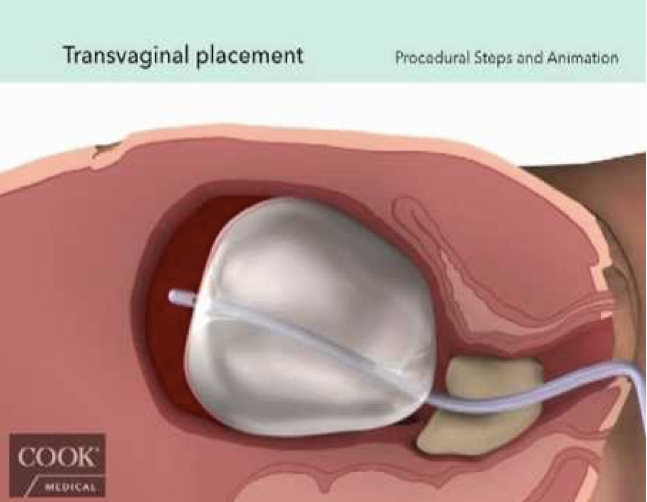
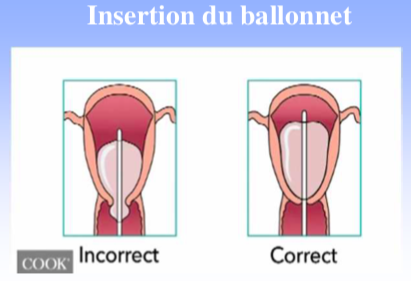
La pose du ballonnet peut également être indiquée au cours d’une césarienne. Le ballonnet est alors
introduit à travers l’hystérotomie et son extrémité distale passée à travers le col vers l’extérieur. L’hystérotomie est alors refermée, le ballonnet est ensuite gonflé jusqu’à l’arrêt de l’hémorragie en vérifiant la suture d’hystérotomie. Le ballonnet peut également être mis en place par voie basse après une césarienne. Le ballonnet est laissé en place entre 12 et 24 heures associé à la poursuite d’un traitement utéro-tonique ainsi qu’à une antibioprophylaxie. Selon les auteurs, le ballonnet peut être retiré après dégonflage partiel ou en un temps.
La mise en place du ballonnet doit intervenir en cas d’HPP persistante après échec de la prise en charge initiale : révision utérine et examen du col et du vagin suivi de l’administration d’utéro-tonique, ocytocine puis sulprostone. Son utilisation a été décrite en cas d’atonie utérine, de placenta praevia, de placenta accreta, de grossesse cervicale, mais aussi en position intra-vaginale en cas de lacérations vaginales importantes L’utilisation du ballonnet est contre-indiquée en cas de chorio-amniotite.
Les revues de la littérature, étudiant les cas utilisant différents types de ballonnets font état d’un taux de succès élevé allant de 82 à 91%% pour Doumoutchtsis (7) à 91%.
Cette efficacité importante associée à la facilité de sa mise en œuvre ont conduit plusieurs sociétés savantes anglo-saxonnes à recommander l’utilisation du tamponnement intra-utérin dans la prise en charge des HPP.
Dans ces recommandations, il apparaît une nouvelle étape dans l’algorithme des prises en charge, à savoir un test de tamponnement par le ballonnet avant de proposer l’étape suivante par embolisation ou chirurgie.
Toutefois les séries rapportées restent peu nombreuses avec des situations souvent hétérogè et des études sur une plus grande échelle sont indispensables afin préciser la place réelle de ces sondes dans le traitement des HPP.
3-Les hémostases chirurgicales
Il existe différentes techniques dont le choix dépend des antécédents obstétricaux de la patiente, de sa stabilité hémodynamique, de l’importance de l’hémorragie et de l’expérience du chirurgien.
a-Les techniques de plicatures et capitonnage utérin
-La technique de B-Lynch: On commence en avant, 3 cm sous l’hystérotomie, à droite, de dehors en dedans, et on reprend son aiguille, de dedans en dehors, 3 cm au-dessus de l’hystérotomie, et à 4 cm du bord de l’utérus. Le fil passe au-dessus du fond utérin à 4 cm de la corne droite. En arrière, l’aiguille transfixie l’utérus, de dehors en dedans, au niveau de l’insertion du ligament utéro-sacré droit. Elle est conduite horizontalement dans la cavité et de nouveau extériorisée, à gauche, pour revenir cravater le fond utérin à 4 cm de la corne gauche. On pénètre une dernière fois dans la cavité utérine, 3 cm au-dessus de l’hystérotomie et à 4 cm du bord utérin gauche. L’aiguille est enfin reprise, 3 cm sous l’hystérotomie en transfixiant de dedans en dehors le segment inférieur.
L’hystérotomie doit être fermée, avant que le B-Lynch ne soit mis en tension et noué, par crainte de ne pas correctement contrôler les angles de l’incision. Durant toute la procédure, le premier aide doit exercer une forte compression bimanuelle sur l’utérus pour que le fil soit posé, sans traction pour qu’il ne coupe pas.
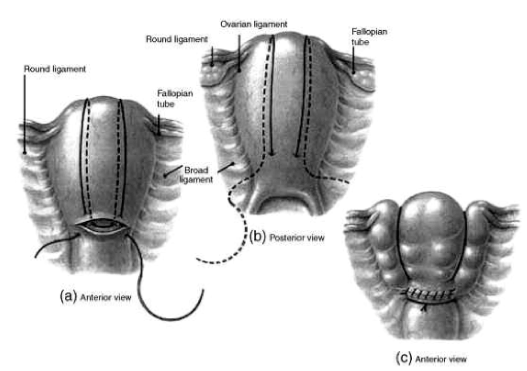
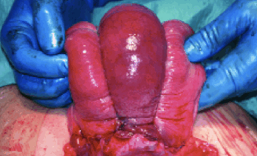
-La technique de Cho. Elle consiste à placer de multiples points en cadre (plus de 32 passages pour Cho). En France, l’équipe de Robert Debré a publié une série simple dans sa réalisation (2 points obliques, 2 points transversaux médians). Il y a aussi celle de Pereira qui combine de multiples sutures, verticales transfixiantes et horizontales sous séreuses. Hackethal est le dernier en 2008 à décrire une technique de points en U horizontaux (6 à 16), du fond utérin au col.

b-Les ligatures vasculaires
-La ligature des bilatérale des artères hypogastriques. Elle est efficace mais peu aisée techniquement. Elle peut être source de complications graves (plaie veineuse, urétérale). Après repérage systématique de l’uretère, la ligature est placée au passe-fil environ deux centimètres sous la bifurcation en prenant garde de ne pas blesser la veine. La ligature ne doit pas être placée à moins de deux centimètres de la bifur- cation iliaque, devant être en aval de l’origine de l’artère fessière. Une ligature proximale est à haut risque de claudication fessière. On vérifie à la fin de la procédure les pulsations de l’artère iliaque externe. Le même geste est réalisé de façon bilatérale. La ligature doit être effectuée à l’aide de fils résorbables.
Certains auteurs ont proposé d’associer une ligature bilatérale des ligaments lombo-ovariens et des ligaments ronds afin d’optimiser les chances de succès. Le taux de succès est très variable dans la littéra- ture, variant de 42 à 93 %. Les causes utérines (atonie, placenta accreta) sont une source importante d’échecs.
-La ligature bilatérale des artères utérines. Il s’agit d’une procédure facile et rapide à réaliser. Le taux de succès rapporté varie de 80 à 96 % des cas.
-La triple ligature de Tsirulnikov. Elle consiste à ligaturer les deux ligaments ronds, les deux utéro-ovarien (N°3) et les deux artères utérines (N°1).
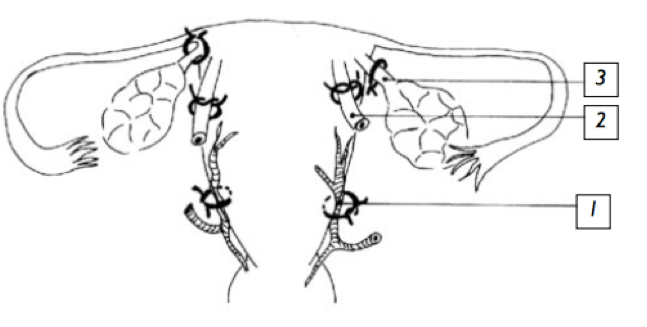
-La ligature étagée «stepwise».Elle comporte 5 étapes facultatives, chaque étape étant réalisée en cas d’échec de la précédente. On considère comme échec la persistance du saignement au bout de 10 minutes. Ces étapes sont: ligature haute des deux artères utérines, ligature basse des artères utérines, ligature d’un lombo-ovarien, ligature controlatérale. Elle peut permettre la dévascularisation du col et donc traiter les étiologies cervicales.
c-L’hystérectomie d’hémostase. Traitement radical, elle est réservée à l’échec des traitements conservateurs (chirurgicaux ou radiologiques) ou aux cas d’hémodynamique instable. C’est une hystérectomie qui est interannexielle, souvent subtotale pouvant ne pas être efficace s’il persiste un saignement au niveau cervico-vaginal.
d-Le tamponnement pelvien est une technique de sauvetage en cas de troubles majeurs de la coagulation, et en cas d’échec de l’hystérectomie d’hémostase.
e-Enfin doivent bénéficier de traitements spécifiques: les plaies cervico-vaginales, la rupture utérine, l’inversion utérine.
D-Le cas du placenta accreta
Le dépistage anténatal du placenta accreta pourrait permettre d’améliorer la prise en charge et il est recommandé. Le diagnostic de placenta accreta peut être suggéré par l’échographie 2D associée au doppler couleur. L’imagerie par résonnance magnétique (IRM) est également une aide au diagnostic. Idéalement, le diagnostic doit être évoqué en anténatal dans tous les cas d’insertion placentaire en regard d’une cicatrice utérine. Les techniques d’imagerie, essentiellement l’échographie couplée au mode Doppler et l’IRM, présentent à l’heure actuelle une sensibilité élevée mais une spécificité faible. Il est préférable de programmer l’accouchement au-delà de 34+0 SA sans dépasser 38+0 SA.
Il est recommandé de ne pas utiliser une technique extirpative en cas de placenta accreta. Toute tentative de clivage forcée entre placenta et myomètre en cas de placenta accreta provoque le plus souvent une hémorragie massive lors de la délivrance mettant en jeu le pronostic vital maternel. Le diagnostic de placenta accreta est évoqué le plus souvent au moment de la délivrance, devant l’absence de plan de clivage du placenta lors d’une délivrance artificielle et/ou dans un contexte d’hémorragie de la délivrance. Il sera confirmé par l’examen anatomo- pathologique du placenta et/ou de la pièce opératoire en cas de chi- rurgie.
Les modalités de prise en charge ne sont, à ce jour, pas totalement consensuelles et opposent deux attitudes thérapeutiques :
1/ l’attitude d’extirpation : une tentative de délivrance forcée est effectuée. Cette attitude engendre dans la plupart des cas une hémorragie immédiate et massive, et le recours à l’hystérectomie d’hémostase est alors souvent la seule solution. Cette chirurgie peut être délabrante en cas de placenta percreta, pouvant nécessiter des résections digestives et/ou une cystectomie partielle secondaires à l’envahissement placentaire. L’hystérectomie d’hémostase compromet par ailleurs définitivement la fertilité ultérieure chez la patiente.
2/ l’attitude conservatrice : la prise en charge conservatrice des placenta accreta consistant à laisser le placenta en place au moment de la délivrance a été décrite par l’équipe obstétricale de la maternité Port-Royal à Paris. Outre la préservation de l’utérus, cette prise en charge présente avant tout un intérêt sur le plan de la réanimation de par la diminution très significative du nombre de culots globulaires et de plasma frais congelé transfusés.
a-En cas d’accouchement par voie basse
Il est en premier lieu important de souligner que la suspicion d’anomalie de placentation n’impose en aucun cas une césarienne d’emblée. Le diagnostic ne pouvant être affirmé en anténatal en l’état actuel des connaissances, un accouchement par voie basse peut tout à fait être tenté en l’absence de contre-indication obstétricale. La forte suspicion d’anomalie de placentation imposera alors une prudence au moment de la délivrance, avec abandon du placenta in situ en cas d’absence de plan de clivage.
b-En cas de césarienne
Après s’être assuré que la patiente a bien compris les risques d’une conservation utérine avec abandon du placenta in situ, en termes d’hémorragie secondaire et de risque infectieux, il convient de définir la stratégie en cas de confirmation du diagnostic de placenta accreta. La patiente peut opter pour une conservation utérine ou une hystérectomie d’emblée.
Le principe de la prise en charge conservatrice est de ne forcer à aucun moment le clivage placentaire. Il apparaît donc primordial d’effectuer l’hystérotomie à distance de la zone d’insertion placentaire, dont le repérage précis pourra être effectué par échographie ou IRM.
L’incision cutanée devra être adaptée : une incision classique de Pfannenstiel pourra être effectuée en cas de placenta postérieur ne remontant pas au-dessus de la zone d’incision. En cas de placenta antérieur, l’hystérotomie devra être fundique, imposant une incision cutanée médiane. Après extraction fœtale, une délivrance dite dirigée doit être tentée par injection de 5 UI d’ocytociques et traction douce sur le cordon. En cas de non délivrance immédiate, une délivrance artificielle prudente est tentée. En cas d’absence de plan de clivage, le placenta est abandonné in situ dans tous les cas.
Si la patiente a opté pour une hystérectomie conservatrice, celle- ci est réalisée d’emblée, le plus souvent subtotale, ou totale en cas de placenta accreta recouvrant. L’abandon du placenta in situ implique l’ablation d’un utérus augmenté de volume, imposant un repérage systématique des uretères.
Si la patiente a opté pour une conservation utérine, le placenta est réséqué au maximum sur sa partie décollable, et le cordon est lié au plus près de son insertion placentaire. Puis l’hystérotomie est suturée .
L’élimination complète du placenta abandonné in situ peut prendre plusieurs mois. Il n’existe pas de preuve de l’intérêt d’une antibioprophylaxie systématique bien que la plupart des auteurs en retiennent l’indication.
La surveillance clinique doit être régulière, avec mise en œuvre d’une antibiothérapie IV en cas de signes infectieux. Une infection secondaire peut imposer la réalisation d’une hystérectomie en cas d’échec des antibiotiques. Aucun traitement complémentaire n’a démontré son intérêt pour accélérer l’élimination de la masse placen- taire résiduelle.
En cas d’hémorragie secondaire, l’embolisation est une bonne solution..
En cas de diagnostic per-opératoire de placenta percreta, l’attitude conservatrice semble à privilégier dans tous les cas du fait des risques opératoires immédiats. En effet, l’envahissement est fréquemment vésical et urétéral, et les complications urologiques surviennent dans la majorité des cas, en cas de tentative d’hystérectomie. La patiente doit bien entendu être avertie en préopératoire de cette éventualité si son choix s’était porté sur l’hystérectomie.
E-Les hémorragies secondaires du post-partum
Les hémorragies secondaires du post-partum (0,5 à 2 % des accouchements) sont définies comme les hémorragies survenant entre 24 heures et 6 semaines après l’accouchement et nécessitant une action thérapeutique quelle qu’elle soit. La cause la plus fréquente est une rétention de fragments placentaires et/ou l’endométrite plus ou moins associée à une involution utérine incomplète. Les autres causes sont les faux anévrismes de l’artère utérine et les fistules artérioveineuses (anomalies vasculaires), le choriocarcinome et les coagulopathies. La prise en charge est fonction de l’étiologie et de la sévérité de l’hémorragie : antibiothérapie et utérotoniques. En cas de persistance de l’hémorragie et de rétention de fragments placentaires, une aspiration sous contrôle échographique ou une hystéroscopie opératoire est recommandé.
Retour vers: l’accouchement