Le cancer du col de l’utérus est le deuxième cancer le plus fréquent de la femme au niveau mondial. Cette fréquence est en diminution dans les pays développés en particulier grace aux méthodes de dépistage comme le frottis cervical. En France environ 3500 nouveaux cas sont diagnostiqués tous les ans.
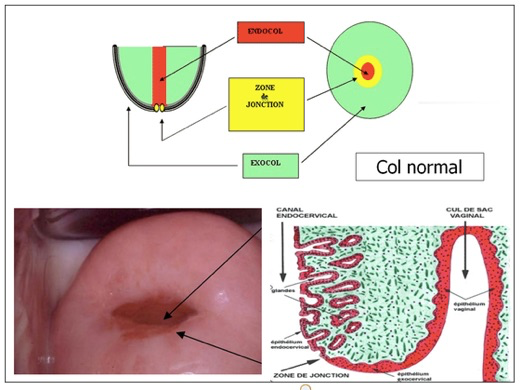
LE COL NORMAL
Le col normal comporte une partie externe visible, c’est l’exocol qui est recouvert d’un épithélium malpighien (comme la peau) et une partie interne faite d’un épithélium cylindrique de type glandulaire. La zone de transition entre ces deux parties est appelée la zone de jonction et est généralement la zone de naissance du cancer. D’où l’intérêt d’étudier en colposcopie cette zone de jonction. Elle est souvent visible en particulier en cas d’extériorisation de l’endocol (appelée ectropion), mais parfois invisible si elle est située plus ou moins haut dans le canal cervical.
Epidémiologie des cancers du col
L’âge moyen des cancers invasifs se situe autour de 45 – 55 ans. L’incidence du cancer du col de l’utérus augmente avec l’âge et atteint un plateau à partir de 55 ans.
Ce cancer est dans l’immense majorité des cas d’origine sexuellement transmissible, du à la contamination par certains types de papillomavirus ou HPV (16, 18, 30, 33, 35, 54…). Ceci explique le lien très net entre le cancer et la vie sexuelle, la précocité des premiers rapports et la multiplicité des partenaires. Cependant, seule une faible proportion des femmes infectées par HPV développera une tumeur et cette infection virale n’est pas suffisante pour entraîner le développement d’une tumeur. La plupart des femmes éliminent d’ailleurs naturellement le virus. En fait le cancer du col est d’origine multifactorielle avec l’intervention de multiples co-facteurs liés au terrain comme le déficit immunitaire, le tabac, d’autres maladies sexuellement transmissible, type herpès, etc..
Néanmoins le principal facteur de risque de survenu du cancer du col est l’absence de frottis cervico-vaginal.
Evolution des lésions histologiques
Le cancer du col se développe à partir de la jonction cylindro-malpighienne et de la zone de transformation anormale. Les carcinomes épidermoïdes représentent environ 80 à 90 % des lésions invasives. Dans 10 à 20 % des cas il s’agit d’adénocarcinomes développés à partir de la muqueuse cylindrique endocervicale.
1-Carcinome épidermoïde
Le cancer apparaît à la suite d’une évolution progressive d’anomalies dont les stades sont les suivants:
a-Néoplasies cervicales intraépithéliales (CIN)
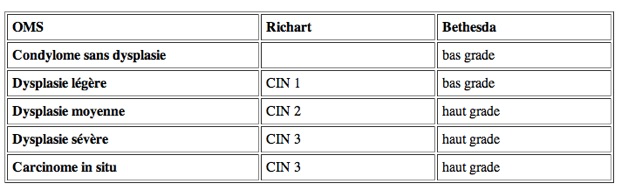
C’est le premier stade. Les CIN se développent sur la zone de transformation du col utérin. La zone de transformation est située entre la jonction cylindro-malpighienne originelle et la nouvelle jonction cylindro-malpighienne. Les CIN sont caractérisées par une désorganisation architecturale et une prolifération de cellules atypiques plus ou moins différenciées. La sévérité des lésions est évaluée par la hauteur des anomalies cellulaires dans l’épithélium. Ainsi l’extension au tiers inférieur de l’épithélium correspond une CIN 1, l’extension au deux tiers à une CIN 2 et l’extension à toute la hauteur de l’épithélium à une CIN 3.
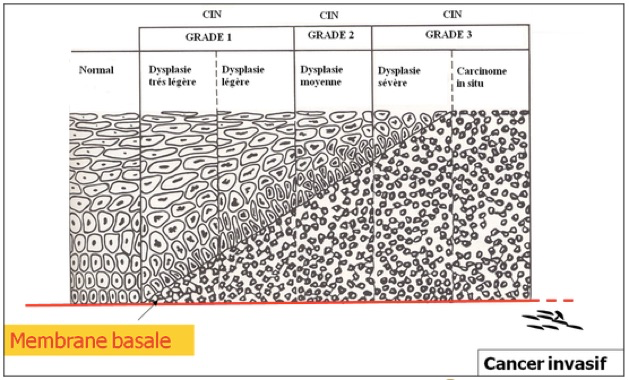
La classification actuelle de Bethesda distingue seulement deux types d’anomalies: soit anomalies cellulaires de bas grade dites LHIL, soit anomalies de haut grade dites HSIL (qui regroupe les CIN 2 et 3).
Les condylomes sont des lésions virales dues aux papillomavirus visibles au niveau vulvaire mais seulement visibles par colposcopie au niveau du col utérin. Ils peuvent régresser spontanément ou évoluer vers des lésions dysplasiquesI.
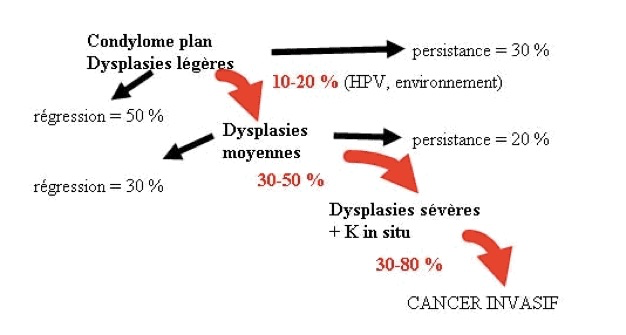
Il faut savoir que dans certains cas toutes ces lésion peuvent régresser spontanément et ne pas évoluer vers le cancer,. C’est souvent le cas des lésions de bas grade et il faut s’en souvenir pour la conduite à tenir. Les chances de régression sont plus importantes dans les lésions de bas grade (CIN 1) qui régressent dans plus de la moitié des cas. Les risques de progression et d’évolution vers l’invasion augmentent avec la sévérité des anomalies. On estime que 1 % des CIN1 et 10 à 15 % des CIN 2 vont progresser vers un cancer invasif en l’absence de traitement. La durée de la progression est très variable. Pour les CIN de haut grade (CIN 2 – 3) la durée d’évolution vers l’invasion peut aller de 2 à 20 ans. L’histoire naturelle permet de mieux comprendre leur traitement : plus la dysplasie est sévère plus elle risque de progresser vers un stade pathologique plus important:
Apport de la protéine P16
La protéine P16 est un biomarqueur de la dysplasie cervico-utérine. Elle est normalement exprimée au cours de la division cellulaire. Chargée de réguler le cycle, elle garantit le bon déroulement de la mitose. Plusieurs cancers sont liés à une perturbation de de l’ADN de cette protéine. Dans le cadre des lésions de haut grade viro-induites, une accumulation importante de la P16 est observée au niveau nucléaire et cytoplasmique. Elle permet de mieux distinguer une simple métaplasie d’une lésion de haut grade. Elle est également utile pour apprécier les berges d’exérèse d’une conisation, de distinguer un condylome d’un CIN1, d’aider au diagnostic des lésions glandulaires endocervicales.
b-Carcinome in-situ: les anomalies cytologiques intéresse toute la hauteur de l’épithélium, la mem basale reste intacte.
c-Carcinome micro-invasif
Dans le carcinome micro-invasif il existe une rupture de la membrane basale et une invasion du stroma par les cellules malignes. Le potentiel métastatique de la lésion est encore limité. Il augmente avec l’étendue de la lésion, la profondeur de l’invasion et l’envahissement des espaces vasculaires et lymphatiques. Dans le cancer micro-invasif IA1, avec une profondeur d’invasion inférieure à 3 mm, le risque d’envahissement ganglionnaire est pratiquement nul. Dans le carcinome micro-invasif IA2, avec une extension comprise entre 3 et 5 mm de profondeur, le risque d’atteinte ganglionnaire est de l’ordre de 1 à 8 %. Ensuite on parle de carcinome invasif.
d-Carcinome invasif
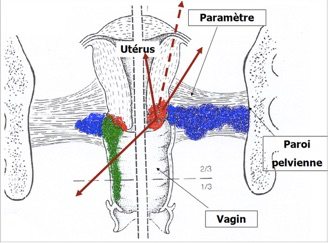
L’extension se fait ensuite de proche en proche avec un envahissement des structures et des organes voisins. La tumeur cervicale dépasse le col et envahit de proche en proche le paramètre proximal, puis le paramètre distal jusqu’à la paroi pelvienne. L’extension au vagin se fait habituellement par une propagation directe. L’extension à l’endomètre est possible à partir d’un adénocarcinome endocervical. L’extension aux organes de voisinage se fait surtout vers la vessie en avant et plus tardivement vers le rectum en arrière. Parallèlement à l’extension locale se produit un envahissement des ganglions et une embolisation des vaisseaux des paramètres. Les métastases lymphatiques sont précoces et constituent la voie d’extension la plus importante du cancer du col. L’envahissement lymphatique se fait successivement dans les ganglions du paramètre, les ganglions obturateurs, les ganglions de la chaîne iliaque externe, les ganglions iliaques primitifs et enfin les ganglions lombo-aortiques.
Les métastases ovariennes sont exceptionnelles. Les métastases à distance sont rares. Dans les formes à risque elles se font par voie sanguine. Les plus fréquentes sont hépatiques et pulmonaires, plus rarement osseuses ou cérébrales.
2-Adénocarcinome
Environ 15 à 20 % des cancers invasifs sont des adénocarcinomes ou des carcinomes adénosquameux. Le papillomavirus humain est également impliqué dans la transformation maligne de ces lésions.
Ils sont précédés d’atypies glandulaires qui constituent les lésions pré-invasives. Contrairement aux lésions malpighiennes il n’est pas possible de distinguer les différents stades des atypies glandulaires, mais la notion d’adénocarcinome in situ est généralement acceptée. Il présente des degrés de différenciation cellulaire et glandulaire divisés en trois grades (1, 2 ou 3). Les adénocarcinomes de type endométrioïde à cellules claires ou de type séreux sont plus rares.
Signes et diagnostic
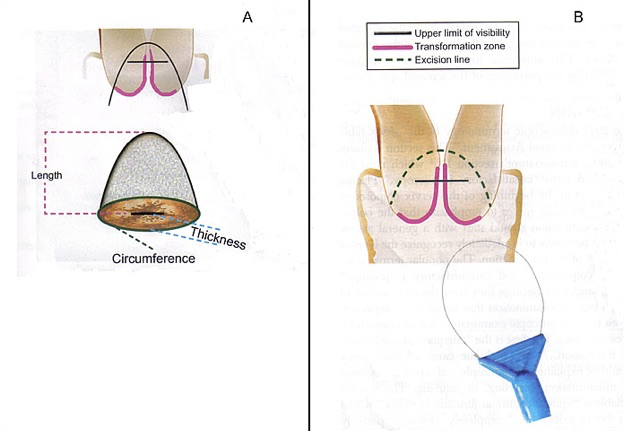
Lorsqu’il s’agit de lésions préinvasives il n’y a aucun symptome et l’examen par le spéculum à l’oeil nu parait normal. Ces lésions sont dépistées par le frottis cervical. Le diagnostic repose ensuite sur la colposcopie avec des biopsies des lésions suspectes. Lorsque la colposcopie n’est pas satisfaisante (c.à.d. jonction cylindro-malpighienne ou limites endocervicales supérieures de la lésion non visibles) il est nécessaire d’avoir recours à une conisation diagnostique:
Lorsque le cancer devient invasif, les signes cliniques les plus habituels sont les métrorragies provoquées par les rapports sexuels et les leucorrhées purulentes, malodorantes, parfois striées de sang. Les métrorragies peuvent également se présenter sous la forme de saignements intermenstruels anormaux.
D’autres symptômes, comme les douleurs pelviennes, les troubles urinaires, les troubles rectaux ou un oedème ou une thrombose des membres inférieurs, ne se voient habituellement que dans les formes avancées.
Une minorité de patientes reste asymptomatique, même dans certaines formes avancées.
L’examen au spéculum permet de visualiser le col. Le col est généralement friable et hémorragique. Le cancer peut se présenter sous la forme d’une large ulcération à bords irréguliers saignant au contact, sous une forme végétante exubérante ou sous une forme infiltrante avec une induration déformant le col. Il est inutile, à ce stade, de faire un frottis du col qui du fait de l’hémorragie et de la nécrose risque d’être faussement négatif. Le diagnostic est affirmé par la biopsie. Dans certains cas le col garde un aspect normal, notamment en cas de carcinome micro-invasif ou dans certaines lésions endocervicales.
Au toucher vaginal on note l’induration et ou la déformation. L’examen recto-vaginal est important pour évaluer l’extension du cancer. L’invasion des paramètres et des ligaments utéro-sacrés sont mieux appréciées par le toucher rectal.
Le bilan d’extension
Le bilan d’extension est basé sur l’examen clinique et des investigations complémentaires. Il permet de classer le cancer du col selon la classification de la Fédération Internationale de Gynécologie-Obstétrique (FIGO). Cette classification a une certaine valeur pronostique et précise les modalités thérapeutiques.

L’examen au spéculum et le toucher vaginal précise la taille de la tumeur, et le volume de l’utérus et l’extension éventuelle au vagin.
Le toucher vaginal et le toucher rectal quelque fois réalisés sous anesthésie générale permettent d’apprécier la mobilité utérine, l’extension aux paramètres et aux ligaments utéro-sacrés.
L’échographie pelvienne donne des renseignements sur le volume tumoral cervical et une éventuelle extension aux paramètres ; elle recherche une pathologie utérine ou annexielle associée.
L’IRM permet une étude plus précise des dimensions et de l’extension de la tumeur et d’un éventuel envahissement aux organes de voisinage.
L’urographie intraveineuse permet de détecter les anomalies du système urétéro-pyélocaliciel, les anomalies de forme ou de trajet de l’uretère et les sténoses urétérales dans les formes avancées.
La cystoscopie et la rectoscopie précisent l’état de la muqueuse vésicale et de la muqueuse rectale.
La radiographie pulmonaire et l’écho abdominale complète le bilan d’extension viscéral à distance.
Le bilan sanguin peut révéler des anomalies dans les stades avancés : une anémie, une insuffisance rénale due à une obstruction urétérale et des altérations du bilan hépatique par suite de métastases. Le dosage des marqueurs tumoraux n’est pas indispensable pour le diagnostic ou pour l’évaluation de l’extension ; il est surtout important pour la surveillance post-thérapeutique. Le plus intéressant est celui du SCC (squamous cell carcinoma antigen).
La TEP-TDM (Tomographie par émission de positons couplée à la tomodensitométrie est le meilleur examen pour rechercher un envahissement des chaines ganglionnaires pelviennes et/ou lombo-aortiques et pour mettre en évidence des métastases à distance. Sa résolution spaciale est cependant limitée et elle visualise mal les lésions tumorales <5mm. Cet examen n’est donc pas recommandé pour réaliser le bilan d’extension des stades < IB2.
La classification des cancers du col
On utilise la classification internationale FIGO. Cette classification est basée sur l’extension loco-régionale et ne tient pas compte de l’extension ganglionnaire qui est évaluée en général en post opératoire. Cette classification commence au stade de cancer invasif.
Les traitements des cancers du col
Les CIN de bas grade (CIN 1)sont des lésions qui peuvent régresser spontanément dans plus de 50 % des cas. Selon les cas elles peuvent être surveillées pendant un à deux ans ou traitées. Le traitement est indiqué dans les CIN de bas grade persistantes, en cas de discordance entre les éléments diagnostiques (frottis, colposcopie et biopsie) ou en cas de jonction cylindro-malpighienne non visible à la colposcopie.
Les CIN de haut grade (CIN 2 – 3) sont considérées comme des précurseurs cancéreux vrais qui doivent toujours être traités. Le choix de la méthode thérapeutique varie en fonction de nombreux facteurs. Les traitements par destruction (cryothérapie ou mieux vaporisation au laser CO 2) peuvent être proposés chez la femme jeune, en cas de lésion de petite taille et entièrement visible à la colposcopie. Leur inconvénient majeur est l’absence de pièce opératoire, donc l’absence d’examen histologique pour confirmer la biopsie. Il est préférable de recourir à des méthodes d’exérèse (conisation au bistouri, conisation au laser ou résection à l’anse diathermique). Ces méthodes ont l’avantage de permettre un examen de la pièce d’exérèse qui va donner un diagnostic histologique précis et établir si l’exérèse est complète ou non.
Les taux de succès thérapeutique se situent entre 90 et 95 %.
Les complications dépendent de la méthode utilisée et de l’importance de l’exérèse. Elles sont plus fréquentes et plus sévères après une conisation au bistouri. L’intérêt de la résection à l’anse diathermique tient à sa facilité d’utilisation, à la possibilité d’adapter l’exérèse à l’étendue de la lésion et à la rareté des complications post-opératoires.
Chez la femme enceinte le traitement des CIN de haut grade (après avoir éliminé avec certitude la possibilité d’une invasion) peut être différé et réalisé après l’accouchement.
En cas d’adénocarcinome in situ une conisation peut être suffisante si l’exérèse est complète et si la patiente désire avoir d’autres grossesses, mais en raison des risques de récidive (et lorsqu’une surveillance régulière est impossible) une hystérectomie est recommandée.
Au stade 1A1
Le diagnostic a été fait sur une pièce de conisation. L’attitude thérapeutique peut être :
-une surveillance simple si les marges de la conisation sont in sano et en l’absence d’embols lymphatiques et si la patiente préfère un traitement conservateur de l’utérus ;
-une hystérectomie totale simple si la conisation est non in sano et/ou si la patiente ne souhaite pas un traitement conservateur de l’utérus ;
-si des embols lymphatiques sont présents sur la pièce de conisation, le traitement est identique à celui d’un cancer de stade IA2 avec présence d’embols.
Au stade 1A2
Le diagnostic a été fait sur une pièce de conisation. L’attitude
thérapeutique peut être :
-une surveillance simple si les marges de la conisation sont in sano et en l’absence d’embols lymphatiques et si la patiente préfère un traitement conservateur de l’utérus ;
-une trachélectomie (amputation du col utérin) afin de préserver la fertilité ou une hystérectomie simple pour les autres patientes si la conisation est non in sano ;
-en présence d’embols lymphatiques sur la pièce de conisation, la résection du paramètre peut être indiquée dans certaines situations particulières. Elle se fait par trachélectomie élargie (colpo-cervicectomie élargie) ou par hystérectomie élargie.
Une lymphadénectomie pelvienne complémentaire, réaliséehabituellement par cœlioscopie, est indiquée dans tous les stades IA2. Si la patiente présente un envahissement ganglionnaire, une chimioradiothérapie concomitante complémentaire est administrée.
Au Stade IB1 et IIa1
*Référentiel Rhone-Alpes 2010
On commence par une stadification première qui consiste en une lymphadénectomie pelvienne avec examen extemporané.
Si l’analyse des ganglions pelviens est positive, on poursuit le curage en iliaque primitif et lombo-aortique. Ensuite sera discut: radiochimiothérapie concomitante et curiethérapie utérovaginale (radiothérapie externe et chimiothérapie à base de sels de platine), puis réévaluation clinique et avec IRM 4 à 6 semaines après. En fonction de la réponse, on pourra proposer une colpohystérectomie plus ou moins élargie type Piver I ou II.
Si l’analyse des ganglions pelviens est négative, on discutera secondairement en RCP:
-soit une Curiethérapie préopératoire si la tumeur mesure entre 2 et 4cm,
-soit une chirurgie première type Piver II.
En cas de tumeur <2cm et si l’âge est compatible avec un désir de grossesse, peut se discuter une trachélectomie élargie.
Par la suite, une simple surveillance est réalisée et s’il existe au moins un facteur de risque une radiochimiothérapie pelvienne sera proposée. Ces facteurs de risque sont: tumeur>4cm, stade pT2b, N+, embols nombreux.
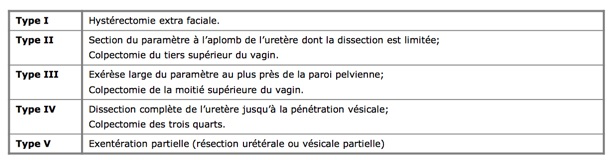
On trouvera pour mémoire ci-après la classification des différents types d’hystérectomies en fonction deleur élargissement par rapport à l’utérus
Aux stades IB2 et IVA
Le traitement de référence est la radiochimiothérapie concomitante. La chirurgie première d’exérèse de la tumeur n’est pas indiquée.
Il faut en premier évaluer un éventuel envahissement lymphatique au niveau des ganglions lombo-aortiques ce qui aura pour effet de modifier la largeur des champs d’rradiation pratiqués. Cette évaluation commence par un TEP-scan (ou PET-scan) au 18-FDG. Si la TEP ne montre pas d’extension lombo-aortique, il faut confirmer par un curage lombo-aortique premier (par coelioscopie ou laparotomie). Si le curage est négatif on met en route une radiochimiothérapie concommitante (à base de sels de platine) et une curiethérapie utéro-vaginale. Une chirurgie de cloture sera discutée en RCP en fonction de la réponse.
Si l’envahissment lombo-aortique est confirmé soit par la TEP soit par le curage on peut choisir, après discussion en RCP, soit deux cures de chimiothérapie (Cisplatine, Topocétan ou Carboplatine, Paclixatel) soit radiochimiothérapie avec grand champ d’irradiation, et cela sans indication de chirurgie de clôture.
L’irradiation est pelvienne +/- lombo-aortique et s’étale sur 5 semaines. Les volumes d’irradiation sont basés sur les examens d’imagerie (IRM, TEP-TDM au 18F-FDG) et/ou sur les résultats d’e la lymphadénectomie lombo-aortique première. La curiethérapie utérovaginale est réalisée 8 à 10 jours après la fin de la radiothérapie externe. Ce délai doit être respecté car tout retard a un impact sur le contrôle local.
La chimiothérapie la plus souvent employée est à base de sels de platine (5-FU Platine), administrés de manière hebdomadaire pendant la radiothérapie, soit 5 à 6 cures. Elle est peu ou pas neutropéniante et généralement non alopéciante.
Si l’état général empêche un traitement par radiochimiothérapie, la patiente peut être traitée par une radiothérapie seule.
Au Stade IV B (métastases es à distance)
Ces situations sont rares et discutées au cas par cas en fonction de l’extension de la maladie et de l’état général de la patiente. La thérapeutique repose sur une chimiothérapie et/ou une radiothérapie. Le recours à la chirurgie est exceptionnel chez ces patientes.
En cas de récidive locorégionale ou métastatiqueLes récidives surviennent le plus souvent dans les 2 ans, mais 10 % surviennent après un délai de 5 ans. Pour la plupart des patientes, une chimiothérapie palliative est l’option préférentielle. Une chirurgie pelvienne (souvent une exentération pelvienne) et une radiothérapie sont des options dans certains cas.
La surveillance après traitement
La surveillance est indispensable dans toutes les CIN traitées. Elle consiste, après un premier contrôle comprenant une colposcopie et un frottis 3 à 6 mois après le traitement initial, en une surveillance cytologique annuelle.
Dans les cancers invasifs traités
La surveillance a pour objectif de dépister précocement les récidives loco-régionales, les métastases et les complications du traitement. Plus de 80 % des récidives surviennent dans les 3 premières années.
Les patientes seront revues tous les trois mois au cours de la première année, tous les six mois pendant les deux années suivantes, puis tous les ans. La surveillance comporte un examen clinique avec le prélèvement d’un frottis vaginal. Une échographie abdominale voire une UIV sont proposées à titre systématique 3 à 6 mois après l’intervention. L’intérêt de la radiographie du thorax et du dosage des marqueurs tumoraux, tous les ans reste discuté. Des examens d’imageries (urographie intraveineuse, scanner abdomino-pelvien et/ou IRM) sont proposés en cas de signe d’appel.