La puberté correspond à l’activation de la fonction hypothalamo-hypophyso- gonadique, aboutissant au développement complet des caractères sexuels, à l’acquisition de la taille définitive, de la fonction de reproduction et de la fertilité. Les différents stades du développement pubertaire sont définis selon la classification de Tanner portant sur les caractères sexuels secondaires:
Chez la fille, la première manifestation pubertaire est le développement des glandes mammaires qui commence en moyenne à partir de 10,5/11 ans. Vien- nent ensuite le développement de la pilosité pubienne et axillaire, les modifi- cations de la vulve et enfin les premières règles (ménarche) qui apparaissent en moyenne autour de 13 ans, entre 2 et 2,5 ans après l’apparition des pre- miers signes pubertaires. Leur date de survenue est considérée comme physio- logique entre 10 et 15,5 ans. La puberté chez la fille se situe pour un âge osseux de 11 ans (10 à 12 ans) correspondant à l’apparition du sésamoïde du pouce.

Chez le garçon, le premier signe de puberté est l’augmentation du volume testiculaire qui se produit en moyenne vers l’âge de 12-13 ans. Les autres signes de maturation pubertaires sont le développement de la pilosité pubienne et axillaire, l’augmentation de la taille de la verge. La puberté chez le garçon se situe pour un âge osseux de 13 ans correspondant à l’apparition du sésamoïde du pouce (voir le chapitre: impubérisme).
En Europe, l’âge des premières règles est en moyenne à 12 ans en Italie, 12,6 ans en France et 13,5 ans en Allemagne. Concernant les garçons, différentes études américaines et européennes s’accordent sur un âge moyen de 11,6 ans pour le stade G2.
La puberté commence lors d’une augmentation des secrétions de gonadotrophines FSH et LH.
Dans le cas où l’hypothalamus est déconnecté du système nerveux central (soit à cause de tumeurs, soit par des lésions expérimentales de l’hypothalamus chez l’animal), on observe une puberté précoce. Ceci permet de conclure que le sytème nerveux central doit exercer un effet inhibiteur sur les neurones à GnRH de l’hypothalamus.
L’hypothèse du contrôle de l’entrée en puberté par un « somatomètre » est basée sur le fait que la puberté dépend du poids corporel et de la masse adipeuse. Le somatomètre informerait en permanence le système nerveux central de l’état de de développement somatique de l’individu.
Plusieurs molécules peuvent rendre compte de cet état, et jouer le rôle de somatomètre: il s’agit de deux molécules impliquées dans la croissance, l’hormone de croissance et le facteur IGF-1, et d’une hormone sécrétée par le tissu adipeux, la leptine qui semble jouer un rôle essentiel dans le déclenchement de la puberté. Sa sécrétion s’élève au début de la puberté tandis que celle de l’hormone de croissance continue tout au long de la croissance, jusqu’après la puberté.
Deux autres facteurs contrôlent également le démarrage de la puberté. Il s’agit du glutamate, neuromédiateur excitateur, et du GABA, neuromédiateur inhibiteur. Ces deux molécules semble être directement impliquées dans l’initialisation de la puberté car le début de la puberté (chez le macaque) s’accompagne d’une augmentataion du taux de glutamate et une baisse du taux de GABA dans l’hypothalamus médian, en même temps que s’élève le contenu en GnRH.
Les neurones à GnRH sont contrôlés par différentes afférences nerveuses excitatrices ou inhibitrices, directes comme les neurones à GABA ou à glutamate ou indirectes comme celles qui mettent en jeu la leptine. La compréhension du mécanisme d’action de la leptine nécessite la connaissance de la localisation de ses récepteurs. Ils ont été identifiés sur les neurones à POMC et NP. La pro-opio-mélanocortine (POMC) est un précurseur de diverses molécules (endorphine, ACTH…) qui jouent, avec le neuropeptide Y (NPY), un rôle fondamental dans la régulation de l’appétit et de la fonction gonadotrope. L’élévation de leur taux entraîne une augmentation du stockage des lipides dans les adipocytes et une élévation de la leptine. Quand la masse adipeuse est normale, un taux élevé de leptine entraîne une inhibition de la synthèse de NPY et une activation des neurones à POMC. Il y a stimulation des neurones à GnRH.
Si la masse adipeuse est inadéquate et le taux de leptine faible, le taux de NPY s’élève et inhibe la sécrétion de GnRH. Ceci explique les retards pubertaires par malnutrition ou encore les aménorrhées par excès d’exercice physique.
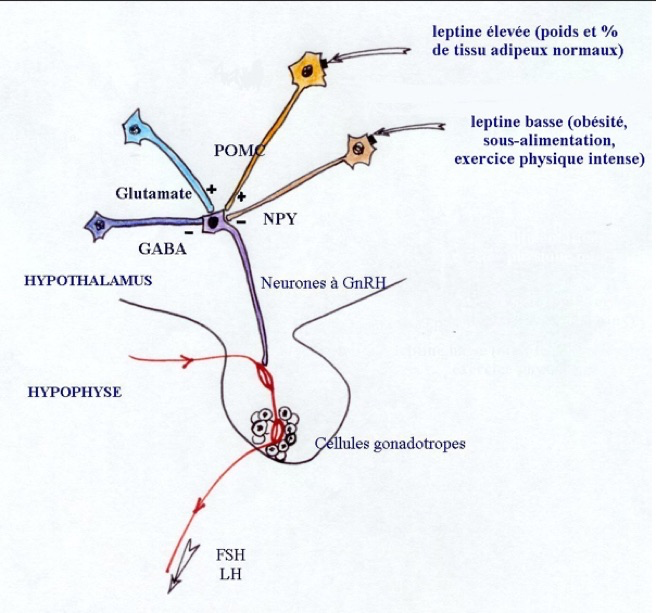
Les neurones à GnRH (violet) reçoivent des influences directes des neurones à GABA (en bleu) ou à glutamate (en ciel) et indirecte, de la leptine, par l’intermédiaire des neurones à POMC (en jaune) ou à NPY (en marron), sur lesquels elle se fixe par ses récepteurs (carrés noirs).
D’après Cunningham et al, Biol. Reprod., 1999, 60, 216-222; Magni, 18.
En résumé, le processus central du démarrage pubertaire est dominé par l’activation des neurones à GnRH (noyau arqué de l’hypothalamus médio-basal) dont la sécrétion est pulsatile. L’activation du générateur de pulses est réprimé jusqu’à la puberté par des facteurs tels que l’insuffisance de développement somatique. Ces facteurs exercent leur influence sur ces neurones par l’intermédiare d’hormone comme la leptine, ou de neuromédiateurs comme le NPY, le glutamate ou le GABA. Mais les mécanismes intimes du déclenchement de la puberté ne sont pas encore totalement connus.