On parle de rupture prématurée des membranes pour toute rupture survenantavant le début du travail. Cela concerne 5 à 10 % des grossesses. Dans les conditions physiologiques, les membranes de l’œuf (chorion et amnios) se rompent spontanément au cours du travail à dilatation complète : c’est la rupture tempestive.
La rupture est dite précoce lorsqu’elle survient au cours du travail avant la dilatation complète. Elle est dite prématurée lorsqu’elle se rompt avant le début du travail. L’œuf étant ouvert, il est d’autant plus exposé à l’infection que le travail tarde à se mettre en route.
La notion de délai entre la rupture et le début de travail est donc très importante, et beaucoup d’auteurs n’appellent rupture prématurée des membranes que les ruptures survenant plusieurs heures avant le début du travail, cette durée pouvant varier de 2 à 24 heures selon les définitions adoptées. Au-delà de 24 heures, on parle volontiers de rupture prolongée.
La conduite à tenir diffère donc selon l’âge auquel survient la rupture, et il faut distinguer les ruptures prématurées à terme (>/= 37 SA) et celles avant terme (</= 36 SA) . Ce sont ces dernières qui posent, surtout avant 35 semaines, les véritables problèmes de pré- maturité et d’infection. Avant 25 SA, elles exposent en plus à une hypoplasie pulmonaire du fait de la diminution du liquide amniotique dans l’arbre trachéo-bronchique.
I-Rupture prématurée des membranes avant terme
A-Les causes
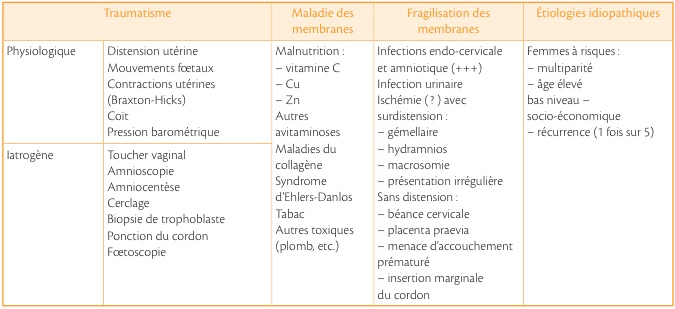
Deux phénomènes doivent nécessairement s’associer pour provoquer la rupture : d’une part, une anomalie localisée de la structure membranaire; d’autre part, une augmentation du tonus utérin qui fait céder les membranes à un endroit où elles présentent une fragilisation.
Les différentes causes sont rapportées dans le tableau suivant mais le mécanisme précis est encore inconnu. La composante élastique repose sur la trame du réseau de collagène, qui peut être altérée par l’infection. Mais l’infection ne saurait être reconnue comme facteur causal unique .
B- Les conséquences de la rupture prématurée des membranes
Le pronostic pour l’enfant dépend
– de l’âge gestationnel à la rupture ;
– de l’existence ou non d’un oligo-anamnios (plus grande citerne < 2 cm) ;
– de l’existence ou non d’une chorio-amniotite.
1-La mise en route du travail
Après rupture prématurée à terme avant travail, la moitié des patientes accouchent dans les 5 heures et 95 % dans les 28 heures, même avec des col peu favorables au début. Cel vient confirmer le rôle essentiel de la rupture artificiel dans le déclenchement du travail à terme mais cela est une autre histoire.
Après rupture prématurée des membranes avant terme, la durée moyenne de latence avant les naissances varie de 10 à 21 jours. 57% des femmes auront accouché dans la semaine et 22 % dans le mois qui suit la rupture. Durant la période de surveillance, 3 à 13 % des patientes voient la perte de liquide s’arrêter et le volume du liquide revenir à la normale.
2-L’infection
Elle est souvent la cause de la rupture prématurée des membranes, et parfois la conséquence. Il est classique de dire que l’infection précède la rupture et nous avons vu par quels mécanismes. Cela explique que le liquide amniotique puisse être très rapidement contaminé par des germes d’origine vaginale (25 % de culture positive à 6 heures de rupture, 50 % après 20 heures).
a-L’infection foetale
Elle se propage par voie funiculaire, transcutanée et transmuqueuse, pénétrant dans le fœtus par le tube digestif, les voies respiratoires, les fosses nasales et le canal auriculaire. La bactériologie positive du liquide gastrique et du sang du nouveau-né augmente avec le temps de latence de la rupture. Cette agression microbienne peut être responsable de pneumonie, d’otite, de méningite, d’infection cutanée et de septicémie pour le fœtus. Le but des examens est de rechercher une infection subclinique, mais on ignore si elle a un meilleur pronostic que la chorioamniotite avérée et si, à l’inverse, elle justifie un déclenchement ou au moins une antibiothérapie orientée. L’orientation des recherches est triple : biologique, bacté- riologique et échographique.
b-L’infection maternelle
Elle est consécutive à l’infection amniotique qui provoque une atteinte de la caduque et une endométrite. Ce foyer septique est un point de départ possible de sep- ticémie ; après 24 heures de rupture, 20 % des mères devien- nent fébriles.
3-La prématurité
La prématurité est la complication majeure de la rupture prématurée des membranes, car la rupture induit souvent le travail. Ce sont les plus jeunes grossesses qui attendent le plus. Le fait que la rupture accélère la maturité pulmonaire fœtale et qu’il y ait moins de membranes hyalines si le délai entre rupture et début du travail dépasse 24 heures est discuté.
4-La procidence du cordon
La fréquence de l’association procidence du cordon-rupture prématurée des membranes varie de 0,3 à 1,7 % selon les auteurs. On doit donc toujours avoir cette complication présente à l’esprit de façon à en faire le diagnostic précocement et à mettre en route le traitement.
5-La présentation du siège
La présentation du siège n’est pas la cause de la rupture, mais du fait du jeune âge de ces grossesses certains foetus sont «surpris» alors qu’ils sont encore en position de siège. Elle est donc fréquente du fait de la prématurité. La rupture prématurée des membranes assombrit légèrement le pronostic.
En deçà de 26 SA, l’accouchement par voie basse sera privilégié car le pronostic est principalement lié à la prématurité. Entre 26 et 32 SA, une césarienne est préférable afin d’éviter la rétention de tête dernière. Au-delà de 32 SA ou d’un poids fœtal supérieur à 1 500 g, l’attitude sera la même que pour un siège à terme et sera une question d’école..
6-L’oligoamnios prolongé
On parle d’oligo-amnios lorque la plus grande citerne est<2cm. Le problème se pose pour des ruptures très précoces. L’existence d’un oligoamnios est de mauvais pronostic en cas de rupture prématurée des membranes de moins de 28 SA. Entre 20et 25 semaines l’existence d’un oligoamnios est associée significativement à une augmentation de la mortalité néonatale de l’ordre de 85%. les autres complications sont: déformations des extrémités, surtout des pieds, de déformations articulaires, ’arthrogrypose, craniosténose, voire un véritable syndrome de Potter. Le risque majeur est cependant l’insuffisance du développement du thorax avec hypoplasie pulmonaire, d’autant plus grave que la rupture est précoce (avant 26 semaines), prolongée (plus de 5 semaines) et l’oligoamnios très sévère, sans être pour autant une complication obligatoire.
C-Le diagnostic de rupture
Dans le cas particulier des RPM avant 24 SA, une interruption médicale de grossesse ne devrait pas être envisagée en l’absence d’anamnios ou de chorio-amniotite. Dans tous les cas, la rencontre des pédiatres avec les parents en période anténatale doit permettre de les intégrer dans les décisions.
Dans 90 % des cas, le diagnostic est évident et repose uniquement sur l’interrogatoire et l’examen au spéculum. En cas de doute, on peut faire appel à différents test:
-le test à la nitrazine recherche une élévation du pH endocervical ou vaginal par simple réaction colorimétrique. Le pH endocervical est normalement acide et devient alcalin en présence de liquide amniotique. Ce test a une excellente sensibilité pour la majorité des auteurs; comprise entre 90 et 97,5 %. Un test négatif élimine pratiquement la possibilité d’une RPM. Enfin, ce test a un taux de faux positifs élevé (de l’ordre de 20 % pour la majorité des études) et entraîne de ce fait des hospitalisations abusives pour RPM . En effet, la réaction colorimétrique peut apparaître en présence d’eau, de mucus cervical, de sang et de sperme.
-Le test à la Diamine oxydase. La diamine oxydase est une enzyme secrétée par le placenta ; elle est présente dans le liquide amniotique et le sang maternel dès 20 SA et ce jusqu’à terme. Le test consiste à appliquer un papier buvard dans le vagin sans aucune désinfection vulvo-vaginale préalable et en évitant tout contact avec le col utérin (saignements entraînant des faux positifs). Néanmoins, son utilisation en routine fait appel à la disponibilité d’un laboratoire pour effectuer le dosage radio isotopique ce qui retarde considérablement le diagnostic. Enfin, si ce test est très spécifique (faux positifs compris entre 0 et 5 %), sa sensibilité est moindre avec un taux de faux négatifs compris entre 10 et 17 %. Le risque, dans ce cas, étant de méconnaître une véritable rupture des membranes. Ce test n’est plus tout à fait d’actualité.
-La fibronectine. La fibronectine fœtale est une protéine de la matrice extracellulaire située au niveau des points d’ancrage du placenta et des membranes. Elle ne doit pas être retrouvée au niveau des secrétions cervico-vaginales entre 25 et 37 SA . Il s’agit d’un test plutôt utilisé pour évaluer le risque d’accouchement prématuré.
-L’IGFBP-1 (Insulin Growth Factor Binding Protein de type 1) est présente à des taux élevés dans le liquide amniotique pendant toute la gestation (10-350 mg/l). Par ailleurs, sa concentration intra-amniotique est de 100 à 1 000 fois plus élevée que dans le sérum maternel (0,063 à 0,6 mg/l). Enfin, elle n’est détectée ni dans les urines ni dans le sperme. Ainsi, ce marqueur présente une excellente spécificité avec une VPP supérieure à 95 % dans l’ensemble des études, un test positif confirmant une RPM dans la plupart des cas. Sa sensibilité est également bonne, comprise entre 95 et 100 % lorsque la valeur seuil choisie est de 25 µg/l au moins.
-L’échographie permet d’apprécier la quantité de liquide amniotique res- tant, tout en sachant qu’il existe d’autres causes d’oligoamnios que la rupture prématurée des membranes. Elle a l’avantage de l’innocuité mais un examen normal n’élimine pas la rupture.
-Le toucher vaginal augmente le risque infectieux et réduit l’intervalle rupture-accouchement. Il devrait donc être évité dans tous les cas où la patiente ne présente pas de signes de début de travail.
D-Prise en charge à l’admission
Les investigations initiales comportent la recherche de signes cliniques de chorio-amniotite, un examen cardio-tocographique foetal, un prélèvement vaginal à visée bactériologique, un prélèvement sanguin maternel pour numération formule sanguine (NFS), dosage de la protéine C réactive (CRP) et bilan préopératoire, une échographie en cas de doute sur la présentation.
Il n’existe pas de marqueur idéal de l’infection, y compris par amniocentèse (NP3). Celle-ci n’a donc aucune indication en dehors d’un protocole de recherche.
Il n’existe pas de données pour recommander la pratique de l’amnio-infusion trans-abdominale ou trans-cervicale dans le but de réduire le risque d’infection ou d’hypoplasie pulmonaire. L’utilisation de colle ou de « blood-patch » ne doit pas être réalisée en dehors d’un protocole de recherche. En cas de RPM chez une patiente cerclée, le peu de données est en faveur d’un décerclage (le fil de cerclage peut être envoyé pour examen bactériologique).
Avant 34 SA, le traitement initial doit comporter :
une antibiothérapie de courte durée, systématique et immédiate, qui diminue la morbidité infectieuse maternelle et néonatale, et prolonge la grossesse;
– une corticothérapie systématique et immédiate à partir de la viabilité;
– une tocolyse, en faveur de laquelle il existe des arguments, en cas d’activité utérine jusqu’à 32 SA, voire pour certains jusqu’à 34 SA, qui prolonge la grossesse le temps de permettre l’efficacité de la corticothérapie;
– un éventuel transfert in utero, selon l’âge gestationnel, si l’accouchement n’est pas imminent.
Entre 34 et 36 SA, deux attitudes sont possibles sans que l’on puisse trancher en faveur de l’une ou de l’autre: déclenchement systématique ou bien expectative avec antibiothérapie prophylactique.
Au delà de la période initiale, l’hospitalisation initiale des patientes présentant une RPM avant 37 SA est justifiée par le fait que plus de la moitié des patientes vont accoucher dans la semaine qui suit la rupture. Pour une petite proportion de patientes stables et sans critères de mauvais pronostic, une hospitalisation à domicile pourrait être proposée dans le but de réduire les coûts de prise en charge. Il n’existe pas de données justifiant le repos strict au lit.
Les recommandations concernant la surveillance s’appuient sur les pratiques plutôt que sur des études cliniques. Il est proposé de surveiller :
– quotidiennement : la température et le pouls maternels, les mouvements actifs foetaux et le rythme cardiaque foetal ;
– une à deux fois par semaine: la NFS, la CRP, l’examen bactériologique d’un nouveau prélèvement vaginal.
Autour de la naissance, le risque d’infection de l’espace péridural semble bien inférieur aux risques que fait courir l’absence d’analgésie péridurale chez ces femmes à haut risque de césarienne ou de manoeuvres obstétricales. Il n’y a aucune donnée pour contre-indiquer la réalisation d’une analgésie péridurale sur la notion d’une RPM.
Si la patiente accouche avant 37 SA, l’administration d’antibiotiques pendant le travail réduit le risque d’infection maternelle et foetale.
Enfin, la transmission aux pédiatres des données prénatales – en particulier bactériologiques – est indispensable.
II-Rupture prématurée des membranes à terme
Il existe un bénéfice au déclenchement systématique du travail par rapport à une attitude expectative sous antibiotiques: moindre morbidité maternelle, moindre morbidité néonatale et plus grande satisfaction des patientes. Le délai entre la RPM et le déclenchement ne devrait pas excéder 48 heures. Concernant la technique de déclenchement nous utilisons l’adjonction d’ocytocine même sur col défavorable qui nous parît très préférable à l’utilisation des prostaglandines.
Répétons que la pratique du toucher vaginal avant l’entrée en travail spontané ou avant la décision de déclenchement doit être limitée au minimum.
En cas de déclenchement immédiat, une antibiothérapie systématique ne semble pas justifiée, l’intervention pouvant à elle seule éviter le risque infectieux. Si l’accouchement est différé, l’antibiothérapie systématique diminue les infections maternelles et néonatales.