Certaines caractéristiques du cancer renseignent sur les risques qu’a ce cancer de récidiver. On parle alors de facteurs de risque de récidive. Ces facteurs de risque sont déterminants dans le choix du traitement. En fonction de leur présence, les médecins optent pour tel ou tel traitement ou telle ou telle combinaison de traitements. C’est l’examen clinique et anatomopathologique (ou histoloqique) qui permettent de préciser la plupart de ces facteurs de risque de récidive.
Le rôle de l’histologiste est fondamental dans la prise en charge des cancers du sein. Il intervient en effet à l’étape diagnostique, à l’étape du traitement chirurgical et donne les informations capitales pour le choix des traitements complémentaires.
Lors de l’étape diagnostique il permet de porter le diagnostic de cancer sur les biopsies pratiquées par le radiologue (microbiopsies sous échographie, macrobiopsies stéréotaxiques par mammotome, Intact system). Ces biopsies permettent non seulement un diagnostic anatomo-pathologique mais permettent également de fournir les renseignements provenant de l’étude immunohistochimique des prélèvements.
Lors de l’étape chirurgicale, l’histologiste intervient:
1-Lors de l’examen extemporané de la pièce opératoire, pour préciser les marges saines de l’exérèse tumorale. Des marges insuffisantes doivent faire pratiquer une recoupe immédiate par le chirurgien.
2-Lors de l’étude du ganglion sentinelle.
3-Lors du résultat final qui doit indiquer obligatoirement certaines informations détaillées plus loin et qui permettent d’évaluer les facteurs de risques.
La gestion des prélèvements
La transmission des prélèvements
-Elle doit être rapide. Le délai entre l’exérèse et la fixation doit être le plus court possible car le geste chirurgical induit des phénomènes d’ischémie source de déterioration biologique pouvant impacterles analyses immunohistochimiques, les techniques d’hybridation et le séquençage. Le mieux est de réaliser une fixation immédiate au bloc opératoire
-les prélèvements doivent être orientés par le chirurgien, soit par des fils soit mieux fixés par des épingles sur plque de polystirène. puis immédiatement colorés selon les faces par l’histologiste.
-la pièce opératoire doit être si possible non fragmentée, ce qui pose le problème des recoupes qu’il faut alors orienter dans les trois dimensions et en évitant les sections au bistouri électrique qui peuvent géner l’appréciation des marges. La réalisation de recoupe est laissée à l’appréciation du chirurgien,
en fonction de l’aspect macoscopique des berges, d’un examen extemporané ou d’une attitude systématique (recoupes orientées par des fils et adressées en anatomopathologie).
-Le clipage des berges du lit tumoral (au moins 4 clips dont 1 sur le muscle pectoral) est systématique
L’examen extemporané
La pratique des biopsies pré-opératoires qui permettent le diagnostic de malignité en pré-opératoire a modifié les indications de l’examen extemporané. Il va rester nécessaire au diagnostic pour les rares patientes qui n’ont pas eu de biopsie, celles dont l’analyse per-opératoire découvre des lésions suspectes non attendues et les cas où la biopsie n’est pas formelle.
On ne fait pas d’extemporané sur les lésions non palpables et les lésions kystiques et papillaires, leur analyse étant insuffisamment fiable.
Il reste que dans les cas habituels l’examen extemporané est réservé aux carcinomes infiltrants essentiellemnt dans le but de guider le geste du chirurgien, en lui précisant la qualité d’exérèse macroscopique afin que cette exérèse ait le maximum de chances d’être complète en un seul temps opératoire.
Efin l’extemporané est utilisé pour l’analyser du ganglion sentinelle : si des cellules malignes sont identifiées dans ce ganglion, le chirurgien réalisera alors l’exérèse des ganglions voisins (curage axillaire).
Ci-dessous: modèle de compte-rendu d’examen extemporané:

L’examen macroscopique
Il se fait après fixation au formol Ph neutre. La durée de fixation varie entre 24 et 48 heures. les marges d’éxérèse sont repérées par des encres de Chine de couleurs différentes selon les faces afin de conserver l’orientation de la pièce lors de l’examen microscoique.
Au laboratoire, les prélèvements sont décrits à l’œil nu (examen macroscopique) puis les zones d’intérêt sont prélevées et disposées dans des cassettes identifiées par un numéro de traçabilité. Les échantillons subissent ensuite différentes étapes techniques dont le but est d’obtenir des blocs de paraffine dans lesquels sont inclus et conservés les tissus prélevés. Ces blocs tissulaires sont ensuite coupés au microtome et les coupes obtenues, étalées sur une lame qui sera colorée afin de permettre son analyse histologique au microscope.
Il existe deux grandes catégories de cancers du sein :
– les cancers in situ (carcinome intra canalaire ou carcinome intralobulaire) correspondent à des cellules cancéreuses qui ont envahi les canaux galactophores ou les lobules sans que la membrane basale qui les entoure ne soit franchie.
– les cancers infiltrants ou invasifs (carcinome canalaire infiltrant et carcinome lobulaire infiltrant) qui correspondent à des cellules cancéreuses qui ont franchi cette membrane basale pour envahir le sein.
Les informations microscopiques indispensables à rechercher :
Lorsque le pathologiste a diagnostiqué un cancer du sein il va rechercher des informations complémentaires nécessaires au choix du traitement.
• Mesure de la taille tumorale en mm
• Détermination du caractère in situ ou infiltrant
• Détermination du type histologique (canalaire ou lobulaire)
• Evaluation de la différenciation et du grade histo-pronostic de SBR
• Evaluation des berges d’exérèse, avec détermination de la marge la plus proche c’est à dire la distance séparant les cellules tumorales du bord du prélèvement.
• Recherche de cellules tumorales dans les vaisseaux et les ganglions.
Si le cancer est infiltrant, le pathologiste va également déterminer si la tumeur exprime certains facteurs afin de prédire la réponse à un traitement ciblé.
- -Evaluation des récepteurs hormonaux par méthode immunohistochimique Il s’agit d’un test qui permet de déterminer si les cellules cancéreuses possèdent des récepteurs hormonaux. Dans ce cas, la tumeur est hormonosensible, c’est à dire qu’elle pourra être sensible à la prescription d’une hormonothérapie.
- -Evaluation du statut de HER2 par immunohistochimie ou hybridation in situ. Il s’agit de tests qui permettent de déterminer si les cellules tumorales surexpriment la protéine HER2. Si c’est le cas, un traitement ciblé pourra alors être prescrit afin de bloquer l’action de cette protéine qui favorise la prolifération tumorale.
L’examen anatomopathologique sur la pièce opératoire permet de définir le stade TNM de la tumeur couplé au bilan dit d’extension, qui comporte: Une mammographie bilatérale, une échographie mammaire; une radiographie pulmonaire, une échographie abdomino-pelvienne, une scintigraphie osseuse.
Il est bon d’utiliser un compte-rendu standardisé tel que celui décrit sur ce lien.
Les facteurs pronostics
Certaines caractéristiques du cancer renseignent sur les risques qu’a ce cancer de récidiver. On parle alors de facteurs de risque de récidive ou de facteurs pronostics. Ces facteurs de risque sont déterminants dans le choix du traitement. En fonction de leur présence, les médecins optent pour tel ou tel traitement ou telle ou telle combinaison de traitements. C’est l’examen clinique et anatomopathologique (ou histoloqique) qui permettent de préciser la plupart de ces facteurs de risque de récidive.
Les principaux facteurs de risque de récidive du cancer du sein sont les suivants.
A-L’âge
Le cancer du sein qui affecte les femmes jeunes tend à être plus agressif, de haut grade et plus avancé au moment du diagnostic avec un risque accru de récidive.
B-La taille de la tumeur
Le pronostic est meilleur lorsque la tumeur est de petite taille. Elle apparaît dans la classification dite TNM (voir Classification TNM)
C-L’extension lymphatique
La présence de cellules cancéreuses dans les ganglions lymphatiques axillaires ou sus-claviculaires. Si le cancer du sein s’est propagé aux ganglions lymphatiques, le risque de récidive est plus grand que si le cancer ne s’y est pas propagé. Le risque augmente avec le nombre de ganglions atteints.
D-Le type histologique
Certains types de cancers du sein infiltrants (comme les carcinomes tubuleux, mucineux, médullaire et papillaire) risquent moins de se propager aux ganglions lymphatiques ; ils engendrent alors un pronostic plus favorable que le carcinome canalaire infiltrant. Nous donnons cependant cette classification, qui est purement histologique et tend à être abandonnée au profit d’une classification moléculaire que l’on trouvera plus loin dans cet article. Alors qu’il y a plus d’une trentaine de types différents de carcinomes et que les canalaires infiltrants représentent 80% du total, cette classification morphologique ne permet pas la compréhension de la biologie et n’a donc qu’une très faible utilité pour le choix de la thérapeutique.
Classification histologique des cancers du sein selon l’OMS 2002-2003:
Tumeurs épithéliales non infiltrantes:
- •Carcinome canalaire in situ (intracanalaire) (CCIS). La prolifération épithéliale maligne est dans la lumière soit du canal galactophorique. la membrane basale est toujours respectée; il n’y a pas d’infiltration.
- •Carcinome lobulaire in situ (CLIS). Le plus souvent de découverte fortuite, la fréquence est d’environ de 5 %. Les acini des lobules renferment une prolifération épithéliale faite de cellules monomorphes, élargissant la lumière et réalisant ainsi l’image d’un sac de billes.
Tumeurs épithéliales infiltrantes
Carcinome canalaire infiltrant de type non spécifique (canalaire TNS): 85% des cs
Carcinome lobulaire infiltrant: 15%
Carcinome rares (1%)
E-Classification Histopronostique de Scarf Bloom Richardson (SBR)
La classification originale de Scarf Bloom Richardson est basée sur trois critères histologiques différents. Elle a été modifiée par Elston et Ellis et adoptée de façon plus générale dans le cadre des critères de Nottingham. On évalue:
-Le degré de différentiation architecturale (côté de 1 à 3),
- • Présence de tubes occupant plus de 75% du champ du microscope : 1
- •Tubes occupant entre 10 et 75 % du champ du microscope : 2
- •Tubes occupant moins de 10% du champ du microscope : 3
Le nombre de mitoses par champ (côté de 1 à 3) mesuré au grossissement (x400) :
- •0 à 6 mitoses pour 10 champs : 1
- •7 à 12 mitoses pour 10 champ : 2
- •Plus de 12 mitoses pour 10 champs : 3
L’importance du polymorphisme cellulaire (côté de 1 à 3)
- •noyaux réguliers entre eux et taille cellulaire < 2 fois noyau normal : 1
- •situations intermédiaires : 2
- •noyaux réguliers entre eux mais taille > 3 fois la taille d’un noyau normal et nucléole proéminant
- •ou noyau de tailles irrégulières variant de 1 à 3 fois celle d’un noyau normal : 3
On aboutit ainsi à distinguer 3 grades différents :
Grade I: (total de 3 à 5) : cancers bien différenciés
Grade II: (total de 6 à 7) : cancers moyennement différenciés
Grade III: (total de 8 à 9) : cancers indifférenciés
Le grade de Scarff, Bloom et Richardson joue un rôle important dans la décision de traitement adjuvant après chirurgie locale.
L’étude des récepteurs hormonaux
Il s’agit du dosage récepteurs à l’œstrogène ou à la progestérone sur les fragments de tumeur. Si plus de 10% des cellules sont positives, le récepteur est considéré positif. Cela détermine l’hormonodépendance de la tumeur. C’est une étude immunohistochimique qui permet ou non une hormonothérapie (tamoxifène, anastrozole).
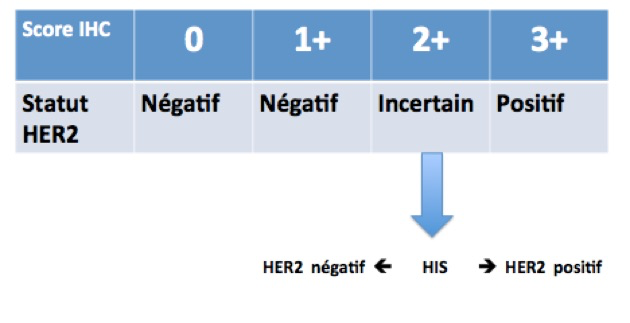
Etude des récepteurs HER2
HER2 est une protéine naturellement présente dans l’organisme. Il s’agit d’un récepteur transmembranaire

impliqué dans la régulation de la prolifération cellulaire. Quand une cellule devient cancéreuse, il peut arriver que le nombre de récepteurs HER2 présents à sa surface augmente anormalement. Cette augmentation favorise la croissance des cellules cancéreuses. On dit alors que ces cellules « surexpriment » HER2 ou qu’elles sont HER2 positives. La surexpression du récepteur HER2 est retrouvée chez 12 à 20 % des femmes atteintes d’un cancer du sein. Le résultat est exprimé selon une graduation de 0 à 3+. S’il est 0 ou 1+, la recherche est négative, il n’y a pas surexpression de HER2. S’il est 3+, le résultat est positif, il y a surexpression de HER2. Lorsque le résultat est 2+, il est incertain. La technique dite d’Hybridation In Situ (HIS) est alors utilisée pour confirmer ou infirmer la surexpression HER2. Le résultat est alors soit négatif, soit positif. En cas de test HER2 positif, une thérapie ciblée anti-HER2 pourra alors être proposée.

Mesure du Ki67
Ki 67 est Protéine nucléaire exprimée pendant toutes les phases du cycle cellulaire sauf G0. Elle est mise en évidence par immunohistochimie sur coupes. C’est un
marqueur corrélé avec l’index mitotique: donc le grade histologique. Le résultat est exprimé en pourcentage de cellules tumorales positives. Le seuil de positivité n’est pas encore très précis, il varie selon les études entre 10 et 20%.
Ce score contribue à différencier les tumeurs luminales A et B et de préciser le pronostic des tumeurs de grade II qui sont problématiques dans la reproductibilité diagnostique et le traitement. Il nécessite une parfaite fixation des biopsies et pièces opératoires.
Son inconvénient est sa reproductibilité d’un laboratoire à l’autre qui est imparfaite et la précision du seuil.
La protéine P53
Le p53 est une protéine régulant certaines fonctions cellulaires importantes comme la mitose ou la mort programmée. P53 est capable en réponse à un stress cellulaire d’initier l’arrêt du cycle cellulaire et l’apoptose. Lors d’une agression cellulaire, la concentration et la demi-vie de p53 s’accroissent par une diminution de sa dégradation physiologique. Son rôle est soit de réparer l’ADN, soit de provoquer une mort cellulaire pour limiter les dégats. Le gène codant pour la protéine p53 est endommagé dans la moitié des cancers chez l’Homme, ce qui ne permet plus cet effet protecteur. Cet anti-oncogène est l’oncogène le plus souvent muté dans les cancers à un stade évolué. La protéine P53 mutée se lie à la protéine P53 normale (ou protéine P53 sauvage) et empêche son action. La protéine P53 mutée possède une demi-vie longue et s’accumule donc dans le noyau de la cellule cancéreuse où elle peut être révélée par immuno-histochimie.
La mise en évidence de mutations dans les cancers semble être un facteur de mauvais pronostic. L’accumulation dans le noyau des cellules tumorales de la protéine p53 induite par l’anti-oncogène p53 muté, peut être évaluée par technique immunoenzymatique sur coupes de tissu.
Qualité d’exérèse: classification R
L’état des berges après chirurgie conservatrice est maintenant précisé par la classification R:
*RX= impossible d’apprécier la présence d’un reliquat tumoral
*R0= pas de reliquat tumoral
*R1= reliquat tumoral microscopique
*R2= reliquat tumoral macroscopique
Les critères de mauvais pronostic
Certains critères sont considérés de mauvais pronostic. ceux qui suivent sont classiques mais d’autres s’y rajoutent aujourd’hui:
-La taille de la tumeur.
-Le jeune âge (<35ans).
-La présence de signes inflammatoires locaux.
-Envahissement ganglionnaire, surtout avec rupture capsulaire.
-l’invasion lymphatique et vasculaire.
-Présence de métastases.
-Statut SBR 3
-Statut HER2 négatif.
-le Ki67.
-Présence d’embols vasculaires.
-Absence de récepteurs hormonaux
-Et la signature génomique de la tumeur, lorsqu’elle peut être faite, permettant de déterminer un score de récidive (voir le chapitre sur la génomique du cancer du sein)
Les principaux critères pronostiques pour les cancers infiltrants présentés en taux de survie à 5 ans sont les suivants:
-Critères cliniques

Age inférieur à 35 ans = mauvais pronostic
Bonne réponse à la chimiothérapie première = bon pronostic
-Critères anatomopathologiques:

Tous ces différents critères pronostiques sont liés : c’est dans la catégorie des T1 qu’il y a le plus de SBRI, de N0 et de N-. Cependant chacun des critères pronostiques indiqué à une valeur pronostique en soi si tous les autres facteurs pronostiques sont égaux.
Le compte-rendu anatomopathologique
Un certain nombre d’éléments doivent figurer au minimum sur le compte-rendu anatomopathologique:
-Type tumoral et sous-type selon la dernière classification moléculaire de l’OMS (voir ci-après)
-Taille de la composante infiltrante (les deux dimensions les plus grandes)
-Taile de l’extension tumorale complète
-Le caractère uni ou multifocal
-Grade SBR (modifié Elston et Ellis)
-Extension tumorale: présence ou non d’embols vasculaires tumoraux; extension cutanée, mamelon, muscle
-Qualité de l’éxérèse (classification R, -voir plus haut-)
-Nombre et taille des métastases ganglionnaires. Le nombre de ganglions examinés et le nombre des ganglions envahis avec ou sans rupture capsulaire. Il en faut classiquement au minimum 10. En fait un nombre moins important semble suffire (6 ganglions), au minimum on se contente d’un ganglion s’il s’agit du ganglion sentinelle et s’il est négatif.
-Stroma et infiltrat inflammatoire
-Corrélation entre les données d’imagerie et de pathologie.
Classification moléculaire des cancers du sein
La classification ci-dessus est basée sur des critères morphologiques. Sachant que les carcinomes canalaires infiltrants représentent 85% de l’ensemble ce qui est d’une utilité très limitée pour le choix des traitements. Récemment, le développement des analyses génomiques permet d’analyser simultanément l’expression de nombreux gènes (jusqu’à 25 000 gènes) grâce aux puces à ADN ou microarrays et donner un profil de chaque tumeur.
L’étude de l’expression génique permet ainsi de proposer une nouvelle classification dite “moléculaire” en classes ou sous-types dans le cancer du sein. (voir le chapitre séparé: la génomique des cancers du sein)
Pour comprendre cette classification qui se rapporte aux constituants normaux du sein, il est nécessaire de faire un rappel concernant l’histologie du tissu mammaire normal.
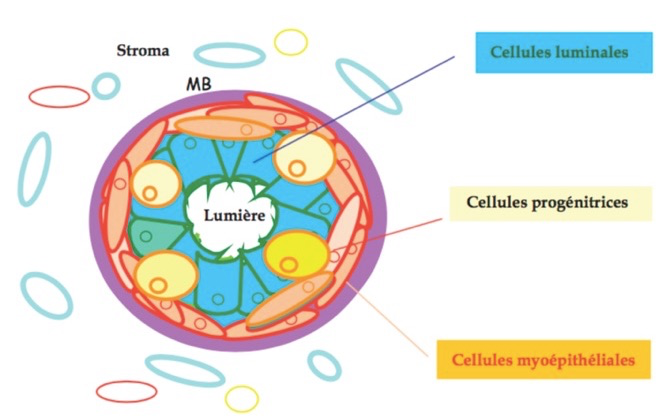
Les canaux et lobules sont bordés par deux types de cellules :
-Les cellules luminales qui bordent la lumière des lobules et des canaux expriment des marqueurs associés aux récepteurs hormonaux (récepteurs des œstrogènes et de la progestérone), certaines cytokératines (CK8, CK18) ainsi que des facteurs de transcription spécifi- ques comme GATA3 et FOXA1.
-Les cellules myoépithéliales (ou basales) entourent les cellules luminales et sont au contact de la membrane basale. Elles expriment les cytokératines CK 5/6, CK14, CK17 et à l’état très différencié
des marqueurs musculaires lisses comme l’actine musculaire lisse et p63.
-Il existe aussi des cellules souches progénitrices qui peuvent se différencier en cellule basale ou luminale. Elles sont situées dans les canaux en faible nombre et sont situées en position basale ou supra-basale, probablement au niveau de niches spécialisées:
L’orientation d’une cellule épithéliale mammaire vers le lignage luminal ou myoépithélial pourrait être sous le contrôle de gènes « maîtres ». GATA3 pourrait être un de ces gènes « maîtres » pour le lignage luminal.
L’efficacité d’un traitement sera maximale s’il touche la bonne cellule. Un nombre croissant d’arguments permettent de penser que le cancer du sein se développe à partir des cellules souches mammaires (ou de leur descendants immédiats, les progéniteurs précoces) après une série d’altérations génétiques. Ces cellules, définies ainsi comme cellules souches cancéreuses (CSC) et dotées de la capacité à s’auto-renouveler, seraient les seules à alimenter la prolifération et la croissance de la tumeur. Elles seraient également à l’origine des métastases. Un traitement ne pourrait donc être réellement efficace que s’il cible et détruit ces CSC. La meilleure caractérisation des cellules souches et des deux lignages mammaires ainsi que la définition des sous-types moléculaires dans les cancers du sein permettent de dégager des grandes lignes cohérentes et un schéma provisoire:
À partir de cellules souches et leurs descendants immédiats (progéniteurs bipotents prolifératifs), deux lignages cellulaires se développent, aboutissant à des cellules matures différenciées. Le lignage luminal comprend des cellules capables de produire le lait pendant la lactation. Le lignage myoépithélial entoure le précédent et comprend des cellules différenciées exprimant des marqueurs du muscle lisse. Les altérations génétiques touchent les cellules souches ou les progéniteurs (flèches rouges) produisant une tumeur faite de cellules immatures si les capacités de différenciation sont limitées (tumeurs basales) ou de cellules progressant le long du lignage luminal (tumeurs luminales). Voir le scéma ci-après (AR = auto-renouvellement):
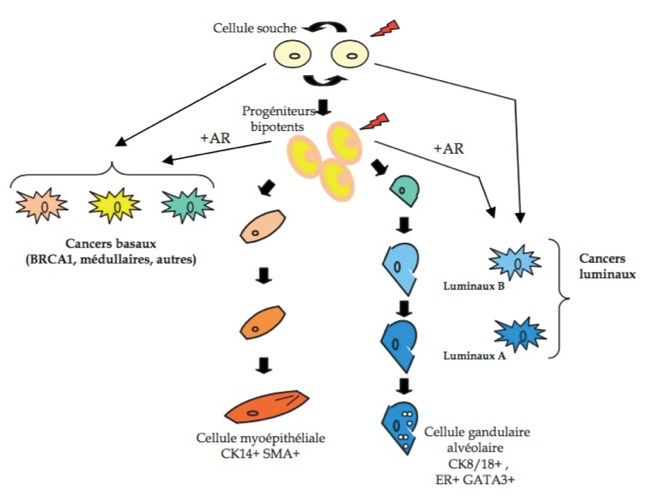
La différence entre les cancers basaux et luminaux est importante. Il s’agit probablement de deux maladies différentes. Ceci exige leur reconnaissance en routine et un traitement approprié. En fait toutes ces nouvelles techniques permettent actuellement d’identifier au moins 4 sous-classes moléculaires de cancers du sein invasifs pouvant correspondre à des pronostics et des traitements différents.
On distingue donc, au moins, 4 sous-types moléculaires :
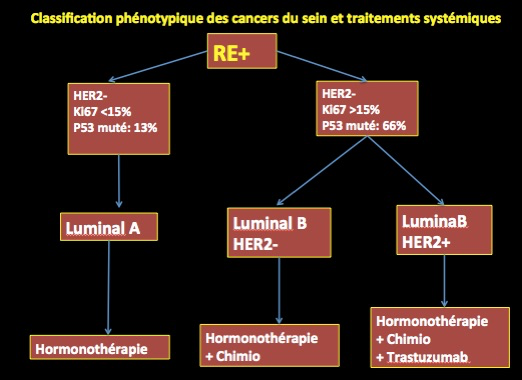
1-Les cancers du sein dits « luminaux » : luminal A et luminal B, caractérisés par l’expression du récepteur œstrogène (RE) et de gènes associés à la voie du RE;
2-Les cancers du sein HER2-like , caractérisé par la surexpression et l’amplification du gène HER2 sur le chromosome 17q12 et surexpriment l’oncoprotéine Her2, protéine appartenant à la superfamille des récepteurs à l’ epidermal growth factor , (EGF) mais également peuvent exprimer les récepteurs aux estrogènes et à la progestérone.
3-Les cancers du sein de phénotype basal , n’expriment ni les récepteurs hormonaux, ni l’oncoprotéine HER2 et sont souvent désignés par le terme « triple négatifs ». Ils expriment, en revanche, un certain nombre de gènes des cellules basales de l’épithélium.
4-Les cancers du sein dits normal breast-like , sont caractérisés par un profil triple négatif et par l’expression de gènes observés dans le tissu mammaire normal et le tissu adipeux.


En pratique, on va distinguer deux cas de figure: soit les récepteurs hormonaux sont exprimés, soit ils ne le sont pas (négatifs).
-cas où les récepteurs hormonaux sont positifs
On se situe là dans le cadre des tumeurs de type luminal
Ce sont les formes les plus fréquentes des cancers du sein avec près des deux tiers des cas.
Le terme luminal se rapporte au nom donné à un des deux types cellulaires du tissu mammaire normal.
Ces tumeurs sont appelées luminal car leurs gènes codent les protéines des cellules épithéliales de la lumière des canaux ou des lobules du sein. Leur profil protéique est caractérisé par
-L’expression des cytokératines CK8+, CK18+ et CK19+
-Des formes histologiques particulières : lobulaire, mucineux, carcinome canalaire infiltrant de grades I et II
-Un niveau d’expression du marqueur Ki67 permettant de différencier entre les sous types A et B
Ces tumeurs comportent donc deux sous-types, A et B, selon qu’elles expriment fortement, luminal A ou faiblement, luminal B, les récepteurs des œstrogènes (RE+). Ces tumeurs expriment les cytokératines (CK) 8/18. Dans plus de 10 % des cas, ces tumeurs sont associées à une mutation du gène de maintien du génome, le TP53 .
a – Le sous-type luminal A
Il est caractérisé par une expression des récepteurs hormonaux œstrogènes (RE+) et/ou à la progestérone (PR+), l’absence de surexpression de géne HER2 et un taux de mutations p53 faible .
Les tumeurs sont souvent de bas grade histologique .
b -Le sous-type luminal B
Il a la même caractéristique en ce qui concerne les récepteurs hormonaux (RE+et/ou RP+) mais il y a, plus souvent, une surexpression du gène HER2 +.
Les tumeurs sont habituellement de haut grade histologique.
Concernant le pronostic de ces tumeurs,, elles sont souvent de Grade I mais le grade semble plus élevé dans le sous-types B .
De bon pronostic pour le sous-type A, il l’est moins favorable pour le sous-types B, ce qui explique, peut-être, les différences de réponse aux traitements.
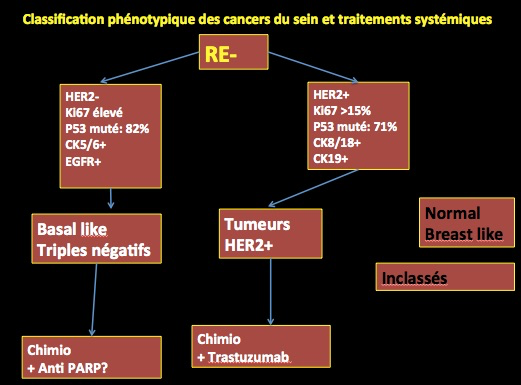
cas où les récepteurs hormonaux sont négatifs
Là, on va distinguer trois types de tumeurs différentes.
a-les tumeurs dites «basal like»
Ces tumeurs représentent 15 à 20 % des cancers du sein. Elles proviennent de Ces cellules sont en position « basale » juste au contact de la membrane basale, soit au niveau des cellules myoépithéliales.
Les tumeurs de type basal ou basal-like sont caractérisées par l’expression de gènes identiques à ceux exprimés par des lignées de cellules myoépithéliales. En immunohistochimie, ces tumeurs expriment des marqueurs des cellules myoépithéliales (ou basales) du sein normal : l’actine musculaire lisse, les cytokératines CK5/6, CK14, CK17. Ce groupe est le mieux identifié par les différentes études génomiques. Les tumeurs ont un phénotype particulier et reproductible : récepteurs aux estrogènes (RE) -, HER2-, expression d’au moins un marqueur de cellules basales (CK5/6, EGFR, vimentine, actine musculaire lisse, c-kit). Ces tumeurs sont en majorité récepteurs à la progestérone (RP) -, présentent un taux plus élevé de mutation de p53 ; leur grade histopronostique est de type III avec une activité mitotique élevée.
Les carcinomes de type basal regroupent les carcinomes de type médullaire atypique, les carcinomes liés à une mutation du gènee BRCA1 , les carcinomes canalaires infiltrants (Grade 3 sbr) et les
les carcinomes métaplasiques. Ce sous-type a un pronostic défavorable pour la survie globale et sans rechute. En revanche, il est associé à un taux plus élevé de réponse complète à une chimiothérapie néoadjuvante à base d’anthracyclines.
a bis- Les tumeurs «triple négatives»
Par extension et par ressemblance avec les tumeurs «basal like», on parle de tumeurs “triple négatif” qui sont (RE- RP- HER2-) et qui comprennent un grand nombre de tumeurs de type basal. Il n’y a toutefois pas de superposition complète entre ces deux groupes. Ces tumeurs “triple négatives” ont un pronostic particulièrement mauvais et des essais thérapeutiques se mettent en place pour cette catégorie de tumeurs représentant moins de 15 % des tumeurs du sein. Ce sont des tumeurs agressives, peu différenciées, de grade III.
Leurs caractéristiques épidémiologiques et cliniques comprennent un âge plus jeune au diagnostic, une obésité associée ou non à un syndrome métabolique, un risque de rechute plus élevé malgré une plus grande chimiosensibilité, une plus grande fréquence des métastases pulmonaires et cérébrales. Elles sont plus souvent diagnostiqués au stade de tumeur cliniquement détectable à la palpation.C’est une forme fréquente dans les cancers d’intervalle (cancers diagnostiqués entre deux mammographies de dépistage). Leur évolution est sombre, avec une grande fréquence de récidives et dissémination métastatique. Cette gravité est accrue encore du fait d’une résistance aux diverses thérapeutiques : elles ne sont pas sensibles aux traitements hormonaux pas plus qu’au trastuzumab et réagissent mal aux chimiothérapies classiques. Elles sont chimiosensibles aux sels de platine et aux antiangiogéniques et résistantes aux anthracyclines.
b-les tumeurs HER2+ (ou HER2 like)
Ce groupe est le plus souvent défini comme incluant toutes les tumeurs HER2 + quelle que soit leur expression des récepteurs hormonaux. Un progéniteur luminal serait à l’origine de ces tumeurs. Leur phénotype est HER2+, CK8/18/19+. Ce groupe comprend les tumeurs de type apocrine et des canalaires infiltrants de grades II et III. Leur pronostic est défavorable. Ces tumeurs sont de grade élevé et possèdent un taux de mutation de TP53 dans plus des deux tiers des cas. Ce type moléculaire correspond aux carcinomes infiltrants de Grades 2 et 3 sbr. le pronostic est défavorable.
Des études montrent que les cancers du sein ayant trop de protéine HER2/neu sont traités plus efficacement par une chimiothérapie qui comporte des médicaments de type anthracycline, comme la doxorubicine ou l’épirubicine que par les associations de chimiothérapie qui ne contiennent pas ce type de médicament.
Les cancers du sein avec un excès de protéine HER2/neu ou cerbB-2 peuvent également être soignés avec un médicament appelé Herceptin™.
L’Herceptin™ est un anticorps monoclonal spécifique qui bloque la protéine HER2/neu et prive donc les cellules cancéreuses d’un facteur contribuant à leur croissance. Ce médicament utilisé au début, pour bloquer l’évolution de la maladie des patientes souffrant de métastases a vu son champ d’application aux traitements adjuvants des cancers surexprimant HER2.En cas de surexpression d’HER2, on vous proposera une traitement par l’Herceptin TM .
De plus, la positivité de HER2 peut orienter le choix des traitements complémentaires, car le statut de tumeur HER2+ peut signifier une résistance à l’hormonothérapie, notamment au tamoxifène, peut être prédictif d’une réponse aux anthracyclines à doses élevées, peut indiquer une résistance au protocole CMF
et être associé à une augmentation de la réponse aux taxanes
c-les tumeurs normal breast-like
Pour ces tumeurs l’expression génique est proche de celle du tissu mammaire normal. Le phénotype des tumeurs de ce sous type n’est pas décrit. Leur pronostic est intermédiaire.
Il reste environ 10 à 15 % de tumeurs inclassées n’appartenant pas aux groupes précédemment décrits.
Certains sous-types sont eux-mêmes hétérogènes tels que les sous-types luminal A (hétérogénéité des tumeurs ER+), basal (p53 +/- ; BRCA1) et HER2 (ER +/-) et des analyses plus approfondies permettront d’améliorer cette classification.
Enrésumé, et compte tenu de toutes ces notions, on va distinguer: