Définitions
Losrqu’un foetus parait trop petit au cours de la grossesse, on parle aujourd’hui de PAG, c’est-à-dire de petit poids pour l’âge gestationnel. Cela se définit par un poids isolé (estimation pondérale in utero ou poids de naissance) inférieur au 10e percentile. Le PAG sévère correspond à un PAG inférieur au 3e percentile.
Parmi ces PAG, certains sont des enfants constitutionnellement petits, sans que cela soit anormal (tout le monde n’est pas pareil), mais certains parmi eux sont petits pour des raisons anormales qui les menacent. On parle pour ces derniers de RCIU, ou Retard de Croissance Intra-Utérins. Le RCIU correspond le plus souvent à un PAG associé à des arguments en faveur d’un défaut de croissance pathologique : arrêt ou infléchissement de la croissance de manière longitudinale (au moins 2 mesures à trois semaines d’intervalle).
Diagnostic
La mesure de la hauteur utérine reste intéressante à partir de 22 semaines mais l’échographie reste l’examen essebtiel. Le problème est que la performance de l’échographie pour dépister les PAG est faible avec une sensibilité de 22 % en France. Cela signifie qu’environ 22% des bébés souffrant de RCIU ne sont pas diagnostiqués au cours de la grossesse. De plus, une étude de l’INSERM portant sur 14000 femmes a montré que près de la moitié des enfants que l’on soupçonnait de RCIU avait finalement un poids normal à la naissance. Ce qui laisse entendre que la moitié des diagnostics seraient en fait des faux positifs. Or, la suspicion d’un RCIU pendant la grossesse est associée à une augmentation de la morbidité et de la mortalité foetale.
Ces difficultés sont liées à la marge d’erreur des mesures échographiques et au fait que ces mesures se réfèrent à des courbes de croissance anciennes et qui ne tiennent pas compte de certains facteurs. En effet, le sexe fœtal, la taille et le poids maternels en début de grossesse, la parité, et l’origine ethnique influencent significativement le poids fœtal, le sexe étant le facteur prépondérant. L’utilisation d’une courbe non différenciée par sexe conduit à suspecter préférentiellement le faible poids chez les filles (faux positifs) et ignorer des PAG garçons (faux négatifs) . L’adoption homogène de nouvelles courbes de croissance, en période prénatale comme à la naissance, est une nécessité et est en cours de réalisation.
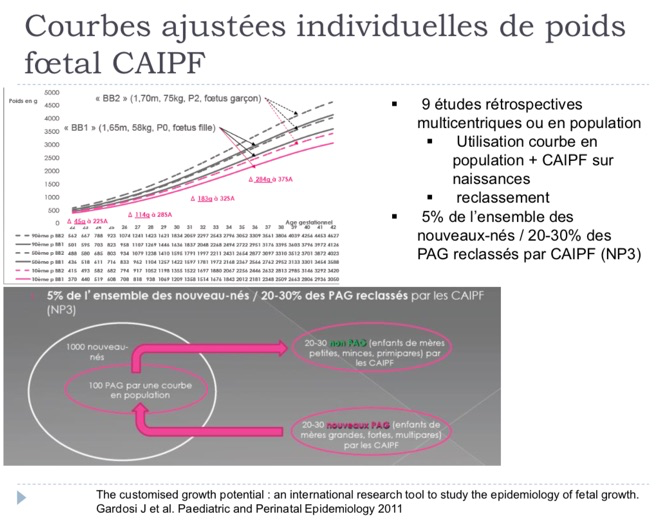
Les mesures échographique faites en routine sont: sont recommandés : périmètre céphalique (PC), périmètre abdominal (PA), longueur fémorale (LF). Ces mesures permettent le calcul de l’estimation de poids fœtal (EPF) qui est, avec le PA, le paramètre le plus pertinent pour le dépistage. De nombreuses formules de calcul ont été publiées (59) ce qui montre bien la difficulté de passer de mesures linéaires à un poids. On utilise le plus souvent la formule d’EPF de Hadlock à 3 paramètres (PC, PA et LF). Elle a montré son intérêt pour les populations à bas et à haut risque de PAG. Pour 95 % des patientes, l’estimation de poids fœtal a une erreur maximale de +/- 20 %. Cela veut dire que pour 5 % des patientes, l’écart entre le poids estimé et le poids réel est de plus de 20 %. Cet EPF correspond à un chiffre de poids au moment de l’échographie, aussi est-il important de l’exprimer en percentile par rapport aux courbes utilisées.
Bien évidemment la fiabilité de ces mesures dépend étroitement de la connaissance la plus précise possible de la date de début de grossesse. On rappelle qu’une première échographie faite vers 8 semaines est la plus précise pour déterminer cette date, donc si possible avant l’échographie classique de 11-14 semaines. Malgré cela, la précision n’est pas à un jour près. Il est d’usage de calculer le début de grossesse à partir de la date des dernières règles. Cette date sera corrigée en fonction des données échographiques que si la date estimée par échographie est différente de plus de 7 jours de la date déduite des dernières règles normales. Ainsi les comptes rendus devraient conclure à une date donnée +/- 5 ou7 jours .
Voici pour l’exemple l’une des formules de Hadlock:
Hadlock et al. (1985) » Log10 EPF = 1.326 + 0.0107 PC + 0.0438 PA + 0.158 LF – 0.00326 (PA) (LF)
Il est rappelé qu’un fœtus dont toutes les biométries sont ≥ 10e percentile peut avoir une EPF < 10e percentile!
Dans une population à bas risque de PAG et dans le cadre d’une échographie de dépistage, on va considérer comme suspect une biométrie (EPF) inférieure au 3e percentile, même en l’absence de toute autre anomalie clinique ou échographique associée.
Pour les populations à risque de PAG ou en présence d’une anomalie clinique ou échographique, c’est le seuil du 10e percentile qui est choisi.
Pour contribuer au diagnostic de RCIU, si la répétition de l’examen biométrique est nécessaire, l’intervalle minimum est de 3 semaines. Cet intervalle peut être plus faible si l’EPF est importante dans la décision d’une éventuelle extraction fœtale .
Les facteurs de risque de PAG
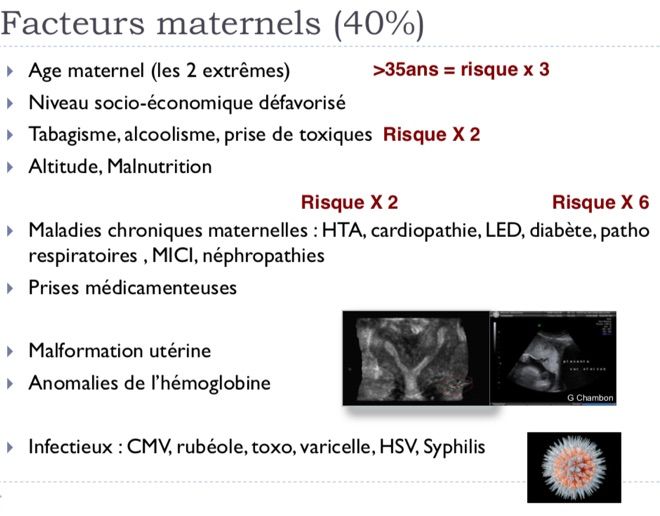
Un antécédent de PAG multiplie par 4 le risque de PAG. L’âge maternel de plus de 35 ans augmente le risque d’un facteur 3 par rapport aux femmes de 20 à 30 ans. La primiparité et la grande multiparité : risque multiplié par 2. Les troubles hypertensifs augmentent la fréquence de PAG :
hypertension artérielle chronique (d’un facteur 2), prééclampsie (d’un facteur 5 à 12 selon la sévérité de l’atteinte et les études), hypertension gravidique (d’un facteur 2). Un diabète préexistant à la grossesse avec atteinte vasculaire est associé au PAG (risque multiplié par 6). Tabagisme actif pendant la grossesse : risque multiplié par 2 pour une consommation de 10 cigarettes par jour avec un effet- dose. La consommation alcoolique multiplie le risque par 2. Une consommation de drogues pendant la grossesse est associée à une fréquence augmentée de PAG (risque multiplié par 3).
Autres facteurs de risque (augmentation du risque inférieure à 2) : insuffisance pondérale, obésité, niveau socio-économique défavorisé.
Les causes de PAG
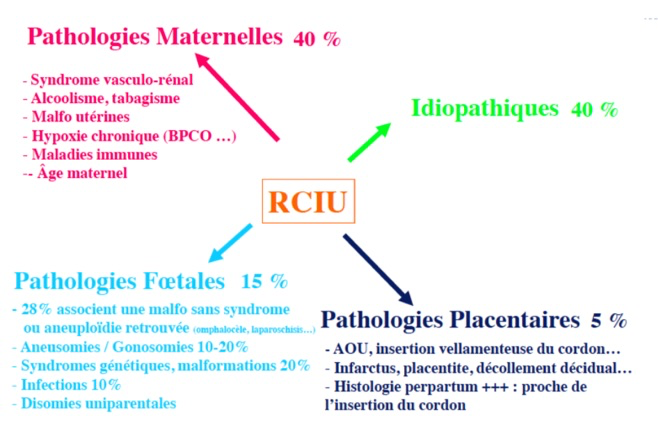
Les causes sont multiples et différentes en fonction du type de RCIU (harmonieux ou dysharmonieux) :
-Cause maternelle. Il peut alors s’agir de pathologies maternelles comme une pathologie cardiaque ou hématologique par exemple, d’une prise de toxiques (tabac, alcool), de malformations de l’utérus, etc…
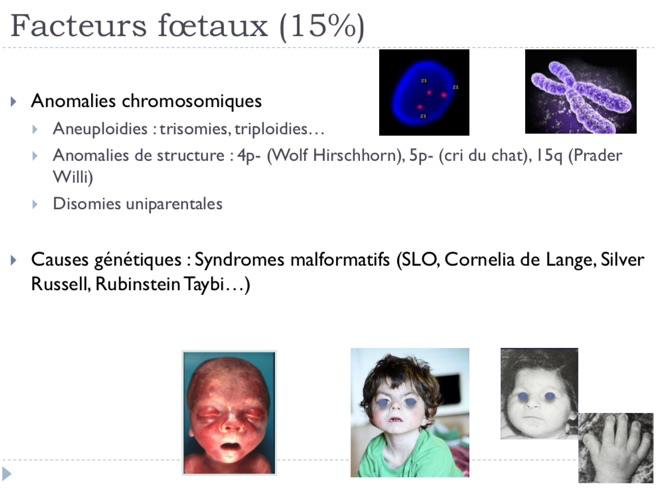
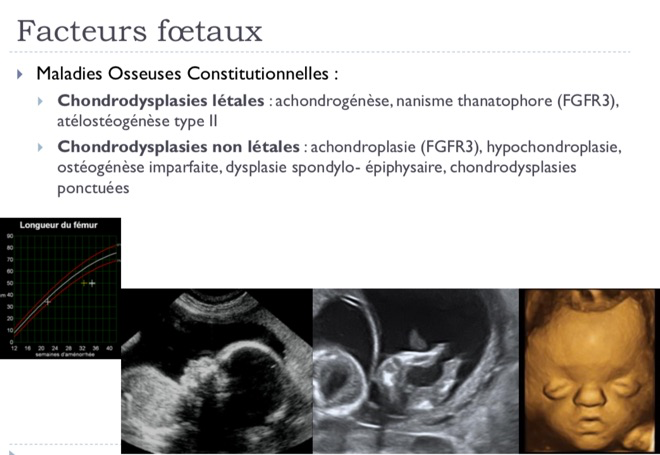
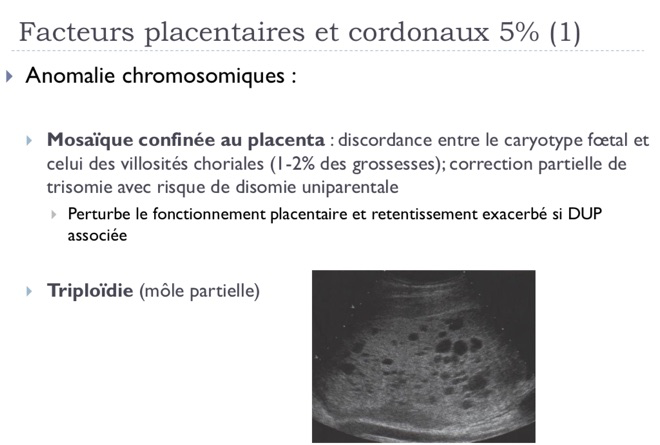
-Cause fœtale. Il peut s’agir d’anomalies chromosomiques, d’anomalies génétiques, d’infections fœtales (toxoplasmose, rubéole, cytomégalovirus, varicelle…), ou de grossesses multiples.
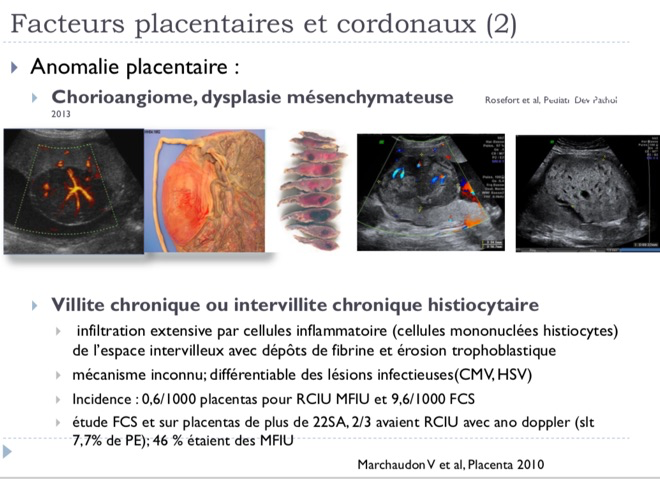
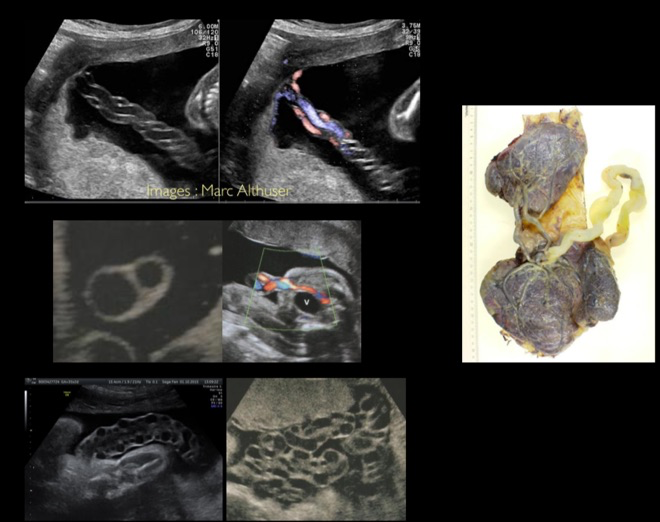
-Causes placentaire, c’est-à-dire que le placenta ne permet pas une « vascularisation » adéquate du fœtus, on parle alors d’insuffisance placentaire. Outre le RCIU, cela peut se traduire par la survenue d’une hypertension artérielle maternelle, d’une présence de protéines dans les urines, et l’on parle alors de pré-éclampsie. Dans d’autres cas, le cordon peut présenté une insertion particulière au niveau du placenta ou présenter un nœud…
-Enfin dans les cas restants, on parlera de petite taille constitutionnelle fœtale. C’est à dire que le fœtus ne présente aucune pathologie excepté une petite taille (en général, ses parents sont également de petite taille).

Conséquences
Les risques des RCIU pathologiques sont:
-la mort foetale in utero;
-l’asphyxie pernatale;
-des troubles métaboliques (hypoglycémie, hypocalcémie), des troubles digestifs ou hématologiques;
-des troubles du développement psychomoteur;
-un retard statural;
-un syndrome métabolique et vasculaire à l’âge adulte.
Bilan étiologique et surveillance
Les investigations complémentaires ont pour but d’évaluer la vitalité fœtale et les possibilités de poursuite de la grossesse dans des conditions de sécurité pour la mère et le fœtus, etétablir l’origine du PAG. Le bilan est à envisager lorsque l’estimation de poids fœtal est < 10e percentile ou < 5e per centile (à défaut lorsque le périmètre abdominal est < 10e percentile).
L’échographie doit vérifier les anomalies biométriques, rechercher d’autres anomalies du fœtus, du liquide amniotique, du placenta et des Doppler.
Le dépistage d’une infection materno-fœtale à CMV, par une simple sérologie maternelle, peut être proposé d’emblée en l’absence d’argument pour une cause vasculaire.
La difficulté principale est de décider si un prélèvement invasif (amniocentèse le plus souvent) doit être réalisé. Ce prélèvement comprendra selon les cas un bilan infectieux, une analyse chromosomique et/ou génique voire d’autres dosages plus spécifiques.
Les arguments qui plaident pour un prélèvement invasif sont principalement :
anomalie biométrique précoce et/ou sévère ;
– association à une quantité augmentée de liquide amniotique ;
– association à une/des anomalie(s) morphologique(s) ;
– absence d’anomalie Doppler ;
– absence d’autre cause évidente ;
– parents désireux d’un diagnostic prénatal ;
– résultats susceptibles de modifier la prise en charge.
Le Doppler ombilical, volontier associé au Doppler cérébral, et le rythme cardiaque fœtal (RCF) sont les premiers outils de surveillance à mettre en place en cas de diagnostic de RCIU. L’hospitalisation n’est pas systématique.
Lorsque le foetus a à faire face à une réduction de son apport en oxygène dans le cadre d’une hypoxie chronique, il redistribue son flux sanguin pour préserver les flux cardiaques et cérébraux en vasodilatant ces territoires, ce qui diminue sélctivement l’index de résistance dans les artères cérébrales. Le Doppler des artères cérébrales se fait au niveau des artères cérébrales antérieures et s’exprime en terme de rapport entre les index de résistance cérébraux et placentaires. Ainsi un rapport cérébro-placentaire <1 traduit une redistribution des flux avec vasodilatation cérébrale. Si dans un second temps ce rapport se normalise cela peut traduire le dépassement du mécanisme de protection cérébrale à l’hypoxie.
Une cure de corticoïdes est recommandée chez les patientes dont le fœtus présente un RCIU et chez qui une extraction fœtale est envisagée avant 34 SA.
En cas de Doppler ombilical avec diastole normale, celui-ci sera répété toutes les 2 à 3 semaines, combiné à la réalisation d’un Doppler cérébral et d’une biométrie. La fréquence de la surveillance sera adaptée à la sévérité du RCIU.
En cas de Doppler ombilical anormal avec une diastole encore positive, et si un accouchement n’est pas envisagé, une surveillance par Doppler ombilical, cérébral et RCF sera répétée toutes les semaines ou de façon pluri-hebdomadaire selon la sévérité du RCIU. Cette surveillance peut être faite en ambulatoire .
En cas de diastole nulle ou de reverse flow au Doppler ombilical une hospitalisation est à envisager pour réaliser une cure de corticoïdes et organiser la surveillance voire la naissance. Un RCF sera réalisé tous les jours.
Indications de naissance
– Avant 32 SA : L’impact de la prématurité induite est majeur et justifie d’envisager un traitement conservateur même en cas de Doppler ombilical pathologique. Un arrêt de la croissance fœtale isolé (Doppler fœtaux normaux et RCF normal) n’est pas en soi une indication d’extraction fœtale.
L’index de pulsatilité (IP) du ductus venosus (ou canal d’Arantius) > 95e percentile et les anomalies du RCF (VCT < 3 ms ou rythme peu oscillant ou décélérations répétées) sont des critères indépendants de naissance des RCIU < 32 SA. L’accouchement doit être envisagé lorsqu’un de ces deux paramètres est anormal de manière persistante.
Après 32 SA : la naissance ou l’expectative sont deux options possibles. En cas de reverse flow ou de diastole nulle permanente sur le Doppler ombilical après 34 SA, un accouchement devra être
envisagé. En cas de Doppler ombilical anormal avec diastole positive, il est recommandé une surveillance renforcée par Doppler ombilical, cérébral et RCF de manière pluri-hebdomadaire. Une surveillance en ambulatoire est possible.
Une naissance peut être envisagée à partir de 37 SA en fonction de l’estimation pondérale, de la quantité du liquide amniotique et de la mesure des Doppler. La voie d’accouchement tiendra compte des caractéristiques maternelles et obstétricales (parité, utérus cicatriciel, indice de masse corporelle (IMC), conditions locales cervicales)