Le liquide amniotique
Le liquide amniotique entoure le fœtus pendant toute la vie intra-utérine. Il joue un rôle de protection essentiel en protégeant le fœtus contre les traumatismes externes par un rôle tampon et permet, en offrant un espace à faible résistance et en maintenant l’expansion de la cavité utérine, la mobilité fœtale, indispensable au développement fœtal, en particulier des appareils locomoteur, cardiopulmonaire et digestif. De plus, il possède des propriétés antibactériennes et assure une lubrification, prévenant l’apparition des brides amniotiques.
Le volume de liquide amniotique est un indicateur essentiel du bien-être fœtal. Les anomalies de volume, qu’il s’agisse du manque de liquide amniotique (oligoamnios) ou de l’excès de liquide amniotique (hydramnios), sont des signes d’appel potentiels d’une pathologie fœtale ou maternelle.
A-Physiologie du liquide amniotique
1-Composition du liquide amniotique
Le liquide amniotique est composé de 98 % d’eau et son pH se situe entre 7,10 et 7,20. La composition du liquide amniotique est proche de celle du sérum maternel et fœtal en début de grossesse. Le taux de sodium dans le liquide est de 116mmol/L, alors qu’il est de 142mmol/L dans le plasma fœtal et de 40mmol/L dans les urines. Les concentrations de sodium et de chlore diminuent au cours de la grossesse alors que celles de l’urée et de la creatinine augmentent. Le liquide amniotique comporte en outre de nombreux composants et tous les acides aminés sont présents dans le liquide amniotique. Plusieurs familles d’enzymes ont été mises en évidence dans le liquide amniotique. La diamine-oxydase, enzyme hépatique de dégradation des acides aminés, est présente dans le liquide amniotique à un taux très supérieur à celui observé dans le sang maternel. Sa détection dans le vagin maternel permet ainsi d’affirmer une rupture des membranes. La détection de l’acétylcholinestérase par électrophorèse permet de s’orienter vers un diagnostic d’anomalie de fermeture du tube neural. Le liquide amniotique normal contient des enzymes digestives dont l’évolution dépend de la physiologie digestive fœtale. Ainsi, avant 13 SA le tube digestif est clos, et bien que les entérocytes sécrètent déjà des enzymes digestives, le liquide amniotique n’en contient pas encore. À 13 SA, date de l’ouverture de la membrane anale, les sécrétions accumulées dans le tube digestif inondent le liquide amniotique. Au-delà de 18 SA, les modifications de la composition du méconium et la maturité du sphincter anal interdisent tout nouvel écoulement, les activités des enzymes digestives s’effondrent. Les phospholipides dans le liquide amniotique ont fait l’objet de nombreuses études car ils jouent un rôle majeur dans la composition du surfactant. Un rapport du taux de lécithines sur celui de sphingomyélines supérieur à 2 est associé à une bonne maturation pulmonaire.
L’alfa-1-fœtoprotéine est synthétisée par le foie fœtal. Elle passe dans le sang maternel mais se retrouve à un taux 1 000 fois inférieur à celui du sérum fœtal. Son taux augmente rapidement dans le liquide amniotique lorsqu’un contact existe entre celui-ci et le système circulatoire fœtal, lors par exemple d’une amniocentèse.
De nombreuses hormones sont également présentes dans le liquide amniotique: la prolactine, qui aurait un rôle dans la régulation du volume du liquide amniotique, augmente à partir de 14 SA pour atteindre un plateau de 18 à 28 SA, et diminue ensuite jusqu’à 36 semaines. Les facteurs de croissance, comme l’EGF et l’IGF, sont très nombreux.
Enfin, le liquide amniotique contient des cellules en suspension. Jusqu’à 20 SA, il existe deux principales populations de cellules vivantes : les cellules fibroblastiques et épithéliales (cellules de desquamation amniotique ou cutanée). La quantité de cellules présentes dans le liquide amniotique augmente constamment avec le terme. En revanche, un maximum de cellules vivantes est recueilli entre 16 et 20 semaines. Après 20 SA, les cellules vivantes (nucléées) disparaissent rapidement au profit des cellules de desquamation.
2-Renouvellement du liquide amniotique
Le liquide amniotique se renouvelle en permanence ce qui nécessite des entrées et des sorties: production et réabsorption.
a-Production et réabsorption
-Avant 20semaines
La cavité amniotique apparaît au 7e jour après la fécondation. Au cours des premières semaines, le liquide amniotique est essentiellement un ultrafiltrat du plasma maternel. Entre 10 et 20 SA, sa composition est isotonique au sérum maternel et fœtal. Ceci est lié aux échanges se produisant à travers la peau fœtale, non kératinisée, qui est alors perméable à l’eau, aux électrolytes et aux éléments biochimiques. La kératinisation de la peau débutera vers 20 SA pour s’achever à 25 SA. Dès la fin du 1er trimestre, le rein fœtal est capable de réabsorber le sodium et de sécréter de petites quantités d’urine.
-Après 20 semaines
Plusieurs éléments collaborent à la formation et à l’élimination du liquide amniotique. Les deux principales sources sont la diurèse fœtale et les sécrétions pulmonaires, tandis que les deux principales voies de réabsorption sont la déglutition fœtale et l’absorption dans le sang fœtal à travers la surface fœtale du placenta (voie intramembranaire).
b-Moyens de régulation
Les échanges d’eau entre le liquide amniotique et la mère sont estimés à environ 460mL/h. La relative constance du volume amniotique, pendant la grossesse, malgré un volume d’échanges considérables et de multiples voies de transferts maternofœtaux, témoigne de la remarquable coordination de ses moyens de régulation. ces derniers sont encore mal élucidés.
B-Aspect échographique du liquide amniotique
Échographiquement, le liquide amniotique est anéchogène en première moitié de grossesse, identique au contenu vésical maternel. En deuxième partie de grossesse, il contient de fins échos mobiles, en abondance très variable qui correspondent à des flocons de vernix provenant de la desquamation cutanée.
C-Évaluation quantitative du liquide amniotique
Le volume de liquide amniotique est relativement constant entre 20 et 40 semaines, alors que le poids fœtal passe de 400 à plus de 3 000 g. Le volume maximal de liquide est atteint entre sept mois et sept mois et demi (environ 800 à 1 000 ml). Au voisinage du terme on observe une décroissance absolue et relative du liquide (« oligoamnios physiologique »).
1-Évaluation quantitative « à l’estime »
Cette méthode subjective est le plus souvent suffisante pour reconnaître un liquide normal ou abondant.
1-Évaluation biométrique « objective »
De nombreuses méthodes de mesure ont été proposées.

a-La méthode de de Chamberlain
C’est la première méthode proposée et elle reste la plus utilisée en pratique. On considère que le liquide amniotique est normal si l’on peut trouver au moins une citerne de 1 cm ou plus de profondeur (axe vertical) sous réserve que la largeur soit d’au moins 1 cm. C’est la méthode la plus simple, la plus rapide, et elle est tout aussi subjective et imprécise que les autres. À l’usage, il faut relever la limite à 2 cm en faisant la moyenne de deux diamètres perpendiculaires et exclure le cordon de la mesure.
b-Méthode des « quatre quadrants » de Phelan et Rutherford
Elle consiste à diviser l’utérus en quatre quadrants (centrés par l’ombilic, donc seulement deux quadrants avant 20 semaines). Dans chaque quadrant, on recherche la plus grande citerne dont on mesure la profondeur dans un axe vertical (par rapport au plan de la table d’examen) et l’on fait la somme des quatre valeurs (dont une ou deux peuvent être nulles) qui définit l’index amniotique. La présence du cordon exclut la citerne de la mesure pour certains auteurs, mais d’autres valident la citerne en mesurant le liquide au-dessus ou en dessous de l’image du cordon.

Le placenta
A-Morphologie et structure placentaire normale
Initialement, vers neuf à dix semaines, le futur placenta est un simple épaississement de la paroi ovulaire. En deuxième partie de grossesse, il forme un disque épais qui se moule sur la concavité utérine, de forme semi-lunaire à la coupe, d’échogénicité toujours plus forte que le myomètre.
Le placenta présente une face fœtale, ou plaque choriale, tapissée par l’amnios et sur laquelle peuvent s’observer les vaisseaux issus du cordon. C’est la face qui baigne dans la cavité amniotique et une face utérine, ou face maternelle ou plaque basale, nettement soulignée en fin de grossesse par des calcifications, beaucoup plus floue ou même indiscernable du myomètre au deuxième trimestre. Cette face utérine est séparée du muscle utérin par une couche résiduelle d’endomètre qui constitue la caduque basale. La caduque basale contient un riche réseau veineux de drainage du placenta, mais elle a surtout un rôle majeur de barrière empêchant l’extension du trophoblaste fœtal vers le myomètre maternel et elle constitue le plan de clivage qui permettra le détachement du placenta lors de la délivrance.
La biométrie du placenta n’a que très peu d’intérêt pratique.
Les variations morphologiques sont nombreuses et le plus souvent physiologiques :
-augmentation de l’épaisseur;
-épaisseur diminuée en cas d’excès de liquide ou s’il est anormalement étalé sur une grande surface ;
-cotylédon aberrant ou accessoire nettement séparé de la masse placentaire mais relié par un pédicule vasculaire qui court dans les membranes: risque de rétention après la délivrance, risque de rupture du pédicule en cours de travail si les vaisseaux sont dans l’aire de dilatation (hémorragie de Benckiser) ;
-placenta bifolié, bilobé ou « bipartita » (le cordon s’insère sur les membranes entre les deux masses placentaires ou sur l’une ou l’autre masse) ou placenta annulaire (en anneau plus ou moins complet autour du col) ;
-placenta marginé ou circummarginé défini par la présence sur la plaque choriale d’un anneau blanchâtre, d’épaisseur variable, qui marque l’insertion des membranes sur toute ou partie de la circonférence placentaire ;
-placenta circumvallata (insertion des membranes en dedans du pourtour placentaire) parfois évoqué en échographie sur la présence d’un soulèvement du bord placentaire ou de zones anéchogènes sous-choriales en périphérie (dépôts de fibrine) : habituellement aucune incidence pathologique mais peut-être associé à une pathologie vasculaire utéro-placentaire ;
-placenta fenêtré qui dans sa partie centrale est dépourvu de cotylédon par régression focale des villosités choriales.
B-Évolution de la structure placentaire
Au deuxième trimestre, le placenta présente une structure homogène, avec une échogénicité modérée, un peu plus forte que le myomètre, qui correspond à la masse des villosités fœtales baignant dans un espace sanguin maternel virtuel.
La sénescence (ou maturation) placentaire se traduit par la perte de l’homogénéité du tissu placentaire :
-Les calcifications apparaissent vers sept mois mais le mystère reste entier de savoir pourquoi certains placentas se calcifient abondamment et d’autres pas.
-Les cavernes sont des zones de raréfaction ou de régression villositaire, siégeant au centre de certains cotylédons, mesurant de quelques millimètres à 3-4 cm de diamètre, formant des lacunes anéchogènes à contours irréguliers, en carte géographique, sans renforcement périphérique important.
-Le lac sanguin sous-chorial présente souvent des dilatations (espace vide de villosités) qui apparaissent assez tôt, parfois très importantes en milieu de grossesse, formant une lacune anéchogène sous la plaque choriale, en bande parallèle à la surface placentaire ou sous forme d’une image triangulaire dont le sommet pointe dans un espace intercotylédonnaire, contenant également un flux lent en haute fréquence. L’aspect échographique est parfois impressionnant mais seules les formes très volumineuses nécessitent une surveillance accentuée à la recherche d’un défaut de croissance fœtale.
-Les autres lacunes anéchogènes intra-placentaires peuvent correspondre à des lésions histologiques très diverses, sans gravité le plus souvent, éventuellement suspectes par leur caractère multiple et diffus ; ces images ne contiennent pas de flux sanguin :
-les foyers de dépôts de fibrine avec nécrose villositaire, fréquents sur le plan histologique, rarement associés à une pathologie vasculaire, pouvant siéger n’importe où dans le placenta ;
-les infarctus placentaires (par obstruction d’un vaisseau utéro-placentaire, retrouvés dans un quart des placentas à terme, potentiellement dangereux si volumineux et nombreux) sont d’abord isoéchogènes puis deviennent anéchogènes quand ils sont anciens, formant une lacune préférentiellement basale, parfois entourée de calcifications;
-les thromboses intervilleuses (caillot nodulaire unique ou multiple, dans l’espace intervilleux par rupture villositaire, formé d’un mélange d’hématies fœtales et maternelles, rencontré dans un tiers des placentas à terme) forment une image d’abord hétérogène évoluant vers une lacune anéchogène arrondie avec renforcement périphérique, parfois cloisonnée, et éventuellement vers la résorption du caillot laissant en place une caverne où le sang circule. Fréquentes mais de pathogénie mal connue, elles sont généralement sans conséquences cliniques.
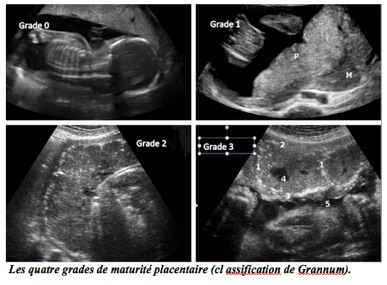
C-La classification de Grannum
Les divers éléments de la sénescence placentaire physiologique ont été regroupés en quatre stades par Grannum mais, à l’usage, cette classification n’a pu être corrélée ni avec la maturité fœtale (pulmonaire en particulier), ni avec la valeur fonctionnelle du placenta :
-grade 0 : structure homogène, plaque choriale lisse, plaque basale à peine visible ;
-grade 1 : rares densifications dispersées, plaque choriale légèrement ondulée ;
-grade 2 : quelques incisures dans la plaque choriale, regroupement des calcifications qui dessinent la plaque basale et des travées intercotylédonnaires ;
-grade 3 : incisures en « brioche » de la face fœtale, calcifications importantes dessinant des cloisons complètes entre la plaque basale et la plaque choriale, creusement de quelques lacunes anéchogènes au centre des cotylédons.
Le grade 3 correspond au processus extrême de vieillissement et s’observe dans 15 % des grossesses au-delà de 36 semaines.
Le cordon ombilical
Sauf en cas d’oligoamnios, le cordon est facilement repéré dans le liquide amniotique, pulsatile, en coupe ou en petits segments en raison de son trajet flexueux. L’utilisation du mode Doppler couleur permet évidemment de gagner du temps pour la localisation du cordon et surtout pour identifier rapidement le meilleur point de mesure, et le meilleur angle, pour la vélocimétrie des artères ombilicales.
Le cordon présente une spiralisation plus ou moins marquée selon les grossesses et cela n’a pas de signification pronostique. Il contient normalement une grosse veine autour de laquelle s’enroulent deux artères parallèles de plus faible calibre, accolées ou séparées de quelques millimètres. La gelée de Wharton qui entoure les vaisseaux est échogène mais souvent peu abondante, soulignant simplement les contours des vaisseaux. Le calibre du cordon, au troisième trimestre, est en moyenne de 15 mm (surface de coupe : 180 mm2). La veine ombilicale mesure 6 à 8 mm de diamètre et les artères 2 à 3 mm. Il est impossible en pratique d’apprécier la longueur du cordon par échographie (en moyenne 50 cm).
L’implantation placentaire est plus facile à repérer sur un placenta antérieur ou latéral. Elle est habituellement centrale. Il est normal d’observer parfois une fusion des deux artères à ce niveau, dans les derniers centimètres : le compte des vaisseaux doit donc se faire en cordon libre ou, mieux encore, à l’implantation abdominale. La recherche de l’implantation sur le placenta est nécessaire pour la cordocentèse ou en cas de placenta bas inséré pour dépister une insertion vélamenteuse.
Le trajet du cordon n’est pas systématisé mais on le retrouve logiquement devant la paroi thoraco-abdominale antérieure et devant la face, entre les membres. Il peut marquer des empreintes trompeuses sur la paroi abdominale ou la face. On observe parfois des manipulations du cordon par les mains fœtales ou des succions.
L’implantation (ou insertion) abdominale doit être étudiée systématiquement pour affirmer l’intégrité de la paroi abdominale.