Malgré les progrès indéniables de la PMA, l’absence de contrôle de l’implantation reste un obstacle majeur au succès de la grossesse. Ces déficits d’implantation peuvent résulter d’une qualité ovocytaire ou embryonnaire médiocre, d’une mauvaise réceptivité endométriale, d’un dysfonctionnement hormonal, immunologique ou angiogénique. Les événements moléculaires intervenant dans l’apposition, l’adhésion puis l’invasion de l’embryon dans l’endomètre maternel sont les sujets d’investigation de nombreux chercheurs.L’implantation de l’embryon reste sans doute la principale difficulté à résoudre en procréation médicalement assistée. En effet, l’obtention in vitro d’un ou plusieurs embryons est dans l’immense majorité des cas rendu possible par les techniques actuelles, alors que l’obtention de grossesses est loin d’être le cas le plus fréquent. L e taux moyen d’implantation des embryons conçus par FIV/ICSI reste faible, 20 % environ et nos moyens d’action pour améliorer ce phénomène restent très limités. Or, le succès de l’implantation embryonnaire est une étape cruciale de la reproduction, naturelle ou assistée. La manière dont le blastocyste s’appose, adhère à l’endomètre maternel tout en dialoguant avec lui et la façon dont le trophoblaste envahit, sans le détruire, le stroma endométrial tout en déjouant les mécanismes immunitaires maternels demeurent les mystères de la reproduction humaine. La réussite du processus dynamique de l’implantation engage deux acteurs principaux : l’endomètre et l’embryon. Résultat d’un dialogue complexe entre l’embryon et l’endomètre, l’implantation va dépendre d’une part de la qualité embryonnaire qui elle-même va dépendre de la qualité ovocytaire et de la qualité des spermatozoïdes, et d’autre part de son acceptation par l’endomètre (qualité endométriale).
La notion de qualité ovocytaire
Même si la qualité ovocytaire est déjà en grande partie prédéterminée par le statut ovarien de la patiente, et qu’elle diminue avec l’âge, il est certain que la stimulation ovarienne a des conséquences sur cette qualité. Les différentes études dont nous avons parlé sont en faveur d’une influence du type de stimulation (plus ou moins forte) sur le statut chromosomique de l’ovocyte confirmé par le taux d’aneuploïdie plus faible des embryons obtenus après une stimulation plus douce. Même s’il n’y a pas encore de preuve certaine, il est également probable que les stimulations ovariennes puissent avoir des conséquences sur le profil épigénétique de l’ovocyte. La notion de qualité d’une tentative d’AMP ne doit pas prendre en compte le nombre total d’ovocytes et d’embryons obtenus, mais le nombre d’ovocytes donnant des embryons aptes à s’implanter, à permettre une grossesse évolutive et la naissance d’enfants bien portants. Ces types d’ovocytes et d’embryons ne sont pas facilement différenciables des autres, mais le fait de stimuler moins, en plus du fait de diminuer les risques d’hyperstimulation de la femme, semble être le garant pour en obtenir un pourcentage plus important. On parle actuellement de « mild stimulation » ou « stimulation douce ».
La notion de qualité embryonnaire
Le succès de l’implantation d’un embryon frais dans la cavité utérine dépend principalement de deux facteurs : la qualité embryonnaire et la réceptivité utérine. Concernant cette notion de qualité embryonnaire, il est bien évident que l’on cherche à transférer les meilleurs embryons pour avoir le plus possible de chances de succès. Les embryons sont sélectionnés au deuxième ou troisième jour après la FIV, avec ou sans ICSI, sur la base de leur apparence morphologique et leur taux de clivage.
Pour pouvoir s’implanter dans l’endomètre maternel, l’embryon doit se développer de façon adéquate jusqu’au stade blastocyste. Cela implique un développement folliculaire adéquat, l’ovulation d’un ovocyte mature, la fécondation par un spermatozoïde de morphologie normale à l’ADN peu fragmenté et un développement embryonnaire précoce harmonieux. La sélection des embryons à haut potentiel implantatoire est un défi important en PMA, à la fois pour augmenter les taux de grossesse, mais aussi pour éviter la cryopréservation massive d’embryons non viables. Bien que la meilleure méthode d’évaluation de la viabilité d’un embryon soit sa capacité à s’implanter, l’observation du développement de l’embryon in vitro a permis d’obtenir d’importantes informations à son sujet, tout en restant indépendant de l’influence non négligeable du milieu utérin. Ces dernières années, des critères morphologiques ont été développés et évalués pour identifier les embryons à haut potentiel implantatoire.
Le taux de succès est pour beaucoup lié au choix « visuel » des embryons transférés. Ce qui implique un suivi biologique attentif. Il n’existe malheureusement pas de classification standardisée de la qualité des embryons.
Au stade de zygote, il est possible, dès 24 à 48 heures après la fécondation, d’observer certains éléments prédictifs du potentiel de développement. Deux classifications ont ainsi été proposées sur la base de l’aspect morphologique, de la localisation des pronuclei et de l’apparence du cytoplasme :
-La classification de Scott et Smith date de 1998 et prend en compte la position des corpuscules nucléolaires précurseurs (Nucleoli precursor Body= NPB), l’existence d’un halo cytoplasmique et la progression au stade deux blastomères 24 à 26 heures après la fécondation.
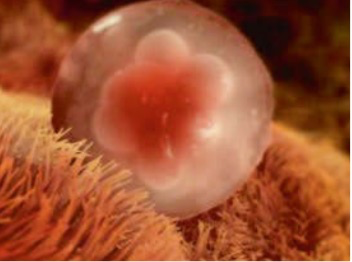
-La classification de Tesarik (1999) et Greco considère le nombre et la distribution des NPB (Fig.1).

Au stade d’embryon segmenté, deuxième ou troisième jour, on peut évaluer :
-le clivage embryonnaire, et en pratique un embryon de bonne qualité dispose d’au moins 4 cellules à J2 et au moins 8 cellules à J3 ;
-la morphologie des blastomères et le taux de fragmentation cytoplasmique : il existe une relation inverse entre le degré de fragmentation extracellulaire et le potentiel implantatoire des embryons. Les embryons de bonne qualité ont une absence ou un faible taux de fragmentation (Fig.2);
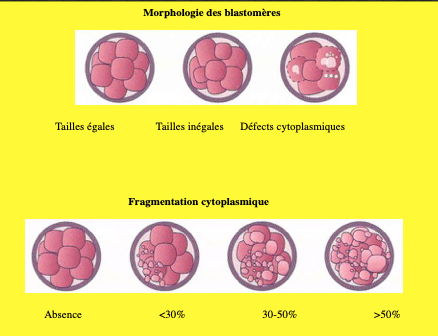
-la multinucléation : bien que les embryons comportant des blastomères multinucléés soient susceptibles de s’implanter, le taux de réussite est beaucoup plus bas que celui des embryons à blastomères multinucléés.
De manière générale, les embryons à 2 cellules en fin de jour 1, à 4-5 cellules au jour 2 et à minimum 7 cellules au jour 3, qui ne présentent pas plus de 20 % de fragmentation et qui n’ont aucun blastomère multinucléé sont considérés comme étant des embryons à haut potentiel implantatoire (top quality embryo).
L’endomètre, ce mal connu
Le concept de fenêtre implantatoire
On peut dire que d’une façon habituelle, l’endomètre est réfractaire à toute implantation et a pour simple mission de se défendre de toute infection et/ou agression extérieure, y compris à l’arrivée d’un embryon. Réfractaire, oui, sauf pendant une courte période d’environ 4 jours (jours 20-24 du cycle menstruel normal soit de LH+7 à LH+11. On appelle cette courte période la fenêtre implantatoire.
Le concept de tolérance maternelle
Le concept de tolérance maternofœtale est en fait un dialogue maternofœtal qui s’instaure dès les premiers moments de la vie, l’embryon étant au centre d’une «mer de cytokines». Alors que les cellules classiques de l’immunité à médiation humorale (principalement les lymphocytes B) semblent fuir l’endomètre au moment de la fécondation, d’autres cellules immunitaires appartenant préférentiellement à l’immunité innée affluent . Les nouveaux arrivants sont principalement des cellules utérines natural killer (uNK) spécialisées et un remodelage de la paroi des artères spiralées. Les cellules uNK sont le pivot du processus implantatoire, leur mobilisation théorique a lieu au moment de la fenêtre implantatoire.
Les pinopodes
Protrusions apicales des cellules épithéliales de l’endomètre, ils apparaissent entre les jours 19 et 21 d’un cycle normal (Fig. 1). Ouvrant la fenêtre implantatoire, ils ne seraient pas présents pendant toute sa durée, bien que cela soit actuellement controversé. Leur présence est strictement contrôlée par la progestérone. La corrélation entre le moment d’apparition des pinopodes dans le cycle et la fenêtre implantatoire, leur localisation spatiale à la surface luminale de l’endomètre, et les études in vitro ayant révélé leurs interactions avec l’embryon, sont autant d’arguments en faveur d’un rôle de ces structures dans la réceptivité endométriale. Cependant, la variabilité d’apparition de ceux-ci d’un cycle à l’autre et la nécessité de réaliser des biopsies dans la fenêtre implantatoire pour recourir à la microscopie électronique limitent la possibilité de leur exploration en clinique courante.

Les molécules d’adhésion
Les interactions cellule-cellule et cellule-matrice extracellulaire jouent un rôle primordial dans la cascade d’évènements conduisant à l’implantation et au développement normal de l’embryon puis du fœtus au cours de la grossesse. L’implantation requiert l’établissement de contacts étroits entre les deux pôles apicaux des cellules épithéliales trophoblastiques et endométriales, ce qui représente un véritable paradoxe biologique. Les molécules d’adhésion sont exprimées avec une variation spatio-temporelle sur l’épithélium et le stroma endométriaux, sur l’embryon et le trophoblaste. En tant que médiateurs de l’attachement cellulaire et de la transduction, leur expression variable au cours du temps est peut-être une clé pour la compréhension de la réceptivité utérine. Nous ne ferons que citer les principales: intégrines, αvβ3, L-selectine, mucines,cytokines.
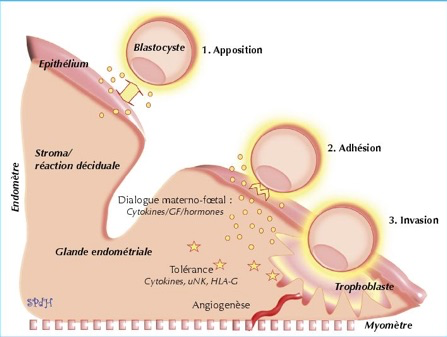
L’apposition
Cette phase initiale est instable, résultant de l’interrelation entre le trophoblaste et l’épithélium endométrial. A ce stade, le blastocyste entre dans la proximité directe de l’endomètre, permettant aux médiateurs solubles comme l’hCG, les cytokines et les facteurs de croissance d’établir un dialogue à l’interface materno-fœtale. Il se produit également à ce moment la présentation d’un répertoire unique de molécules d’adhésion à la surface à la fois des cellules maternelles et fœtales, étape indispensable à la phase d’adhésion du trophectoderme à l’épithélium endométrial.
L’adhésion
Cette phase implique des connexions physiques entre le trophoblaste et l’endomètre, par l’intermédiaire de molécules d’adhésion comme les sélectines, les intégrines et les trophinines.
L’invasion et le développement trophoblastique
Au cours de cette étape, le syncytiotrophoblaste se forme et va envahir le tissu maternel. Le fœtus et la mère contribuent à l’organisation structurelle du placenta, un organe nouvellement formé qui joue un rôle clé dans la progression régulière de la grossesse jusqu’à terme.
Les effets de la stimulation sur l’endomètre
Il est désormais admis que la stimulation ovarienne et les fortes doses de FSH administrées ont des effets néfastes sur l’endomètre : les taux supraphysiologiques d’estradiol et de progestérone sont responsables de modifications morphologiques et biochimiques, d’altérations de l’expression de nombreux gènes liés à l’implantation et de dérégulations de l’expression de miRNA et mRNA. De tels changements affectent la synchronisation entre l’embryon et l’endomètre, diminuant alors l’implantation. Cette hyperestradiolémie risque d’augmenter la contractilité utérine, diminuant là encore les chances d’implan- tation.
Comment agir sur l’implantation?
Il faut bien reconnaître qu’actuellement nos moyens d’action pour influencer favorablement le phénomène d’implantation embryonnaire sont très limités, voire rudimentaires. Il faut de plus garder en mémoire le fait que les chances d’implantation diminuent avec l’âge. Il est, tous cas confondus, lorsque l’on transfère après 2 jours de culture, de 15 % entre 25 et 30 ans et de 7 % à 40 ans. Du fait que l’on transfère généralement, dans ce cas, plusieurs embryons simultanément, le taux de grossesses par transfert peut donc varier donc lui aussi de 30 % à 25 – 30 ans jusqu’à 15 % à 40 ans.
Prolonger la culture des embryons jusqu’au stade de blastocyste
Tous cas confondus, il y a échec de nidation pour90 % des embryons transférés au 2ème jour de culture. Autrement dit, 10 % seulement d’entre eux se nident, Ce pourcentage définit ce que l’on appelle le taux de nidation. Mais si l’on a sélectionné les embryons viables par la culture prolongée, ce taux de nidation est d’environ 20 %.
Comme on transfère plusieurs embryons simultanément, le taux de grossesses par transfert est, bien entendu, supérieur à 10 % (ce qui serait le cas si on n’en transférait qu’un). Il est en moyenne de 25 % avec un transfert au bout de 2 jours de culture et il est de 30 % en cas de culture prolongée.
Intérêt de l’échographie
L’accessibilité de l’endomètre par l’échographie transvaginale ont amené les cliniciens à se demander si le pronostic d’un cycle de FIV peut être corrélé à l’aspect ou à l’épaisseur de l’endomètre.
On a individualisé 3 types échographiques de l’endomètre:
Type A: Un endomètre entièrement hyperechogène et homogène.
Type B: Un type intermédiaire caractérisé par la même échogénicité que le myomètre.
Type C: Un endomètre pluristratifié dit aussi en » triple ligne » dit aussi en grain de café, caractérisé par 3 lignes hyperechogènes (externe, moyenne et interne), délimitant deux zones hypoéchogènes cet aspect est également dénommé 5 bandes. C’est ce type en triple ligne ou 5 zones qui serait logiquement le plus favorable ou » l’endomètre adéquat « . Il a été décrit comme étant l’aspect échographique typique de la phase proliférative de l’endomètre au cours des cycles naturels. La ligne centrale hyperéchogène correspond au » canal » endométrial. Cependant, la littérature se compose d’articles mettant en évidence un rôle pronostic de l’aspect échographique de l’endomètre et d’autre infirmant cette hypothèse.
Concernant l’épaisseur de cet endomètre, il semble que les meilleures chances d’implantation sont très faibles en-dessous de 6 à 8mm. Elles semblent optimales entre 8 et 14mm et redeviennent faibles au-delà de 15mm.
Il est bien tentant d’imaginer que l’on puisse adapter la politique de transfert et de cryoconservation d’embryon à des facteurs pronostics (afin d’éviter la perte de plusieurs embryons dans des cycles de mauvais pronostic). L’aspect échographique de l’endomètre est un des candidats possible. Mais il n’existe pas encore dans la littérature de preuve du bien fondé de cette attitude. Par ailleurs de nombreuses questions restent encore sans réponse: le lien entre les traitements de stimulation et cet aspect échographique, ainsi que la possibilité ou non « d’améliorer » l’état de la muqueuse au cours d’un cycle ou lors des suivants. En particulier, il faut observer que L’endomètre, en phase folliculaire, se développe sous l’action des estrogènes. Néanmoins, les taux supra-physiologiques des estrogènes observés en FIV ne semblent pas améliorer la qualité endométriale par rapport aux taux bien moindres observés en cycle spontané naturel. Néanmoins dans certaines études, un taux de grossesse de 20 % a été rapporté avec les endomètres < 6 mm, ce qui semble suggérer qu’il n’y a pas de limite inférieure absolue pour l’implantation embryonnaire. De plus, une série rétrospective européenne n’a pas retrouvé de corrélation entre épaisseur endométriale et taux de grossesse.
Certains auteurs rapportaient l’utilisation des thérapies adjuvantes susceptibles d’améliorer la réceptivité endométriale dans les cas spécifiques (endomètres fins ou après irradiation). Ces thérapies médicamenteuses (sildénafil, estrogène vaginal, aspirine et autres) sont encore utilisées empiriquement et, pour l’instant, aucune large étude randomisée n’a évalué leur utilité
Il reste qu’au moment de l’injection d’HCG, l’endomètre doit présenter un aspect 3 couches, dit aussi en cible. L’hyperéchogénicité précoce que l’on observe parfois avant le déclenchement est généralement de mauvais pronostic, témoignant d’une élévation prématurée de la progestérone ou d’un effet délétère des androgènes libérés par la stimulation ovarienne. Seul l’aspect de l’endomètre avant l’injection d’HCG doit être pris en compte. Le jour du transfert embryonnaire l’aspect de l’endomètre n’a aucune valeur prédictive puisque celui-ci est toujours hyperéchogène.
Certains scores ont été proposés, tenant compte de l’aspect échographique de l’endomètre et du doppler des artères utérines de façon à adapter le nombre d’embryons à transférer voire, en cas de mauvais score, à proposer une congélation embryonnaire pour effectuer un transfert ultérieurement dans de meilleures conditions.
Ces modèles échographiques ne tiennent compte d’aucune interaction entre les 2 composantes maternelle et foetale, alors que l’on sait qu’il existe un dialogue entre l’endomètre et l’embryon. De plus, quand on réimplante plusieurs embryons, on ne sait pas si les différents embryons n’interagissent pas entre eux.
Rôle des hydrosalpinx
Les hydrosalpinx ont en effet des conséquences néfastes sur l’implantation, en raison de leur embryotoxicité et des mécanismes de flushing embryonnaire extra-utérin engendrés par le liquide tubaire accumulé. D’un point de vue moléculaire, il semble que l’expression du LIF (Leukemia Inhibitory Factor), cytokine nécessaire à l’implantation, soit anormalement diminuée en cas d’hydrosalpinx, son expression pouvant être restaurée en cas de salpingectomie ou de ligature proximale. Ainsi, les patientes présentant des hydrosalpinx ont bien des taux de grossesse et d’implantation diminués et la salpingectomie reste le traitement de référence.
L’hygiène de vie
Tout bilan d’échec d’implantation doit prendre en compte l’hygiène de vie des patients, particulière- ment les facteurs d’obésité et le tabac. L’impact négatif de l’obésité maternelle sur les taux de succès en FIV est largement admis, mais l’obésité n’est pas en elle-même une cause d’échec d’implantation.
Le tabac est, lui aussi, un facteur péjoratif d’implantation. Les effets néfastes de la cigarette se ressentent également chez les fumeuses passives.
La fonction thyroïdienne
Il semble qu’une dysfonction thyroïdienne puisse perturber l’implantation : on a retrouvé un risque de fausses couches deux fois plus important chez les patientes présentant une thyroïdite auto-immune (présence d’anti- corps antiperoxydase ou antithyroglobuline). Il est donc primordial de contrôler cette fonction devant un échec d’implantation.
Intérêt de l’hystéroscopie
Bien entendu, un bilan par hystéroscopie diagnostique, effectuée en consultation, sans anesthésie et sans hospitalisation est généralement réalisé, permettant d’éliminer de discrètes anomalies endométriales comme un petit polype non visible à l’échographie, un petit myome sous-muqueux, une malformation utérine, une synéchie ou une endométrite. Une biopsie d’endomètre est parfois réalisée. Tous ces éléments peuvent entraver la bonne implantation de l’œuf. Mais malgré cela il existe toujours des échecs de nidation.
Intérêt de la biopsie d’endomètre
La fiabilité de la biopsie endométriale dans le diagnostic de l’insuffisance lutéale est un sujet de controverse depuis de nombreuses années. Elle doit se faire en deuxième partie de cycle. Les uns prétendent que le retard de maturation sur une biopsie n’est pas le reflet d’une insuffisance lutéale car il n’y a aucune corrélation avec les dosages sériées de progestérone. De plus la fréquence d’insuffisance lutéale dépistée par une biopsie est presque comparable dans une population fertile et infertile et le traitement de ces cas d’insuffisance lutéale diagnostiquée sur une biopsie ne donne pas de taux de grossesse plus élevé que chez les femmes non traitées. Les autres prétendent que la biopsie est le meilleur moyen pour évaluer la maturation endométriale et détecter une possible insuffisance lutéale.
Pour la recherche d’une endométrite, la biopsie peut se faire n’importe quand dans le cycle à l’exception de la période prémenstruelle ou existe une infiltration lymphocytaire physiologique.
Enfin cette biopsie pourrait permettre d’évaluer l’avance de la maturation endométriale dans les cycles de FIV et ainsi sélectionner un groupe de femmes chez lesquelles il serait inutile de transférer l’embryon et pour lesquelles il serait préférable de congeler les embryons et de les replacer lors d’un cycle ultérieur à un moment où la réceptivité de l’endomètre serait meilleure.
Agresser l’endomètre ?
Certaines études sembleraient montrer qu’une agression endométriale type biopsie d’endomètre réalisée au moment de la fenêtre d’implantation entre J20 et J23 du cycle spontané qui précède une tentative de FIV pourrait améliorer les chances d’implantation. La réponse inflammatoire liée à la biopsie faciliterait la préparation de l’endomètre à l’implantation.
Il reste cependant de nombreuses questions non résolues tant au plan clinique (sélection des patientes, technique, timing et nombre de biopsies) que fondamental pour mieux comprendre les mécanismes d’action et par là mieux sélectionner les patientes.
Rôle et dosage de la progestéronémie (d’après: Progestérone en stimulation ovarienne contrôlée pour FIV : la face cachée.
S. HAMAMAH, C. BRUNET, Centre d’AMP/DPI, INSERM U 847, Hôpital Arnaud de Villeneuve, Montpellier)
La progestérone est fabriquée dans les cellules de la granulosa et de la thèque interne à partir du cholestérol via la voie delta 4 de la chaîne de biosynthèse des stéroïdes :
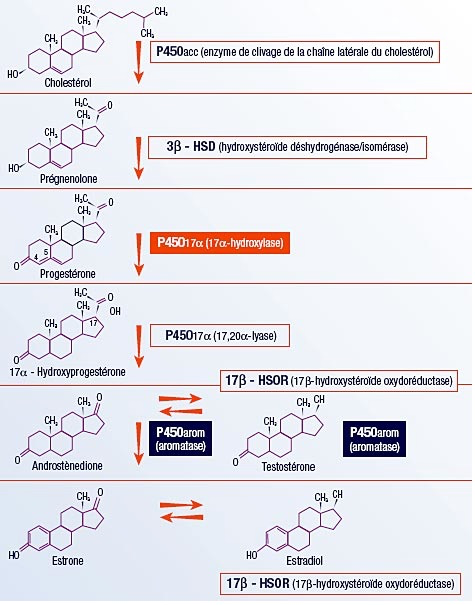
Cette synthèse de progestérone est FSH-dépendante, mais sa transformation en androgènes (androstènedione) est sous la dépendance de la LH. En effet, au cours de la première partie de la phase folliculaire, la LH agit sur les cellules de la thèque interne qui expriment constitutivement à leur surface le récepteur LH/hCG-R et stimule un complexe hydroxylase- lyase, capable de convertir la progestérone en androgènes (4). Les androgènes ainsi synthétisés peuvent être actifs tels quels ou bien après conversion en estrogènes via une aromatase FSH-dépendante au sein de la granulosa .
Selon la théorie bicellulaire, FSH et LH jouent un rôle primordial dans la stéroïdogenèse. Les deux gonadotrophines ont deux actions complémentaires sur la maturation ovocytaire et la croissance folliculaire, médiées par la progestérone :
– au niveau des cellules de la granulosa et, sous l’influence de la FSH, la progestérone est synthétisée à partir du cholestérol, mais ne peut être transformée en androgènes ;
– cette transformation nécessite l’intervention des cellules thécales, au sein desquelles, sous l’influence de la LH, la progestérone synthétisée à partir du cholestérol peut être transformée en androgènes, eux-mêmes précurseurs des estrogènes.
En phase folliculaire, plus les taux de LH sont faibles, plus les taux de progestérone seront élevés. En phase lutéale, la production de la progestérone est assurée par les cellules lutéales du corps jaune. Des travaux menés sur des modèles animaux ont montré que, à concentration égale, l’hCG induit une production de progestérone plus élevée dans les cellules lutéales que la LH(7, 8) en raison d’une demi-vie plus longue et d’une affinité plus importante pour le récepteur commun LH/hCG-R. Les effets biologiques de ces hormones sont regroupés sous l’appellation « activité LH ».
Chez la femme, la progestérone est un régulateur primordial des événements qui conduisent au démarrage (implantation embryonnaire) puis au maintien de la grossesse. La progestérone agit également comme un « immuno-stéroïde » en participant à la constitution d’un environnement « immunoprotecteur » pour le foetus, protégeant l’allogreffe. La progestérone, via son récepteur, est capable d’activer des gènes qui contribuent à la régulation du cycle cellulaire, à la prolifération, à la différenciation ou à l’invasion, tous ces phénomènes qui préparent l’endomètre à l’implantation. De plus, les cibles de la progestérone sont impliquées dans les processus qui créent un environnement cytokinique favorable au développement du foetus. Aujourd’hui, on connaît de nombreux médiateurs et voies de signalisation, mais récepteurs et voies de transduction du signal de la progestérone ne sont pas encore identifiés.
Effectué en seconde partie du cycle, le dosage sérique de la progestérone témoigne de la sécrétion et de la fonctionnalité du corps jaune. Une concentration de progestérone normale permet d’affirmer qu’il y a ovulation, sans préjuger cependant de la qualité ovocytaire. Lors d’une stimulation ovarienne, le dosage de la progestérone pourra être effectué en fin de phase folliculaire (jour du déclenchement) et à J21/J22 du cycle stimulé.
La progestéronémie doit être supérieure à 10 ng/ml en milieu de phase lutéale, et inférieure à 3 ng/ml en fin de phase folliculaire. Si le taux de progestéronémie est trop élevé en fin de phase folliculaire, une annulation du cycle pourra être décidée en raison d’un effet délétère sur la fenêtre d’implantation.
Au contraire, une concentration de progestérone trop faible en fin de phase lutéale pourra motiver la modification de la posologie du traitement sur un prochain cycle.
L’association entre les concentrations sériques d’estradiol, de progestérone et de LH au cours de la phase folliculaire d’une hyperstimulation contrôlée et la survenue d’une grossesse, suscite l’intérêt depuis de nombreuses années. Certains auteurs n’ont pas observé d’impact des taux de progestérone lors du déclenchement sur les taux de succès en FIV, mais le seuil choisi pour définir une progestéronémie élevée était proche de 1 ng/ml : 0,4-0,9 ng/ml, 0,9 ng/ml ), 1,0-1,1 ng/ml, 1,2 ng/ml.
Mais d’autres auteurs estiment ce seuil de 1 ng/ml trop faible pour que puisse être mesuré un impact délétère d’une élévation de la progestéronémie (18,19,20). En effet, il a été observé un fort impact délétère de la progestérone sur les taux de succès lorsque le seuil de 3,4 ng/ml(1) ou de 4 nmol/l est franchi. Dans l’étude MERiT qui comparait les taux de grossesses en FIV sous HP-hMG vs r-FSH, le dosage sérique de la progestérone a été effectué au 6e jour de la stimulation (J6), le jour du déclenchement et le jour de la ponction. Si ces taux étaient équivalents dans les deux bras à J6, les taux sériques de progestérone observés dans le groupe r-FSH étaient plus élevés que dans le groupe HPhMG le dernier jour de la stimulation (3,4 ± 1,7 nmol/l sous r-FSH vs 2,6 ± 1,3 sous HPhMG, p < 0,001) et lors de la ponction ovocytaire (36,3 ± 25,0 nmol/l sous r-FSH vs 24,5 ± 15,6 sous hMG, p < 0,001). Ces taux de progestérone sérique le jour du déclenchement restaient par ailleurs plus élevés dans le bras r-FSH que dans le bras HP-hMG après ajustement sur le nombre de follicules (+ 28 % dans le bras r-FSH) et le jour de la ponction ovocytaire après ajustement sur le nombre de follicules ponctionnés (+ 29 % dans le bras r-FSH). Ainsi, le jour du déclenchement, 23 % des patientes sous r-FSH présentaient des taux sériques de progestérone supérieurs à 4 nmol/l contre 11 % dans le bras hMG.
Ces élévations de progestéronémie sous r-FSH étaient corrélées à un endomètre significativement plus hyperéchogène (p = 0,001), un taux de grossesses évolutives par cycle et un taux d’implantation significativement plus faibles (respectivement p = 0,035 et p = 0,025). Ces résultats ont été récemment confirmés par ceux d’une cohorte de 4 032 cycles de stimulation suivis entre 2003 et 2007 par l’équipe de Bosch et coll. L’analyse des dosages de la progestérone sérique, systématiquement effectués le jour du déclenchement, a montré que le taux de grossesses évolutives diminue parallèlement à l’élévation des taux de progestérone.
Peu importe le protocole de stimulation ovarienne contrôlée (agonistes ou antagonistes de la GnRH), on observe une valeur pronostique négative de taux élevés de progestérone. Le seuil de progestérone sérique au-delà duquel les taux de grossesses évolutives chutent est de 1,5 ng/ml. Par ailleurs, l’analyse multivariée a montré que les deux variables les plus associées à des taux de progestérone sérique > 1,5 ng/ml étaient la dose de FSH utilisée et le nombre d’ovocytes récupérés .
Facteurs génétiques
Les anomalies chromosomiques observées dans l’embryon préimplantatoire peuvent être des anomalies de nombre ou de structure. L’embryon est aneuploïde en cas d’addition (trisomie) ou de délétion (monosomie) d’un chromosome, ou mosaïque s’il est constitué de plusieurs lignées cellulaires de contenus chromo- somiques différents. Il est rapporté que l’aneuploïdie concerne près de 53,8 % des blastocystes des patientes en échec d’implantation.
Harper a été le premier à montrer en 1995 par FISH (Fluorescent in- situ hybridization) que les aneuploïdies de l’embryon précoce étaient dues soit à des erreurs méiotiques soit à des erreurs postzygotiques.
La survenue d’erreurs méiotiques, principalement d’origine maternelle, augmente avec l’âge et entraîne un surrisque d’échec d’implantation ou de FCS. Ces erreurs sont dues à une non-disjonction méiotique (MND), ou plus fréquemment à une sépa- ration prématurée des chromatides sœurs (PSSC).
La contribution paternelle aux aneuploïdies embryonnaires n’est cependant pas nulle : des anomalies du centrosome transmises par le spermatozoïde peuvent être à l’origine des mosaïques chaotiques embryonnaires obser- vées en FIV. Également, la survenue d’altérations lors des étapes de remodelage de la chro- matine spermatique augmente la fréquence des aneuploïdies observées dans les embryons fécondés à partir de spermes OAT sévères.
Des anomalies postzygotiques peuvent survenir de façon aléa- toire au cours des mitoses (prin- cipalement les 3 premières) et donner lieu à des embryons chaotiques dont le développement se bloque le plus souvent en période pré ou postimplantatoire. Au-delà des contributions méiotique et mitotique, certains facteurs cliniques peuvent influencer la survenue d’aneu- ploïdies embryonnaires : les pathologies comme le syndrome des ovaires polykystiques (SOPK), l’endométriose ou l’insuffisance ovarienne souvent associées à une qualité ovocytaire moindre ; la stimulation ovarienne et la maturation in vitro (MIV) peuvent augmenter les taux d’aneuploïdies.
Face à la survenue des aneuploïdies embryonnaires, des mécanismes de réparation sont mis en place, notamment l’activation de p53 qui permet l’apoptose des blastomères anormaux. Cette autocorrection est observée aux stades tardifs du développement préimplantatoire. En effet, Munne a étudié le développe- ment de 145 embryons aneu- ploïdes à J3 (FISH) et a montré que, parmi les 55 d’entre eux ayant évolué jusqu’au stade blastocyste, 18 se sont « normalisés ».
La fréquence élevée des aneuploïdies de l’embryon préimplantatoire, notamment en cas d’échec d’implantation, amène à contrôler les caryotypes des deux membres du couple, même si un caryotype normal n’exclut pas la production de gamètes aneuploïdes. L’analyse des caryotypes des 2 membres du couple en cas d’échec d’implantation est devenue une pratique courante. La FISH sur sperme peut également apporter des éléments de réponse car l’incidence des d’échecs d’implantation ou des FCS à répétition se révèle être plus élevée en cas d’anomalies chromosomiques spermatiques.
Devant un échec d’implantation, faut-il systématiquement rechercher la présence d’aneuploïdies embryonnaires par le screening génétique préimplantatoire (PGS) ? Il a été montré que la morphologie embryonnaire n’est pas corrélée au taux d’aneuploïdies.
Le PGS n’est actuellement pas autorisé en France, mais il est largement pratiqué dans les pays anglo-saxons. Il consiste en l’étude du contenu chromosomique d’un ou plusieurs blastomères afin de distinguer les embryons aneuploïdes des embryons euploïdes alors sélectionnés pour le transfert. Les premiers PGS ont été réalisés par FISH sur embryon précoce avec analyse d’un nombre restreint de chromosomes. Depuis, les tech- niques ont évolué vers l’analyse du blastocyste, en particulier des cellules du trophectoderme, par CCS (Comprehesive Chromosome Screening) permettant l’analyse complète des chromosomes soit par mCGH (metaphase compa- rative genomic hybridization), aCGH (array comparative genomic hybridization), SNP (single nucleotide polymorphism micro array), qPCR (quantitative polymerase chain reaction) ou plus récemment par NGS (next-generation sequencing).
Les indications actuelles du PGS sont l’âge maternel avancé (AMA), les FCS à répétition, l’infertilité masculine sévère, ainsi que les échecs répétés d’implantation. La métaanalyse de Dahdouh n’a cependant pas retrouvé d’intérêt à pratiquer un PGS en cas d’échec d’implantation puisque les taux de naissances vivantes étaient significativement diminués dans le groupe des couples en échec d’implantation comparativement au groupe contrôle, probablement en raison des effets délétères de la biopsie et de l’absence de screening complet des chro- mosomes pour la plupart des études prises en compte (FISH uniquement).
A contrario, Greco a montré par CGH array l’intérêt du PGS chez les couples en échec d’implantation puisqu’il a rapporté des taux de grossesses et d’implantation respectivement de 68,3 % et 68,3 % après transfert d’un blastocyste euploïde dans le groupe RIF-PGS vs 22,0 % et 21,2 % dans le groupe RIF-NO PGS. Pagidas a montré qu’après un échec d’implantation malgré le transfert d’un blastocyste euploïde lors d’un premier cycle de PGS, la présence d’embryons euploïdes au second ou troisième cycles de PGS est toujours asso- ciée à des taux de grossesses et d’implantation élevés
Facteurs spermatiques
La contribution paternelle au potentiel implantatoire de l’embryon doit faire l’objet d’explorations en cas d’échecs d’implantation. De nombreux auteurs ont suggéré qu’une baisse de la qualité du sperme pouvait dimi- nuer les chances de succès des techniques d’AMP en particulier, via une compaction anormale de la chromatine ou encore une frag- mentation élevée de l’ADN spermatique. Une importante fragmentation de l’ADN spermatique peut affecter le dévelop- pement de l’embryon après activation du génome paternel, à savoir dès J3, et conduire à un échec d’implantation. Il a été rapporté que 28 % des hommes infertiles présentent un taux de fragmentation élevé contre 13 % pour les hommes fertiles (Practice Committee of ASRM, 2008). Avendano a montré qu’un spermatozoïde de morphologie normale pouvait néanmoins avoir un taux de fragmentation élevé. Son étude a aussi montré que le taux de fragmentation était plus élevé chez les partenaires de femmes en échec d’implantation comparativement à ceux de femmes qui ont réussi à conce- voir (33,8 % vs 18,9 %).
L’embryoglue: un moyen d’améliorer l’implantation?
Depuis quelques années on s’attache à rechercher des moyens d’améliorer les taux d’implantation, cette dernière étant un des maillons faibles de la fécondation in vitro.
Un domaine de recherche s’est concentré sur le milieu dans lequel les embryons sont transférés dans l’utérus. Des composés d’adhérence ont été ajoutéas au milieu de transfert embryonnaire dans les tentatives d’augmenter la chance de l’embryon adhérant à l’utérus, avec une plus grande chance de grossesse et la naissance d’un nouveau-né en bonne santé en conséquence. Parmi ces produits, l’Embryoglue est utilisé par certains centres.
EmbryoGlue a la composition de base d’un milieu de culture de blastocyste riche et contient une concentration élevée d’acide hyaluronique et d’albumine humaine recombinante. Il peut être utilisé pour le transfert de tous les stades de développement de l’embryon, y compris les blastocystes après incubation assistée, biopsie et cryoconservation.
La Cochrane Data Base rapporte la meta-analyse de 17 essais cliniques randomisés (3898 participants) dans lesquels les chercheurs ont comparé le transfert d’embryons dans un milieu contenant un acide hyaluronique élevé par rapport à un faible ou aucun acide et dans un milieu contenant du mastic de fibrine par rapport au transfert dans un milieu sans agent d’étanchéité de fibrine. Les résultats rapportés comprenaient les taux de naissances vivantes, les taux de grossesses cliniques, les taux d’implantation, les taux de grossesses multiples et d’autres événements indésirables. L’analyse des 16 études a montré une augmentation des chances de grossesse et de naissances vivantes (450 vs 367 pour 1000), mais aussi une augmentation du risque de grossesse multiple (282 vs 175 Pour 1000). Cette augmentation du taux de grossesses multiples peut être le résultat d’une amélioration des résultatsdue à l’addition du composé d’adhérence mais aussi à la politique consistant à transférer plus d’un embryon dans l’utérus, ce qui empêche toute conclusion. Les résultats obtenus pour ces comparaisons étaient de qualité moyenne. Il est important de noter que la preuve d’un taux d’administration plus élevé n’a pas été trouvée dans toutes les analyses; cependant, il a été trouvé dans la méta-analyse globale. D’après l’étude unique qui a utilisé le scellant de fibrine, aucune preuve n’indique que l’ajout de ce composé à un milieu de transfert embryonnaire a amélioré les résultats de la grossesse.
Des études plus poussées sur les composés d’adhérence avec un seul transfert d’embryon doivent être entreprises.