Généralités sur les protocoles de stimulation pour FIV
Le but des traitements de stimulation de l’ovulation est donc d’obtenir, chez une femme normo-ovulante, un développement pluri-folliculaire, c’est à dire entre 5 et 10 follicules, dans l’espoir de recueillir entre 3 et 8 ovocytes en moyenne. Pour cela, il faut utiliser des médicaments appelés gonadotrophines. Le choix du protocole de stimulation ovarienne doit être adapté à chaque patiente, en vue d’obtenir la meilleure folliculogenèse possible . Il dépend de plusieurs facteurs :
– la réserve ovarienne;
– l’âge;
– l’indice de masse corporelle;
– les éventuelles réponses antérieures;
– le statut endométrial;
– la consommation de tabac;
– les antécédents ou notions d’ovaires polykystiques.
Cela justifie donc la nécessité d’effectuer un bilan complet avant toute stimulation.
On distingue deux grands types de protocoles de stimulation pour FIV : les protocoles avec agonistes et les protocoles avec antagonistes. Cela nécessite quelques explications préalables.
Le but de la stimulation pour FIV est :
1- de stimuler les ovaires de façons suffisamment énergique pour obtenir la croissance de plusieurs follicules, c’est-à-dire d’une poly-ovulation (stimulation dite multi folliculaire) grâce à une FSH naturelle ou recombinante ;
2- tout en évitant la survenue d’une ovulation spontanée précoce avant qu’on ait eu le temps de déclencher l’ovulation et de récupérer, par ponction, les précieux follicules, cela par l’utilisation de produits agonistes ou antagonistes.
3-Puis de déclencher l’ovulation lorsque les follicules sont mûrs, par l’injection de 5000UI d’HCG.
Si la stimulation fait toujours appel à des gonadotrophines (à effet FSH comme le Purégon® ou le Gonal-F® ), l’empêchement d’une ovulation spontanée peut être obtenue soit par les agonistes soit par les antagonistes de l’hormone hypothalamique LH-RH. C’est la substitution de certains acides aminés dans la molécule de LH-RH qui est à l’origine d’analogues de la LH-RH dont les effets biologiques sont différents de la molécule naturelle et sont soit agonistes soit antagonistes. C’est le choix de ce type de produit qui va définir le type du protocole : soit protocole agoniste, soit protocole antagoniste.
La stimulation ovarienne
Les gonadotrophines ont été pendant de nombreuses années obtenues par purification à partir d’urines de femmes ménopausées (HMG). Le développement des technologies de génie génétique a permis d’obtenir des molécules recombinantes (follitropine α, Gonal-F® et follitropine β, Puregon®) qui offrent plusieurs avantages. Elles permettent une meilleure traçabilité, elles évitent les difficultés liées à la collecte des urines, elles sont une alternative bienvenue aux produits d’origine humaine, les produits injectés sont plus purs du fait de l’absence de protéines parasites et la variabilité entre les différents lots est plus faible. De plus, elles sont toutes injectables par voie sous-cutanée. Cependant, ces avancées se sont faites au prix d’un coût plus élevé de ces produits.
Il faut réaffirmer qu’aucune étude en FIV ou hors FIV n’a démontré la supériorité de l’une ou l’autre de ces gonadotrophines concernant les taux de succès des traitements, exprimés en taux de grossesse par cycle ou par ponction. Des études ont montré plus de grossesses en additionnant les cycles d’embryons congelés en faveur des recombinants (Puregon®) par rapport au FSH purifié (Metrodine HP®).
Le blocage de l’ovulation
Les agonistes de la Gn-RH
Ils ont par rapport à la Gn-RH naturelle un effet stimulant plus puissant sur l’hypophyse et une durée d’action plus longue. Il en résulte :
-une libération brutale du stock hypophysaire de FSH et de LH se traduisant par une augmentation brutale et transitoire de ces hormones dans la circulation. C’est l’effet « flare up » qui est utilisé dans les protocoles dits courts.
-Cette libération est suivie d’un blocage hypophysaire avec un effondrement des sécrétions de FSH et LH. Le fonctionnement normal de l’hypophyse nécessite, nous lavons vu, une sécrétion pulsatile de la Gn-RH. L’effet du médicament n’étant pas pulsatile mais continu, il s’ensuit un effet inhibiteur de la sécrétion de FSH et de LH lié à l’occupation prolongée des récepteurs de la Gn-RH par l’agoniste entrainant une inhibition secondaire par désensibilisation des récepteurs, par le même mécanisme qui suivrait l’administration continue de Gn-RH. On parle donc de désensibilisation hypophysaire.
L’agoniste peut être utilisé, soit sous forme « retard » (=une seule injection agissant environ 30jours), soit sous forme quotidienne.
Une fois cette désensibilisation obtenue on pourra passer à la stimulation par gonadotrophines sans craindre une ovulation spontanée puisqu’il n’y a plus de production endogène de FSH ni de LH. Cette désensibilisation hypophysaire est donc obtenue par l’administration prolongée de ces agonistes qui peut être soit quotidienne par spray nasal ou injections sous-cutanées, soit sous forme d’injections a effet retard. Les produits utilisables sont par exemple : Décapeptyl®, Enantone®, Lucrin®, Suprefact®, Difériline®.
Les antagonistes de la LH-RH
La substitution de certains acides aminés fait perdre à la molécule de Gn_RH l’essentiel de son activité biologique tout en préservant sa haute affinité de liaison avec son récepteur. Le décapeptide ainsi obtenu agit comme antagoniste de la LH-RH, c’est-à-dire qu’il se fixe sur son récepteur hypophysaire par compétition avec la LH-RH naturelle. Il s’ensuit donc une mise au repos immédiate des cellules gonadotropes sans effet stimulateur initial comme avec les agonistes. Il n’y a pas d’effet « flare up ». Cet effet est de courte durée, et réversible sous l’action de la LH-RH naturelle ou d’un de ses agonistes.
Les antagonistes actuellement utilisés sont l’Orgalutran 0,25® en injections quotidiennes sous-cutanées et le Cétrotide® sous-cutané qui existe en injection quotidiennes à 0,25mg en durée d’action de 96 heures à 3mg.
Le déclenchement de l’ovulation
Le déclenchement de l’ovulation est obtenu depuis très longtemps par l’administration de gonadotrophine chorionique (hCG) d’origine humaine obtenue par purification à partir des urines de femmes enceintes. Il existe depuis un an une gonadotrophine chorionique obtenue par recombinaison génétique (choriogonadotrophine α dont le nom commercial est Ovitrelle®). Ce produit est similaire dans son mode de fabrication aux autres gonadotrophines recombinantes. Son intérêt réside principalement dans la possibilité d’une injection sous-cutanée, donc d’une auto-injection, pour lesquelles le produit urinaire est peu adapté. Ceci est d’autant plus avantageux si l’injection doit être faite tard le soir, les patientes pouvant avoir des difficultés difficultés à solliciter des infirmières après 20 heures. Les résultats obtenus avec Ovitrelle® (dose unique de 250 μg) sont semblables à ceux obtenus avec le produit urinaire (Gonadotrophine Chorionique Endo®). Le prix de Ovitrelle® est cependant supérieur à ses équivalents urinaires.
Les protocoles
L’existence de traitements agonistes et antagonistes définissent, on l’a vu, deux grands types de protocoles pour FIV : avec agonistes ou avec antagonistes. Les protocoles avec agonistes sont de deux types : longs ou courts.
Protocoles avec agonistes
Le protocole long avec analogues agonistes
est le protocole historiquement le plus classique. Il convient aux femmes présentant une réserve ovarienne à priori normale et est particulièrement indiqué quand la seule cause d’infertilité semble être d’origine masculine. Il dure 25 à 30 jours.
Ce protocole de « désensibilisation hypophysaire » associe l’administration:
– d’un analogue agoniste de la LH-RH soit au 21ème jour du cycle précédent, soit au 2e jour du cycle stimulé. Il existe des produits dont l’injection est quotidienne et donc poursuivie jusqu’au déclenchement de l’ovulation ou des produits « retards » dont une seule injection couvre au moins les 28 jours suivants). Ensuite, une période de 14 jours minimum est nécessaire pour obtenir cette inhibition qui doit être vérifiée par échographie et dosage d’estradiol (qui doit être inférieur à 50pg/ml).
– de gonadotrophines dès objectivation de la désensibilisation hypophysaire, généralement 10 à 20 jours après le début du traitement par les agonistes de la GnRH. Cette stimulation par gonadotrophines est alors débutée par une injection quotidienne (généralement à la dose de 150 Unités pour un bilan hormonal standard). Ce traitement doit être surveillé par un monitorage de l’ovulation qui consiste à réaliser une échographie ovarienne par voie vaginale et une prise de sang pour doser l’estradiol. Cette surveillance peut-être débutée entre le jour 8 et 10 de la stimulation soit entre le jour 22 et 24 du cycle choisi. Lorsque les critères de maturité échographique des follicules sont obtenus (plusieurs follicules de diamètre supérieur à 18 mm), l’ovulation est déclenchée par une injection unique de HCG 5000 ou 10000 Unités. La stimulation par FSH recombinante est alors stoppée. Le dosage de l’estradiol est vérifié et doit être compris entre 1500 pg/ml et 5000 pg/ml. L’horaire du déclenchement doit être précis puisqu’il conditionne l’heure de la ponction folliculaire (celle-ci doit être réalisée environ 35 heures plus tard). Avec ce type de protocole, et après le transfert des embryons dans l’utérus, la patiente doit recevoir un soutien hormonal par de la progestérone.
Dans tous les cas, il convient :
– de contrôler au jour 2 des règles, l’absence de follicule dominant;
– de déclencher l’ovulation lorsque les follicules sont mûrs.
Protocole court avec analogues agonistes
Ce protocole utilise l’effet « flare up » qui suit immédiatement l’injection de l’agoniste, la libération de gonadotrophines endogènes transitoire qui s’ensuit permettant d’initier la stimulation, le relai étant pris par l’administration de produits comme le Puregon®. Dans ces situations, on administre généralement les analogues agonistes en même temps que les gonadotrophines (jour 2) et à des doses moindres que pour les protocoles longs. Ce type de protocole nécessite un monitorage plus conséquent que le protocole long, afin de s’assurer que la patiente n’ovule pas spontanément.
En pratique, le traitement par l’analogue commence le deuxième jour du cycle et est poursuivi jusqu’au déclenchement de l’ovulation. Ce cycle peut être soit spontané, soit programmé par l’administration préalable d’un progestatif. La forme galénique de l’analogue est toujours une forme journalière (exemple Décapeptyl® 0,1mg sous-cutané chaque jour). L’injection des Gonadotrophines commence en général en même temps que l’analogue ou au plus tard 3 jours après. Les doses initiales de gonadotrophines sont en général plus faibles que pour un protocole long (de 100 à 200 UI le plus souvent). Le monitorage (échographies et dosages d’estradiol) commence dès le deuxième ou troisième jour de la stimulation et nécessite souvent de fréquentes adaptations de la posologie.
Ce protocole est beaucoup moins utilisé que les autres. Affaire « d’école » chez les normorépondeuses, il est contre-indiqué chez les femmes à risque de réponse excessive (style ovaires polykystiques) et s’adresse plutôt aux « mauvaises répondeuses ». Toutefois, le résultat final en terme d’ovocytes recueillis et fécondés ainsi que le taux d’implantation restent fréquemment décevants. Par ailleurs ce protocole expose les patientes aux kystes fonctionnels et à des montées de progestérone plasmatique supérieures à 3ng/ml nécessitant l’arrêt du traitement. Un contrôle préalable de l’estradiolémie et de la progestéronémie à J2 de l’agoniste, avant de débuter la gonadotrophine, permet de détecter les troubles et de ne pas enclencher le traitement inducteur.
Protocoles avec antagonistes
L’arrivée des antagonistes de la GnRH sur le marché a laissé entrevoir de grands espoirs quant à la réduction des coûts médicamenteux, ainsi qu’à une diminution du risque d’hyperstimulation. En effet, ces antagonistes ayant une action de blocage hypophysaire immédiate, peuvent être introduits plus tardivement dans le traitement, permettant de réduire ainsi les consommations nécessaires de gonadotrophines.
Ils sont bien adaptés aux cas d’ovaires polykystiques et conviennent aussi aux patientes mauvaises répondeuses.
Ils durent 13 à 15 jours.
La stimulation peut commencer en début de règles. Avant ces règles, un pré-traitement en vue d’harmoniser la cohorte folliculaire est souhaitable. Ce pré-traitement vise à empêcher le petit pic de sécrétion de FSH qui précède les règles et qui lance le recrutement. En effet, en fin de phase lutéale du cycle précédent, et notamment chez les femmes à réserve ovarienne diminuée et présentant des cycles courts, l’utilisation de l’estradiol pourrait éviter une ré-élévation trop précoce de la FSH. Ceci permettrait d’éviter la mise en œuvre trop précoce des mécanismes de sélection du follicule dominant et autorisant ainsi une meilleure « synchronisation » de la cohorte de follicules pour le cycle suivant. Ce pré-traitement peut faire appel:
-soit aux estrogènes : par exemple Valérate d’estradiol 4mg/j, soit 1 comprimé matin et soir par voie orale de Provames® démarré au 25e jour du cycle précédent, et poursuivi jusqu’au premier jour de la stimulation, cette dernière pouvant commencer l’un des 5 premiers jours des règles ;
-soit à une pilule estroprogestative qui produit le même effet mais a en plus l’avantage de permettre une meilleure programmation du traitement, la pilule pouvant être arrêtée à une date choisie induisant l’arrivée des règles trois jours après. La stimulation commence alors trois à 4 jours après l’arrêt de la pilule, c’est-à-dire avant la possible survenu du signal FSH.
L’introduction de l’antagoniste peut se faire, selon les écoles, soit au 6e jour de la stimulation, soit au jour 2, en même temps que les gonadotrophines, soit les débuter lorsqu’un follicule atteint 14mm.
Les avantages des protocoles avec antagonistes sont :
-des durées de traitement plus courtes ;
-une meilleure acceptation des patientes ;
-une consommation moindre de gonadotrophines ;
-un nombre plus faible d’ovocytes et d’embryons sans qu’il y ait de diminution du taux de grossesses ;
-une diminution significative du risque d’hyperstimulation
-et la possibilité de repousser d’un jour ou deux le moment de la ponction en fonction de nécessités organisationnelles.
La fécondation in vitro (FIV)
Pour réaliser une FIV, le sperme est recueilli et préparé au laboratoire comme pour une insémination artificielle. Le recueil des ovocytes est plus complexe, car il nécessite une ponction des ovaires.
Au laboratoire, les gamètes sont ensuite mis en fécondation, in vitro (dans un récipient), afin de réaliser l’étape de fécondation.
On ne propose pas une fécondation in vitro d’emblée. Du temps et un certain nombre de consultations seront nécessaires avant d’en poser l’indication. On peut distinguer une première phase d’exploration de la stérilité nécessitant un certain nombre d’examens complémentaires puis une phase de traitement. Bien souvent, d’autres traitements plus simples seront d’abord proposés avant de recourir à la FIV, comme par exemple une stimulation simple de l’ovulation ou des inséminations artificielles. Dans certains cas cependant, l’indication de la FIV pourra apparaître rapidement selon les données du bilan.
Une fois déterminé le type de traitement, après avoir pris soin de vérifier que le dossier est complet, il y a des autorisations légales à signer autorisant l’équipe médicale à effectuer une FIV.
Les étapes de la FIV
La fécondation in vitro comporte donc plusieurs étapes qu’il faut bien comprendre pour mieux en accepter les contraintes :
– le blocage ovarien ;
– la stimulation ovarienne ;
– le déclenchement de l’ovulation ;
– le prélèvement des ovocytes ;
– la fécondation in vitro proprement dite ;
– le transfert des embryons dans l’utérus.
Plusieurs types de protocoles (un protocole est un enchaînement de traitements dans un ordre bien précis) sont utilisés, et ce en fonction de vos examens complémentaires et des examens cliniques (mais aussi des antécédents, de l’âge, de l’histoire médicale, des habitudes de chaque centre, etc).
Le principe est d’obtenir une stimulation de plusieurs follicules, d’éviter une ovulation spontanée et de contrôler la maturation folliculaire.
Le blocage ovarien
Il a pour but d’empêcher une éventuelle ovulation spontanée en cours de cycle sous l’effet de la stimulation, car en cas de FIV il faut que les follicules soient ponctionnés avant l’ovulation et n’aillent pas se perdre dans l’abdomen.
1-Une première possibilité est de faire appel aux agonistes de la LH-RH. Ce sont des produits comme le Décapeptyl®, l’Enantone®, sous formes injectables. Certains existent sous forme de pulvérisations nasales (Suprefact®). Les injections peuvent être réalisées, soit le cycle précédent le traitement de stimulation (généralement au 20ème jour du cycle), soit au début du cycle: 1er ou 2ème jour des règles. Ce type d’injection provoque un blocage temporaire de l’ovulation en simulant une ménopause artificielle, d’où des effets secondaires possibles tels que des bouffées de chaleur, des irritabilités et des maux de tête. Des saignements peuvent également apparaître (contrairement à ce qui était prévu), ils correspondent à la libération brutale des gonadotrophines hypophysaires (FSH et LH) précédant la sidération du système hypothalamo-hypophysaire (=effet « flare-up »). Il s’agit donc d’une évacuation brutale du stock hypophysaire de FSH et de LH. Ces effets secondaires indésirables sont sans lendemain, sans conséquences néfastes et disparaissent très rapidement. Des dosages hormonaux et des échographies attesteront du blocage ovarien et de l’absence de kystes (ce qui nécessiterait une ponction préalable) et des éventuelles anomalies utéro-ovariennes.
2-L’autre possibilité est de faire appel aux antagonistes de la Gn-RH. Ce sont des produits qui bloquent la libération par l’hypophyse de FSH et de LH (sans en épuiser le capital) . Dans ces cas le processus de blocage de l’ovulation se fait en fin de stimulation par des antagonistes de la Gn-RH. Il s’agit du Cétrotide® ou de l’Orgalutran® qui se font à proximité de la période ovulatoire soit en injections quotidiennes, soit en injections retard. Encore faut-il qu’en début de cycle les mécanismes de recrutement et de dominance des follicules n’ait pas été mise en route prématurément avant l’administration de FSH synthétique (Puregon®). Pour cela il faut répéter des notions explicitées dans le chapitre « Physiologie ». Le follicule dominant est en principe sélectionné dès le début de la phase folliculaire, c’est-à-dire entre le premier et le cinquième jour du cycle. Mais ce n’est pas toujours le cas. Il faut savoir que si la deuxième partie du cycle peut être plus courte que 14 jours, la première partie est fixe ; elle dure 13 jours. Or il apparait souvent, notamment sur les courbes de température que cette première phase du cycle est plus courte avec une ovulation paraissant survenir plus tôt. Cela est simplement du au fait qu’elle peut commencer plus tôt, c’est-à-dire avant les règles. Classiquement, l’avancement du cycle menstruel a été calculé en référence au début des règles (jours des règles). Malheureusement cependant, les règles ne sont pas une référence physiologique. En effet, les règles, dernier épisode du cycle précédent, n’ont rien à voir avec le nouveau cycle menstruel qui commence. Le repère que les règles constituent n’offre donc pas d’information précise sur l’avancement fonctionnel réel de la phase folliculaire débutante. Au 3e jour du cycle, au début des traitements d’HOC (hyperstimulation ovarienne contrôlée) (pour la FIV notamment), l’avancement du processus de maturation folliculaire est en fait variable.
En réalité, le début fonctionnel de la phase folliculaire est lié à une légère élévation de la FSH, ou « signal FSH », qui survient pendant la période inter cycle. Cette élévation de la FSH initie la croissance de l’ensemble des follicules dotés de récepteurs à la FSH qui constituent la cohorte des follicules stimulables, visibles en échographie sous l’appellation de follicules antraux.
Le signal FSH inter cycle, qui culmine souvent au 3e jour du cycle (dans les cycles de 28 jours), peut survenir un peu plus tard en cas de cycles longs ou, plus tôt en cas de cycles soi-disant courts. L’amplitude du signal FSH inter cycle, + 2,5 mUI/ml en moyenne, est trop faible pour être identifiée par une simple prise de sang. Pratiquement, il est donc difficile de savoir quand survient le signal FSH inter cycle et quand la phase folliculaire débute réellement. Cela peut avoir des conséquences négatives si l’on commence les injections de FSH (Puregon®) trop tard alors que la sélection et la dominance sont amorcées, dans les cas ou le signal FSH survient avant les règles.
C’est le taux d’estradiol qui contrôle les taux de FSH en fin de cycle. Ainsi, il a été montré qu’un apport en estradiol initié au premier jour des règles ou mieux, 3 jours avant celles-ci, prévient la survenue du signal FSH intercycle et le recrutement folliculaire qui suit. L’élévation de FSH ne commence alors qu’à l’arrêt de l’estradiol et culmine 3 jours plus tard. Cette notion permet de synchroniser la survenue du pic de LH qui a lieu 13-14 jours après l’arrêt d’estradiol, alors que ce dernier avait été poursuivi pendant 7-14 jours après les règles.
La synchronisation du signal FSH peut également être programmée par la prise ponctuelle de pilule contraceptive commencée au 2e jour des règles et continuée pendant 7 à 14 jours (ou plus si nécessaire). Après l’arrêt de la pilule contraceptive, la FSH s’élève plus lentement qu’après la prise d’E2 et culmine au 5e jour après l’arrêt. La pilule offre l’avantage de ne commencer le traitement de synchronisation qu’après la survenue des règles (2e jour).
En résumé, le seul blocage pour obtenir une cohorte homogène de follicules peut être obtenu simplement par la prise préalable de pilule ou par l’administration d’estrogènes à la fin du cycle précédant la stimulation. Le blocage de l’ovulation proprement dite sera obtenu par l’adjonction des antagonistes.
La stimulation ovarienne proprement dite
Hormis les cycles spontanés, les ovaires sont stimulés à l’aide d’hormones de manière à induire la formation de plusieurs follicules.
Nous prendrons l’exemple du Puregon®, que la patiente peut s’injecter elle-même par voie sous-cutanée à l’aide d’un stylo spécial (voir plus loin les modalités d’utilisation du Purégon®). Ces injections sont en général quotidiennes, à effectuer le soir, vers 18-20 heures. La dose est fixée par le gynécologue mais il faut savoir qu’elle est variable d’une patiente à l’autre et d’une tentative à l’autre pour la même patiente. Le but est d’obtenir un certain nombre d’ovocytes tout en évitant une hyperstimulation. Le choix de la dose dépend de l’âge de la patiente, du niveau de la réserve ovarienne (compte des follicules antraux et niveau de l’AMH), de l’aspect des ovaires et des réponses aux tentative précédentes éventuelles.
À intervalle régulier, des dosages hormonaux plasmatiques et des échographies (habituellement réalisées par voie vaginale) indiquant le nombre et la taille de chaque follicule présent dans chaque ovaire, ainsi que l’épaisseur de la muqueuse utérine seront effectués et la posologie sera éventuellement réajustée. Il est permis de manger et de boire avant de se soumettre aux prises de sang effectuées dans le cadre de la stimulation ovarienne.
Le nombre de dosages hormonaux et d’échographies dépend de la manière dont vous réagissez au traitement. Tous les résultats des contrôles sanguins et échographiques donnent lieu à des conclusions et à des indications. Il va sans dire que tous les résultats devront être communiqués en lieu et heure précises. Soit vous serez contacté, soit vous contacterez le Centre.
Sous l’effet de la stimulation ovarienne, provoquant le développement de plusieurs follicules, les ovaires augmentent de volume, entraînant des douleurs abdominales et des gonflements. De plus des allergies à la thérapeutique ou au point d’injection sont possibles. Ces phénomènes sont temporaires, mais peuvent imposer l’arrêt ou le changement de thérapeutique.
En cours de traitement, il est possible de modifier les doses des produits, voire d’arrêter la stimulation ovarienne soit en cas de réponse excessive, soit en cas d’absence de réponse ou de réponse insuffisante, soit pour toute autre raison.
Il est nécessaire de savoir que les stimulations ovariennes n’entraînent pas d’effet d’épuisement sur l’ovaire. Dans certains protocoles on adjoint dans les jours précédant l’ovulation un autre type d’injections afin d’empêcher l’ovulation de se produire spontanément (protocoles avec Antagonistes).
Il est important que la croissance folliculaire soit progressive et évolue parallèlement à l’augmentation de l’estradiolémie. Dans l’idéal, la maturation folliculaire finale permettant aux follicules de passer de 10 à 20mm de diamètre doit s’effectuer en 5 à 7 jours. La montée de l’estradiolémie est exponentielle et le taux final d’estradiol doit être proportionnel au nombre de follicules matures (c’est-à-dire supérieurs ou égaux à 14mm). Ce taux est d’environ 250 à 300pg/ml par follicule mature.
La surveillance, indispensable, est donc double, échographique et hormonale :
-Echographique par l’évaluation des follicules recrutés et de leur croissance en taille. L’évaluation des follicules est réalisée grâce à leur taille et à leur croissance. Le follicule est mesuré grâce ses 3 plus grands diamètres x, y, et z et un diamètre moyen peut être calculé, mais ces mesures sur échographie en deux dimensions comportes ce nettes variabilité d’un opérateur à l’autre. L’échographie en 3 dimensions (3D) présente de nombreux avantages par rapport à l’échographie traditionnelle en 2 dimensions (2D). L’organe est rapidement scanné et une représentation complète est enregistrée. Ce volume 3D peut alors être utilisé pour obtenir des vues en mode plan ou une vision global de tout l’organe (angle de vision modifiable).
-Hormonale par l’évolution des dosages plasmatiques d’estradiol, et de progestérone en cas de protocole avec agonistes. Dans certains cas des dosages de LH quotidiens ou bi-quotidiens seront utiles pour détecter le départ d’un pic de LH endogène.
Le rythme de cette surveillance dépend des habitudes de l’équipe médicale et du type de protocole.
Si la croissance est harmonieuse, les doses de gonadotrophines resteront inchangées. Elles seront augmentées ou diminuées en fonction des résultats.
La stimulation peut être arrêtée dans certains cas:
– si la croissance folliculaire est correcte mais la production d’estrogènes insuffisante ;
– si le recrutement folliculaire est très médiocre (1 ou 2 follicules) ;
-si l’estradiolémie chute de plus de 30% sur deux jours consécutifs ;
– si au contraire la croissance folliculaire est trop rapide avec en particulier des taux d’estradiol trop élevés qui font craindre une hyperstimulation et une qualité ovocytaire médiocre ;
-si un pic endogène de LH est observé avec des follicules de taille inférieure à 17mm lors d’un protocole sans agoniste.
Le déclenchement de l’ovulation
Il est obtenu par l’injection intramusculaire de 5000 ou 10000 UI d’HCG qui va mimer le pic endogène de LH. L’HCG permet la reprise de la méiose de l’ovocyte bloqué en métaphase I qui se retrouve normalement en métaphase II avec expulsion du premier globule polaire au moment du recueil ovocytaire.
Le déclenchement est décidé lorsqu’existe une majorité de follicules supérieurs à 14mm, les plus gros atteignant 19-20mm, que le taux d’estradiol correspond au nombre de follicules matures visualisés (250 à 300pg/follicule) et que le taux global d’estradiol ne dépasse pas 4000pg/ml sous peine de risque d’hyperstimulation. A partir de cette injection, il n’y aura plus d’injections stimulantes ni bloquantes. La date et l’heure, ainsi que la posologie de l’HCG sont fixées de manière précise et impérative, les follicules étant ponctionnés 35 ou 36 heures après, soit juste avant l’ovulation.
Le prélèvement folliculaire
L’heure de déclenchement de l’ovulation déterminera l’heure de ponction des follicules.
La présence du couple est en général requise 2 heures avant l’heure de la ponction. Ce délai est important à respecter pour que le prélèvement se passe de façon optimale. Le prélèvement folliculaire s’effectue sous anesthésie générale, sous contrôle échographique, vessie vide. Il faut être strictement à jeun (sans avoir mangé, ni bu, ni fumé 6 heures avant). Il s’agit d’une anesthésie légère et de courte durée, qui n’a aucun effet nocif sur les ovocytes.
Après avoir uriné, la patiente est transférée en salle de ponction et installée sur une table gynécologique. Une sonde d’échographie est introduite dans le vagin pour rechercher et la situation des ovaires et repérer les follicules visibles. Une fine et longue aiguille creuse est introduite dans un guide aiguille situé sur la sonde endovaginale, puis en traversant la paroi vaginale elle atteindra l’ovaire. Les follicules seront alors aspirés un par un et leur contenu sera réceptionné dans un tube prévu à cet effet, avant d’être transportés au laboratoire.
Tous les follicules seront ainsi aspirés.
Les échecs de ponction sont rares mais possibles (soit il n’y a pas d’ovocyte – on parle de « ponction blanche »- soit l’ovaire est inaccessible).
Le prélèvement ne dure en général que quelques minutes (10 à 20 minutes).
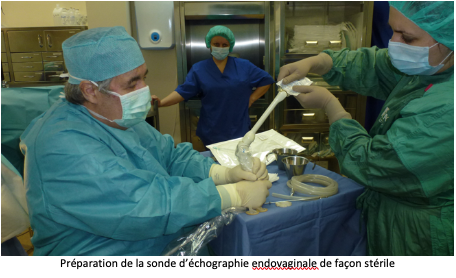
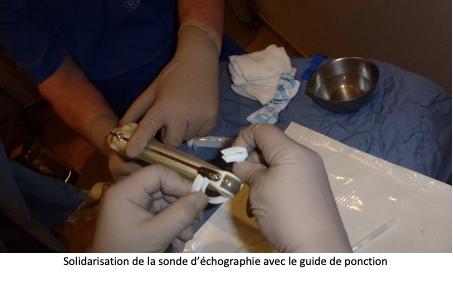
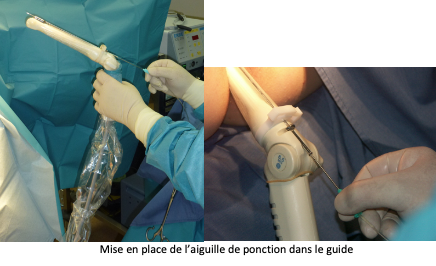
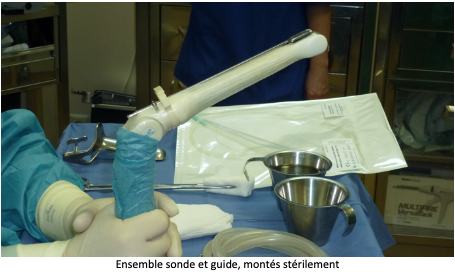

La ponction folliculaire est généralement réalisée en ambulatoire hospitalisation de quelques heures seulement).
Il est impossible de connaître le nombre d’ovocytes avant la ponction et il n’y a que rarement correspondance exacte entre le nombre de follicules visibles à l’échographie, le nombre de follicules ponctionnés et le nombre d’ovocytes recueillis.
Le nombre d’ovocytes est d’environ 5 à 10 par ponction, mais il varie énormément de 0 (3% des cas) à> 30 (1% des cas). Il faut noter que le nombre d’ovocytes dépend de la réponse à la stimulation ovarienne, mais aussi de l’âge de la femme, de l’indication de la FIV, etc.
De plus, les ovocytes recueillis ne sont pas tous de même qualité et sont à des stades de maturité variables. Certains ovocytes sont parfaitement matures, d’autres le sont incomplètement, d’autres sont totalement immatures. De la maturité ovocytaire, dépend leur aptitude à être fécondé et à donner un embryon viable.
Ce n’est que le jour du déclenchement de l’ovulation qu’il est possible de connaître l’heure de la ponction qui s’effectue en même temps que le recueil de sperme. Une abstinence de 2 ou 3 jours est le plus souvent recommandée. Le sperme est mis en liquéfaction, puis lavé et préparé, afin d’être débarrassé du liquide séminal, avant d’être mis en contact avec les ovocytes. Les techniques de préparation du sperme ont pour but d’éliminer le liquide séminal et de concentrer les spermatozoïdes les plus mobiles.
Les traitements adjuvants
Après la ponction ou le transfert, de la Progestérone est administrée par voie orale ou vaginale visant à favoriser l’épaississement de la muqueuse utérine et faciliter la nidation de l’embryon.
La fécondation in vitro proprement dite
Le liquide folliculaire préalablement prélevé, est transmis au laboratoire. Tous les liquides sont examinés, à plusieurs reprises, sous microscope et les ovocytes isolés et mis dans un incubateur (gazé et chauffé).
L’environnement des gamètes doit être constant et aussi proche que possible des conditions réalisées in vivo, tant en ce qui concerne la température, que le pH, la lumière, le mélange gazeux, la pression osmotique, la qualité des milieux de culture.
Quelque temps après la ponction, les spermatozoïdes sont mis en contact avec les ovocytes (environ 100 000 spermatozoïdes par ovocyte). Les réceptacles contenant les cellules mâles et femelles sont placés dans un incubateur où sont reproduites les conditions existant dans les trompes.
Devant l’impossibilité de reconnaître les ovocytes matures, tous les ovocytes sont mis en culture.
La fécondation dure environ une dizaine d’heures. Il s’agit d’une cascade d’événements cellulaires, dépendants les uns des autres. Un certain nombre d’ovocytes ne seront pas fécondés, pour des raisons diverses.
Le taux de fécondation est estimé entre 50 à 75%.
Il faut aussi signaler que le taux de fécondation varie en fonction des caractéristiques individuelles et notamment en fonction de l’indication.
Le lendemain de la ponction, les œufs sont examinés au microscope et lorsque la fécondation a eu lieu, on observe 2 noyaux au centre de l’œuf.
Le 2ème jour, les embryons commencent à se diviser : ils présentent 2 à 4 cellules. Ils sont parfois replacés à ce stade.
Le 3ème jour, les embryons continuent à se diviser. Ils présentent 4 à 8 cellules.
Le 4ème jour, les embryons présentent l’aspect d’une mûre (morula).
Le 5ème et le 6ème jour, les embryons forment une cavité, c’est le stade de blastocyste.
Les embryons peuvent être transférés in utero à tous les stades, mais le plus souvent le transfert s’effectue soit à J2 ou J3, soit au stade de blastocyste.
Tous les embryons ne sont pas viables et peuvent arrêter leur développement à des stades plus ou moins précoces. Ceci peut être dû à la présence d’éventuelles anomalies chromosomiques, à la qualité des ovocytes et des spermatozoïdes; il y a donc au moins 50% d’embryons porteurs d’une anomalie chromosomique et qui ne se développeront pas.
Le transfert embryonnaire
La technique du transfert est très semblable à celle de l’insémination artificielle intra-utérine. Il s’agit là aussi d’une intervention indolore qui ne nécessite ni anesthésie ni hospitalisation.
Pour effectuer le transfert embryonnaire, votre présence, madame, est nécessaire dans l’unité de PMA et vous serez convoquée tout comme le jour de la ponction. La ponctualité est recommandée.
Le transfert d’embryons est une intervention de courte durée, la plupart du temps indolore et sans danger. Aucune anesthésie n’est requise.
Le nombre d’embryons à transférer aura été déterminé avec le couple. Il est de plus en plus souvent de un embryon, parfois deux.
Il est important que la vessie de la patiente soit pleine au moment du transfert. Une vessie pleine diminue l’angle formé entre le col et le corps de l’utérus et facilite grandement la procédure. Les transferts embryonnaires peuvent être réalisés sous contrôle échographique abdominal pour plus de précision.
Un spéculum est introduit dans le vagin qui est désinfecté avec le produit de rinçage des embryons. Le col utérin est soigneusement repéré. A l’aide d’un fin cathéter fixé sur une seringue remplie de milieu de culture, le ou les embryons sont déposés dans la cavité utérine par pression sur le piston de la seringue, tout en prenant soin de ne pas blesser, l’orifice cervical, le canal cervical et sans toucher le fond utérin. Il s’agit de déposer un ou plusieurs embryons dans la cavité utérine et non d’implanter des embryons dans la muqueuse utérine. L’emplacement idéal est de 10 à 15mm du fond utérin (Fig.1).
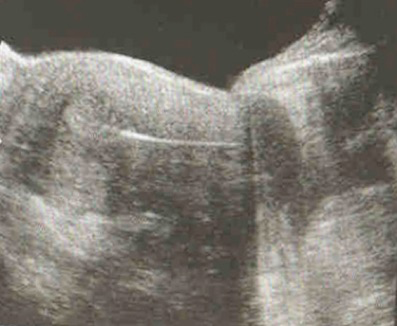
Le cathéter est ensuite confié au biologiste qui vérifie que les embryons ne sont plus dans le cathéter.
Les embryons transférés pourront, s’ils continuent leur développement et si la muqueuse utérine et l’environnement sont adéquates s’implanter et se nider 4 à 5 jours plus tard.
En général, il est préférable d’éviter les bains chauds, les rapports sexuels, les saunas, les sports intensifs … Mais les déplacements n’ont aucune incidence sur la réussite de la FIV, de même que le repos strict (s’enfermer et attendre) ou les arrêts de travail intempestifs. Il est nécessaire d’éviter tout ce qui pourrait entraîner des contractions utérines, que ce soit au moment du transfert ou après et ce jusqu’à la nidation proprement dite.
Les échecs du transfert proprement dit, c’est-à-dire l’impossibilité de traverser le col et pénétrer dans la cavité utérine sont rares, mais non exceptionnels.
Par contre les échecs de nidation, c’est-à-dire d’implantation de l’œuf dans l’utérus sont nombreux et représentent environ 88% des embryons transférés. Autrement dit, seuls 12% des embryons se nident , ce qui peut justifier le transfert de plusieurs embryons. De plus, comme il est difficile de reconnaître les embryons viables, il est donc logique d’en transférer plusieurs, pour avoir plus de chances de disposer du bon embryon (en reproduction spontanée, environ 50% des embryons se nident).
Le nombre d’embryons transférés sera rediscuté, avant le transfert, avec l’équipe médicale. Le choix possible se situe entre 1 et 2, et de plus en plus actuellement à un seul embryon pour limiter les risques liés aux grossesses gemellaires voire triples et parceque la vitrification et la congélation embryonnaires sont maintenant bien au point. Toutefois, afin d’éviter au maximum les grossesses multiples le choix final se fera, en accord avec le couple, en tenant compte d’un certain nombre de paramètres, comme :
– l’âge de la conjointe;
– le rang de la tentative;
– la qualité des embryons;
– le taux de fécondation de la tentative en cours, etc…
Les embryons surnuméraires de bonne qualité seront congelés ou vitrifiés.
Les chances d’obtenir une grossesse sont donc de 12% en transférant un embryon, de 24% avec 2 embryons, etc.
Le risque des grossesses multiples empêche cependant le transfert de plus de 3 embryons. Il faut donc réaliser un compromis entre 2 attitudes contradictoires : Transférer le plus d’embryons possibles pour avoir le maximum de chances de grossesse et en transférer le moins possible pour éviter le risque de grossesses multiples.
L’ensemble des auteurs de la littérature s’accorde à dire que le transfert embryonnaire constitue l’étape-clé des actes d’AMP. Il peut être cause d’échecs d’implantation par l’induction de contractions utérines pour lesquelles l’administration de progestérone a prouvé son efficacité, par contamination intra-utérine, par rétention d’embryons dans le cathéter, d’expulsion des embryons dans les trompes ou dans le col…
Le transfert embryonnaire apparaît comme un geste simple, sans complication chirurgicale spécifique, mais nécessitant une maîtrise parfaite. La difficulté ressentie par le médecin pour cet acte apparaît comme un élément prédictif de grossesse : lorsque le transfert est considéré aisé il s’accompagne d’un taux de grossesse de 20 à 33% selon les auteurs et a contrario un transfert considéré difficile s’accompagne respectivement d’un taux de grossesse de moins de 10%.
Plusieurs types de cathéters sont à notre disposition : souples ou semi-rigides, avec mandrin ou à mémoire, à ouverture terminale ou latérale. Ils permettent de répondre à des situations différentes. Les données concernant les différents types de cathéter utilisé divergent mais plusieurs études soulignent l’amélioration des taux de transferts embryonnaires avec l’utilisation de cathéters souples par rapport aux cathéters rigides. Il semble que les éléments relatifs les plus prédictifs de grossesse sont : l’absence de sang sur le cathéter, le type de cathéter utilisé, l’absence de contact avec le fond utérin , l’absence d’utilisation d’une pince, l’aspiration préalable du mucus cervical, l’évaluation échographique préalable , le cathéter laissé en place une minute , le repos 20 à 30 minutes après le transfert, le test de cathétérisme du col avant le transfert, le monitorage échographique du transfert, l’utilisation d’anti-prostaglandines . Enfin l’atmosphère générale doit être détendue, une ambiance musicale douce peut être la bienvenue et il est fortement souhaitable que la patiente connaisse le médecin qui fait le transfert.
Les médicaments adjuvants après le transfert
Dans certains cas des médicaments sont prescrits après le transfert embryonnaire.
En dehors des antalgiques destinés à gérer les douleurs résiduelles de la ponction, on pourra éventuellement prescrire un ou plusieurs des médicaments suivants, en vue de soutenir la phase lutéale.
-Les spasmolytiques (Spasfon ®): Certaines équipes conseillent aux femmes de prendre cet antispasmodique les 3 jours suivant le transfert, afin de relâcher l’utérus. Dans ce cas, la posologie est souvent de 1 à 2 comprimés 3 fois par jour.
-La progestérone micronisée (Utrogestan ®). Elle est à débuter dès la ponction pour la plupart des équipes. Elle se présente sous forme de capsule, à utiliser par voie vaginale. Elle peut se prendre par voie orale, mais l’absorption est bien meilleure par voie vaginale et les somnolences sont moindres. La posologie est généralement d’une capsule (100mg ou 200mg) 2 fois par jour (matin et soir) ou 3 fois par jour (matin, midi et soir).
-L’aspirine 75 ou 100 mg (Kardégic® ou Aspégic nourrisson®: L’aspirine, à faibles doses, a pour effet de «fluidifier » le sang. Cela améliorerait le flux sanguin, notamment au niveau utérin et pourrait alors favoriser la nidation. Attention : aux doses habituelles (500mg ou 1g), l’aspirine perd cette activité spécifique. Toutefois, il faut bien constater qu’il n’existe pas de preuve scientifique que l’aspirine améliore les résultats en termes d’implantation, mais beaucoup d’équipes en prescrivent systématiquement.
-L’HCG (HCG ®, Pregnyl ®): Par son action mimant la LH, l’HCG va induire la sécrétion d’œstrogènes. Cette injection ne doit pas être faite si un risque d’hyperstimulation est à craindre. Elle est donc rarement indiquée en cas de FIV. On peut injecter 2500 UI en une fois, ou réaliser jusqu’à 4 injections de 1000 UI à 3000UI, espacées de plusieurs jours, dans les 9 jours après le transfert. L’HCG étant l’hormone détectée par les tests de grossesse (sanguins et urinaires), veillez à respecter le délai entre la dernière injection et le test (minimum 13 jours), sous risque d’avoir un résultat faussement positif.
-L’estradiol (Oromone® 1 ou 2 mg, Progynova®) : Dans le but de soutenir le taux d’estrogènes en deuxième phase, au lieu d’injecter de l’HCG, il est possible de supplémenter directement en estrogènes, sans toutefois risquer d’induire une hyperstimulation ovarienne.
Enceinte ou non?
Au cours de la grossesse, les taux sériques d’hCG sont significatifs dès le 6ème jour suivant la fécondation. Mais, en cas de fécondation in vitro, il ne faut pas faire le premier dosage avant 12 jours après la fécondation pour éviter que le résultat soit faussé (faussement positif) par la persistance de l’hCG exogène qui a été injecté lors du déclenchement de l’ovulation. 12 jours, c’est en effet le temps nécessaire pour qu’apparaisse dans le sang, à concentration suffisante, la bêta-hCG, l’hormone sécrétée par l’embryon qui prouve la grossesse. Un examen sanguin est donc prescrit 13 jours après le transfert d’embryons. (12ème jour après)
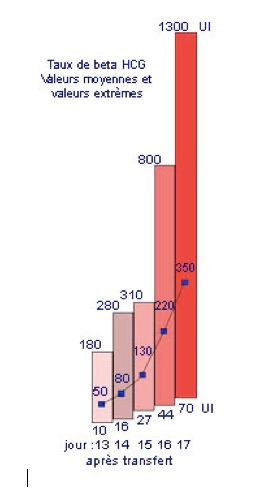
Le taux de bêta-hCG double ensuite tous les 2 à 3 jours et atteint un maximum à la fin du premier trimestre pour redescendre et rester en plateau jusqu’au terme.
Le taux de bêta-HCG déterminera l’existence ou non d’une grossesse, et permettra d’en suivre l’évolution (en général le premier dosage se situe aux alentours de 50 mUI/ml). D’autres sont parfois nécessaires. Au cas où les règles surviendraient avant la date prévue du premier dosage, il est recommandé d’effectuer celui-ci, surtout si les règles vous paraissent anormales (même si dans la plupart des cas le résultat s’avère négatif, et ne fait qu’accentuer la déception très compréhensible de l’échec (1 grossesse sur 3 saigne au tout début).
Une échographie est prévue à la 4ème ou 5ème semaine après le transfert des embryons. Elle jugera du nombre et de la qualité de l’embryon, ainsi que de sa situation endo-utérine. (environ 4% des grossesses après FIV sont des grossesses extra utérines contre 1% dans la population générale).
Les résultats attendus
Toute indication et âge confondus, le pourcentage d’obtenir une grossesse est de 21% par ponction folliculaire et de 26% par transfert d’embryons.
75% des grossesses aboutissent à la naissance d’un enfant vivant, soit 16% par ponction; Cela est dû, non pas à la FIV elle-même, mais aux caractéristiques des femmes traitées (l’âge moyen est souvent élevé), de même que les antécédents infectieux, endométriosiques ou autres.
Il faut cependant noter que ces chiffres sont globaux et ne font pas état de l’âge, des indications, du nombre d’embryons transférés, ni de la qualité du sperme, ni de la caractéristique ou du nombre de tentatives.
Le traitement de la FIV peut être interrompu au cours de toutes les étapes, d’autant que le pourcentage de grossesse est directement corrélé à la réponse ovarienne. En cas de réponse inadéquate, il est préférable d’annuler le cycle et de reconsidérer les paramètres.
Après une tentative infructueuse, il est impératif d’observer un délai d’attente au moins de 2 à 3 cycles, afin de récupérer aussi bien physiquement que psychiquement et physiologiquement. De plus, plus les tentatives sont rapprochées, plus le taux de grossesses diminue. Une bonne réponse ovarienne nécessite quelques cycles de repos avant une nouvelle tentative.
La cause de l’échec est souvent difficile à retrouver et parfois impossible.
On ne peut apprécier qu’imparfaitement la réponse à la stimulation hormonale, le moment propice du déclenchement, la qualité des follicules et des ovocytes, la qualité et le pouvoir fécondant du sperme, la qualité des embryons, l’état de réceptivité de la muqueuse utérine. On sait, en revanche, que la ponction ramène un nombre hétérogène d’ovocytes, les uns sont matures, les autres non, que tous les embryons fécondés ne sont pas viables, et qu’ils ne s’implantent pas tous, et que la muqueuse utérine n’est pas forcément apte à la nidation.
Un nouveau bilan est souvent utile, même s’il est récent. Les éléments nécessaires à la conception d’un enfant en FIV étant multiples, il est impossible de tous les incriminer, il est aussi impossible de tous les rechercher, même si de nombreuses hypothèses peuvent être avancées.
Dans certains cas, la cause de l’échec est difficile à préciser et c’est la répétition des tentatives qui pourra permettre d’obtenir une grossesse, sous réserve qu’aucune cause ne soit négligée.
La part aléatoire, c’est-à-dire la part des paramètres inconnus ou imparfaitement contrôlés, est considérable et chaque cas représente un cas particulier. Un peu de savoir faire, un peu de chance et le bon déroulement de la stimulation, de la ponction, de bons ovocytes, un bon sperme, une bel embryon viable, une muqueuse utérine adéquate et l’on obtiendra un enfant.
Il appartient à chaque couple de savoir si sa motivation et sa résistance, physique et psychologique, peuvent lui permettre de persévérer.
Il appartient, au médecin, de juger de la faisabilité d’une nouvelle tentative ou d’arrêter là les tentatives.