Qu’est-ce que la ménopause?
La ménopause correspond à l’arrêt du fonctionnement des ovaires. Cet arrêt porte sur les deux fonctions des ovaires que sont la production d’ovocytes (rendant la grossesse impossible définitivement), et la production des hormones: estrogènes et progestérone. Elle se produit entre 45 et 55 ans. Avant 40 ans on parle de ménopause précoce (Insuffisance ovarienne prématurée).
Il s’agit donc d’un phénomène ovarien, génétiquement programmé et qu’il est impossible d’éviter. En réaction à cette chute des estrogènes, l’hypophyse réagit par une hypersecrétion d’hormones hypophysaires, FSH et LH, dans le but, illusoire de relancer la fonction ovarienne.
Ménopause, preménopause et périménopause
La preménopause est la période qui précède la ménopause et qui peut s’étaler sur plusieurs années, bien que très variable d’une femme à l’autre. Elle se caractérise par des troubles plus ou moins marqués de l’ovulation et des secrétions hormonales à type de cycles irréguliers et de syndromes prémenstruels. S’y ajoutent parfois des bouffées de chaleurs qui peuvent donc apparaître plusieurs mois ou années avant la ménopause.
Quant à la périménopause, la ménopause n’étant pas un phénomène brutal mais progressif, elle correspond aux quelques mois qui entourent l’arrivée de la ménopause proprement dite.
Diagnostic de la ménopause
C’est traditionnellement l’arrêt des règles. Certes, il n’y a plus de règles après la ménopause, mais absence de règles ne signifie pas ménopause. En effet l’aménorrhée est liée à l’absence d’ovulation mais ne préjuge pas d’une éventuelle persistance des secrétions estrogéniques. Ces dernières qui deviennent souvent anarchiques en préménopause peuvent par ailleurs être responsables de métrorragies «fonctionnelles» pouvant brouiller les cartes.
Un diagnostic biologique de la ménopause est rarement nécessaire, les signes cliniques couplés à l’âge étant le plus souvent suffisants. Si nécessaire, deux dosages sont suffisants: la FSH et l’estradiol. En cas de ménopause confirmée, la FSH est élevée et l’estradiol est effondré. En cas de préménopause, soit ces dosages sont normaux, soit la FSH est élevée mais avec un taux d’estradiol encore signficatif.
Enfin, l’absence de règle pendant au moins 3 mois chez des femmes prenant un progestatif 10, 15 ou 20 jours par mois signe également le plus souvent une ménopause.
Causes de la ménopause
On l’a vu, la ménopause est un phénomène naturel qui est génétiquement programmé et dont l’âge est souvent le même de mère en fille mais elle peut être provoquée par une ablation chirurgicale des ovaires, une chimiothérapie ou une maladie auto-immune provoquant la production d’auto-anticorps qui peuvent altérer le fonctionnement des ovaires.
Symptômes de la ménopause
A-L’aménorrhée. C’est le signe majeur, évocateur pour l’âge concerné lorsqu’elle persiste au bout d’un an.
A-Les autre signes ne sont pas obligatoires bien que classiques.
1-Bouffées de chaleur.
2-Sueurs nocturnes et troubles du sommeil.
3-Sécheresse vaginale et atrophie des muqueuses vaginales mais aussi vésicales donnant des symptômes évoquant des cystites (pollakiurie, brulures mictionnelles). Ces troubles n’apparaissent qu’au bout d’un certain temps.
4-Modifications de la peau et des cheveux: peau et cheveux secs et agravation des rides.
5-Prise de poids de 3 ou 4Kg parfois constatée lors des premiers mois.
6-Troubles psychologiques: angoisse, dépression, tristesse, changement d’humeur, sensation de fatigue.
7-Parfois troubles de la libido.
Les complications à long terme de la ménopause
A-L’ostéoporose
La perte osseuse est un processus inéluctable de vieillissement du tissu osseux qui survient à partir de l’âge de 30 ans et s’accélère après la ménopause en raison de la carence oestrogénique. Chez les femmes ménopausées, l’incidence des fractures entre 50 et 60 ans reste faible (de l‘ordre de 5 fractures du poignet, 1 à 2 tassements vertébraux et 0,5 fracture du col fémoral pour 1 000 femmes par an). Néanmoins, De nombreux facteurs, à l’exception des antécédents familiaux, entraînent une augmentation du risque de fractures chez la femme, comme un faible poids corporel, le tabagisme, le manque d’exercice, un faible apport de calcium et de vitamine D, une perte précoce de la fonction ovarienne et le recours à certains médicaments.
B-Le risque cardiovasculaire
La ménopause est associée à une augmentation du risque cardiovasculaire à long terme mais le rôle propre de la carence oestrogénique n’est pas clairement établi. Il pourrait tout simplement s’agir du vieillissement et de la présence plus fréquente avec l’âge de certains facteurs de risque comme la surcharge pondérale ou l’obésité, le diabète, l’hypertension artérielle ou encore l’hypercholestérolémie. Le tabac restant un facteur de risque bien connu mais indépendant de la ménopause.
Le traitement hormonal de la ménopause (THM)
Le traitement hormonal de la ménopause vise à compenser la carence en oestrogènes.
A-Historique du traitement hormonal
Cette historique est intéressante car elle montre les effets parfois pervers de la dictature intellectuelle de l’EBM (Evidence Based Medecine), c’est-à-dire de la médecine qui ne serait basée que sur des preuves, mais qui a pour effet pervers de supprimer toute liberté de jugement chez les médecins…
Les début de traitement de la ménopause remontent à 1940 aux États-Unis et ont été fait avec le Premarin qui est un estrogène conjugué d’origine équine, administré par voie orale. En France, c’est vers 1970 que l’on a commencé à utiliser des produits à visée hormonale substitutive (THS). Très vite d’ailleurs, les molé- cules utilisées en France se sont différenciées de celles diffusées aux États-Unis : l’estrogène employé étant le plus souventun estrogène naturel, le 17b-estradiol. De même les progestatifs sont vite devenus différents: produits naturels plutôt que produits de synthèse.
De 1980 à 2002, on a assisté à une croissance régulière des prescriptions (multiplication par 6 des ventes). En 2002, 2 millions de femmes étaient traitées en France, avec il faut le dire certains excès publicitaire à but commercial promettant, outre les effets sur les bouffées de chaleur, l’ostéoporose et les bénéfices cardiovasculaires, des effets cosmétiques remarquables et finalement une recette pour ne pas vieillir…D’où l’enthousisme du public et des médecins. La recherche s’étant engoufrée dans le créneau, accompagnée d’une proliferation incontrolée de publications scientifiques et de congrés médicaux de tous poils, le premier gel au 17b-estradiol est apparu sur le marché en 1974, puis le premier THS combiné estroprogestatif en 1982 et le premier patch transdermique en 1987.
Tout allait de mieux en mieux jusqu’à la publication en 2002 d’une étude américaine connue sous le nom de WHI. WHI signifie: Writing Group for the Women’s Health Initiative Investigators. Risks and benefits of estro- gen plus progestin in healthy postmenopausal women. Principal results for the Women’s Health Initiative. Randomized control trial. JAMA, 2002;228:321-333.) L’étude à même du être suspendue avant la fin parce que les résultats montraient un risque accru de crise cardiaque et de maladies du coeur chez les femmes plus âgées. Les chercheurs en ont conclu que toutes les femmes ayant recours à l’hormonothérapie encouraient les mêmes risques. Une autre étude anglaise allait dans le même sens, la MWS (Million Women Study Collaborators. Breast cancer and hormone replacement therapy in the Million Women Study. Lancet, 2003;362:419-427. ). Il s’en est suivi une une chute vertigineuse de l’utilisation du traitement hormonal.
Il a fallu quelques années de plus et de nouvelles études pour mettre en évidence que dans l’étude WHI:
-les traitements avaient été administrés à des femmes le plus souvent âgées de plus de 65 ans, ce qui n’est pas une bonne représentation de l’état de santé d’une femme nouvellement ménopausée d’environ 50 ans. Une analyse méticuleuse de l’étude a depuis révélé que ces conclusions ne s’appliquent pas aux femmes au début de la ménopause. La reprise des résultats de la WHI (Rossow JE. Postmenopausal Hormone Therapy and Risk of Cardiovascular Disease by Age and Years Since Menopause. JAMA, 2007;297:1465-1477. ) et la poursuite de la Nurses’ Health Study (Grodstein F, Manson JE, Stampfer MJ et al. Hormone Therapy and Coronary Heart Disease: The Role of Time since Menopause and Age at Hormone Initiation. Journal of Women’s Health, 2006;15:35-44. doi:10.1089/ jwh.2006.15.35. ) a permis de différencier deux groupes de femmes: celles de moins de 60 ans et celles de plus de 60 ans;
-que les traitements avaient été administrés à des femmes plutôt fortes voire obèses, et parfois hypertendue ou diabétiques;
-et traitées avec des produits par voie orale associant des estrogènes conjugués équins à de l’acétate de médroxyprogestérone , protocoles abandonnés depuis longtemps en France. Or ces produits augmentent significativement le risque coronarien, de cancer du sein, d’embolie pulmonaire, d’AVC et de démences bien que diminuant significativement le risque de fracture du col du fémur et du cancer du côlon.
Depuis donc, de nouvelles études ont permis de préciser un certain nombre de règles.
B-Principes de prescription
1-Le traitement des bouffées de chaleur
Dès l’installation de la ménopause à son âge habituel, le THM pourra être prescrit à une femme informée en prenant le temps d’explication nécessaire à son acceptation, en se référant aux recom- mandations notamment de l’Afssaps (2003) et plus récemment de l’HAS (juillet 2014) : “le THM reste indiqué chez la femme ménopausée présentant des troubles fonctionnels liés à la ménopause et altérant sa qualité de vie. Il doit être prescrit à la dose minimale efficace, pour la durée la plus courte possible dans le respect des précautions d’emploi et des contre-indications. Toute femme traitée doit bénéficier d’une réévaluation régulière de ce traitement au moins une fois par an.”

2-Nature et voie d’administration des estrogènes utilisées
Les estrogènes naturels doivent seuls être utilisés. La voie transdermique doit être privilégiée (gels ou patchs) mais la voie orale avec les estrogènes naturels est possible. Toutes les sociétés savantes recommandent l’uti- lisation des posologies estrogéniques modérées, tant par voie orale que trans- dermique (patch: 25 à 37,5μg; comprimé: 0,5 à 1 mg; gel: une pression de 1 mg). On utilise la dose minimum efficace sur les bouffées de chaleur.
3-Les progestatifs
Afin d’éviter un éventuel effet néfaste des etrogènes sur l’endomètre, on y associe un progestatif si la femme a encore son utérus. L’estrogène est donné seul en cas d’hystérectomie. Le progestatif sera naturel, soit la Progestérone micronisée, soit la Rétroprogestérone (Duphaston®, Estima®). Il faut éviter certains autres progestatifs (norstéroïdes, norprégnanes) concernant le risque de cancer du sein et de maladies veineuses thromboemboliques.
4-Durée du traitement
Le traitement doit être initié dès le début de la ménopause et il est recommandé de limiter la durée de ce traitement à 5 ou 10 ans, pas au delà. Cependant, la majorité des experts estime que seules doivent être prises en compte les raisons pour lesquelles il a été prescrit. Son renouvellement sera envisagé si son utilité reste de mise, avec toujours une remise en question régulière.
5-En cas d’atrophie urogénitale,
l’utilisation de faibles doses d’estrogènes locaux est préconiséemais peu efficace en raison de la disparition des récepteurs oestrogéniques dans cette zone après la ménopause..
6-En cas de signes d’insuffisance androgénique
notamment après une annexectomie bilatérale, on pourra envisager une substitution par andro-gènes qui pourra préserver une fonction sexuelle satisfaisante.
C-Les bénéfices du traitement hormonal
1-Ils seront tout d’abord généraux : action sur les signes climatériques (bouffées de chaleur, sueurs nocturnes) et dans une certaine mesure l’atrophie urogénitale, ou sur les autres plaintes comme les douleurs articulaires, musculaires, les troubles de l’humeur et du sommeil, la baisse de la libido. Ils vont donc favoriser la qualité de vie.
2-Le traitement hormonal prévient la perte osseuse et diminue l’incidence des fractures ostéoporotiques. C’est le traitement de premier recours pour la prévention et le traitement de l’ostéoporose post-ménopausique, avant 60 ans, chez les femmes à haut risque fracturaire. Cet effet protecteur sur la densité minérale osseuse diminue après l’arrêt du traitement.
3-THM et système cardiovasculaire: depuis longtemps les études comme la Nurses’ Health Study avaient montré que l’estrogénothérapie, démarrée en début de ménopause, était cardioprotectrice, évitant la formation de la plaque d’athérome. En revanche, les mêmes estrogènes administrés plus tard vont favoriser la migration de cette plaque et seraient nocifs. On parle, dans ce cas, d’une fenêtre d’intervention (ou d’opportunité) d’efficacité du THM prescrit entre 50 et 60 ans. Les publications récentes vont toutes dans ce sens, y compris les reprises de la WHI en fonction de l’âge de prise en charge.
4-Les autres bénéfices sont:
– action sur la sphère urogénitale, notamment sur le vagin (plutôt par voie locale) mais cet effet reste minime voir nul du fait de la disparition des récepteurs aux œstrogènes dans la paroi vaginale après la ménopause ;
– action sur les cartilages, la peau, les articulations et les disques intervertébraux ;
– comme pour le système cardiovasculaire, le THM démarré tôt diminuerait le risque de maladie d’Alzheimer. En revanche, prescrit après 70 ans, il aurait un effet délétère.
D-Qu’en est-il des risques du THM?
Les dangers éventuels du THM ont du être revus à la lumière des nouvelles modalités de traitement décrites ci-dessus.
1-Le cancer du sein
Au vu des différentes études, il faut ras-surer les patientes. Il existe, bien sûr, une augmentation minime du risque de cancer du sein; mais elle est réellement minime si on la compare aux risques associés à des facteurs liés au mode de vie comme l’obésité et la consommation d’alcool. Or, les femmes étudiées au moment de la WHI étaient âgées de plus de 60 ans (moyenne 63 ans), au minimum en surpoids, voire obèses.
Toutes les études ont montré que le THM avait un rôle promoteur et non initiateur des cellules cancéreuses. Elle vient d’être confirmée par les premiers résultats de l’étude KEEPS (KEEPS site web NAMS, communications congrès, octobre 2012. ), 4 ans après son début, et par la publication de l’étude CECILE (Cordina-Duverger E, Truong T, Anger A et al. Risk of Breast Cancer by Type of Menopausal Hormone Therapy: a Case-Control Study among Post-Menopausal Women in France. PLoS ONE, November 01, 2013DOI: 10.1371/ journal.pone.0078016 ).
Des travaux menés à partir de la cohorte E3N destinée à étudier la santé de la femme (100 000 françaises de la MGEN nées entre 1925 et 1950) ont montré que la progestérone naturelle augmente peu ou pas le risque de cancer du sein par rapport aux autres progestatifs de synthèse.
Au total, l’hormonothérapie prise au début de la transition vers la ménopause pendant une courte durée (moins de cinq ans), ne donne pas de hausse du risque de cancer du sein. Si l’hormonothérapie est prise pendant plus de cinq ans, la recherche démontre que le risque du cancer du sein est à peu près le même que celui d’une femme qui consomme de l’alcool tous les jours, qui ne pratique aucun exercice ou qui présente un excès de poids considérable. Pour la HAS (2014) aucune surveillance mammaire radiologique spécifique recommandée pour les femmes sous THM qui est reconnu comme étant un facteur de risque de cancer du sein au même titre que l’alcool ou la consommation de viandes grasses.
2-Le cancer de l’endomètre
Les estrogènes employés seuls vont stimuler les cellules endométriales et être responsables d’hyperplasie pouvant évoluer vers un cancer. Il existe un effet dose. En revanche, les études américaines ont montré une diminution de ces cancers chez les femmes traitées par estrogènes conjugués équins et acétate de Médroxyprogestérone. L’emploi des stérilets à la progestérone, s’il semble être intéressant, n’est pas encore admis par tous. En France, ils n’ont pas l’AMM à ce sujet. Les SERM autres que le tamoxifène ne stimulent pas l’endomètre.
3-Les maladies cardiovasculaires et les accidents thrombo-emboliques
Les résultats de l’étude ESTHER ont montré que la voie transdermique évite le risque d’augmentation de maladie thrombo-embolique veineuse associé à la voie orale en empêchant le premier passage hépatique de l’estradiol. Le type progestatif utilisé a, ici encore, toute son importance. Progestérone naturelle micronisée, la dydrogestérone et les prégnanes ont un intérêt certain. L’obésité et la thrombophilie sont des facteurs associés importants à considérer. Au total, l’hormonothérapie à court terme pendant les dix premières années de la ménopause n’entraîne pas une hausse du risque d’accident cardiaque chez les femmes nouvellement ménopausées. Des données récentes suggèrent un effet délétère des estrogènes lorsque le traitement est démarré tard après la ménopause (après 60 ans environ). A l’inverse, lorsque celui-ci est mis en place dès la ménopause, il pourrait avoir un effet cardioprotecteur
4-Le risque d’AVC est un événement rare avant 60 ans. Le THM peut augmenter ce risque de manière significative après 60 ans. Les préparations utilisant des faibles doses d’estrogènes transdermiques n’augmentent pas ce risque. Les dernières études déjà citées vont dans ce sens.
Autres traitements
1-Un modulateur sélectif des récepteurs aux estrogènes (SERM) peut être prescrit pour traiter l’ostéoporose chez les femmes ménopausées. Le Raloxifène permet de mimer les effets de l’œstrogène au niveau de l’os tout en les inhibant au niveau du sein et de l’utérus, limitant ainsi le risque de cancer de ces organes. Cependant, cette molécule est sans effet sur le syndrome climatérique et notamment sur les bouffées de chaleur.
2-Quand aux autres produits comme les phyto-estrogènes extraits du soja par exemple, leur efficacité n’a pas été établie sur les symptômes de la ménopause et leurs risques non évalués. A ce jour, ils n’ont pas reçu l’approbation des autorités de santé et leur usage n’est pas recommandé.
3-Concernant l’inconfort lié à l’atrophie et à la sécheresse vaginale, peuvent être proposés:
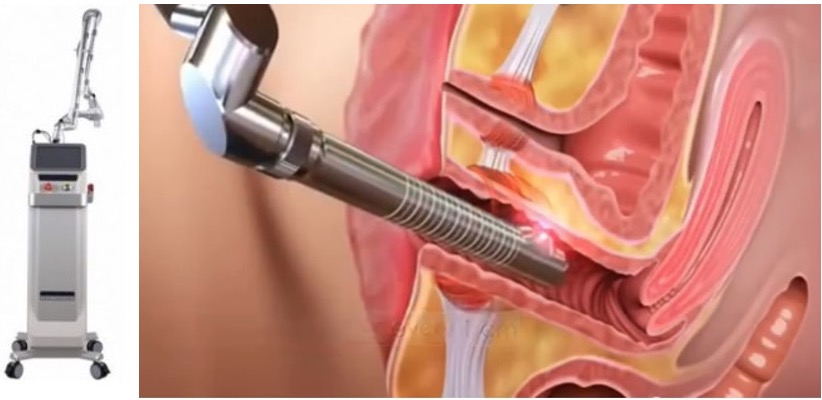
-Le laser vaginal . La méthode qui a prouvé son efficacité est le laser fonctionnant au CO2 fractionné. Les paramètres sont ajustés pour allier efficacité et bonne tolérance du geste par la patiente. Il réalise des micro-impacts laser à l’intérieur du vagin provoquant une abrasion douce de la couche superficielle des cellules vaginales. Il va réactiver les cellules fabriquant le collagène, l’acide hyaluronique, les glycosaminoglycanes et les protéoglycanes. Toutes ces molécules sont celles qui confèrent au vagin son hydratation et son élasticité. De fait, leur présence en quantité suffisante est essentielle pour offrir aux femmes une lubrification optimale. En particulier lors des rapports sexuels. une abrasion douce de la couche superficielle des cellules vaginales. Il va réactiver les cellules fabriquant le collagène, l’acide hyaluronique, les glycosaminoglycanes et les protéoglycanes. Toutes ces molécules sont celles qui confèrent au vagin son hydratation et son élasticité. De fait, leur présence en quantité suffisante est essentielle pour offrir aux femmes une lubrification optimale, en particulier lors des rapports sexuels. On peut noter une diminution voire une disparition des sensations de sécheresse vaginale après trois séances environ. Ce traitement n’est pas pris en charge par la Sécurité Sociale.
-La photobiomodulation par LED. Une LED est un composant optoélectronique qui émet de la lumière presque monochromatique lorsqu’il est parcouru par un courant électrique. Les LED sont un quasi laser mais de puissance plus faible. C’est une technique sans chaleur, sans douleur et sans contre-indication qui permet le retour à l’intégrité des fibroblastes matures et vieillissants en leur permettant de retrouver leur potentiel métabolique ( fabrication de collagène et élastine ), et a par l’intermédiaire des longueurs d’ondes bleues une action bactéricide. Le traitement se fait par sonde intra vaginale et parfois aussi par voie externe en plaçant un panneau LED a quelques centimètres de la sphère génitale. Ce traitement n’est pas pris en charge par la Sécurité Sociale.
Conclusion
Le THM induit des bénéfices et des risques qui sont individuels. Le médecin devra donc individualiser son traitement. La sécurité dépend de l’âge, du choix du progestatif, du choix de la voie d’administration des estrogènes. La notion de fenêtre d’intervention est importante à considérer si l’on se réfère à la cardio ou à la neuroprotection. Il faut réussir à trouver la dose d’estrogène la plus faible arrivant à diminuer les symptômes altérant la qualité de vie des femmes ménopausées. De nombreux experts en ménopause, dont certains étaient impliqués dans l’étude WHI, sont unanimes pour affirmer que, suite à l’étude WHI principalement, les femmes ménopausées ont été inutilement privées de la prise en considération de leur qualité de vie.
Il n’en reste pas moins vrai que concernant la qualité de vie, une vie saine avec de l’activité physique régulière, une alimentation équilibrée, une vie sociale et professionnelle motivante et un brin de coquetterie, peuvent faire aussi bien qu’un traitement hormonal (sauf sur les bouffées de chaleur) et de façon plus durable…