Le cancer de l’ovaire est la 7e cause de cancer chez la femme en incidence avec 4 430 nouveaux cas estimés en 2008. L’âge médian lors du diagnostic est de 65 ans. Le cancer de l’ovaire est la quatrième cause de décès par cancer chez la femme avec plus de 3 000 décès estimés en 2008. En effet, en raison d’un diagnostic souvent tardif, son pronostic reste sombre, trois quarts de ces cancers étant diagnostiqués à un stade avancé (stades IIIB à IV). La survie à 5 ans tous stades confondus est d’environ 45 %.
Le facteur de risque le plus important de cancer de l’ovaire est d’origine génétique. Environ 10 % des cancers de l’ovaire surviennent dans un contexte de prédisposition génétique. Ils sont alors souvent liés à une mutation des gènes BRCA 1 ou 2 et surviennent avant 60 ans. Devant un diagnostic de cancer de l’ovaire avant 70 ans ou avec un contexte familial de cancer du sein ou de l’ovaire, la recherche d’une mutation BRCA1 ou 2 est recommandée. Mais aussi sont recherchés cancer de l’endomètre ou du côlon évoquant un syndrome de Lynch . Le syndrome de Lynch, également appelé cancer colorectal héréditaire sans polypose (syndrome HNPCC), est lié à la mutation de 3 gènes MMR principaux, MSH2, MLH1 et MSH6. Il entraîne une prédisposition génétique à l’apparition d’un cancer du côlon, du rectum ou de l’endomètre. D’autres localisations sont également plus fréquentes que dans la population générale : cancers de l’ovaire, de l’estomac, de l’intestin grêle, du foie, de l’appareil urinaire supérieur, du cerveau et de la peau.
Prévention et dépistage
En dehors de la minorité de patients présentant un risque familial, il n’existe pas de méthode de dépistage du cancer de l’ovaire.
Au plan biologique, le principal marqueur est le CA125 sérique, mais il est de faibles spécificité et sensibilité.
Le dosage du CA125 n’est pas recommandé pour le dépistage du cancer de l’ovaire. Selon l’HAS, il est recommandé en bilan initial, surveillance et suivi de toutes les patientes ayant un cancer de l’ovaire.
HE4 est une glycoprotéine appartenant à la famille des WFDC2 (Whey Acidic Four Disulfide Core protein) anciennement WAP gene family, comportant des inhibiteurs de protéases. HE4 est surexprimée chez les patientes ayant un cancer de l’ovaire, même dans les premiers stades (I et II) du cancer, principalement dans les cancers de type séreux, endométroïdes et à cellules claires. Son expression est indépendante de celle du CA125, et effective dans 50 % des cancers qui n’expriment pas le CA125.
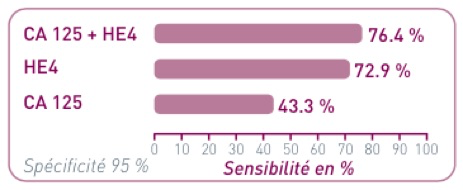
HE4 est plus sensible et plus spécifique que le CA125 et leur association offre la meilleure sensibilité de détection des cancers ovariens aux stades précoces et de leurs récidives (Moore RG et al. Gynecol Oncol 2008).
L’algorithme ROMA évalue un risque de malignité, en associant les mesures sériques d’HE4, du CA125 et le statut ménopausal. Il permet de classer les patientes selon leur niveau de risque de malignité, faible ou élevé, en tenant compte de leur statut ménopausal. Dans une étude de Moore RG (Gynecol Oncol 2009), ce risque a été correctement évalué pour 93,8 % des patientes.
Pour l’algorithme ROMA, HE4 et CA125 doivent être dosés avec la même technologie, ce qui n’autorise pas l’intégration d’un résultat transmis de CA125. Le statut ménopausal doit impérativement être précisé. La prescription doit préciser le calcul du ROMA pour qu’il soit effectué.
Indications du dosage:
Aide au diagnostic précoce de cancer de l’ovaire
Stratification du risque chez une femme ayant une masse pelvienne ou un kyste ovarien – Suivi des femmes ayant un cancer de l’ovaire : détection des récidives
Interprétation pour cette technique de dosage Chez la femme Préménopausée :
ROMA ≥ 11,4 = haut risque de cancer de l’ovaire ROMA < 11,4 = faible risque de cancer de l’ovaire
Chez la femme Postménopausée :
ROMA ≥ 29,9 = haut risque de cancer de l’ovaire ROMA < 29,9 = faible risque de cancer de l’ovaire
Pour la détection du cancer de l’ovaire : HE4 est plus performant que le CA 125, plus sensible et plus spécifique (notamment, il ne s’élève pas dans les endométrioses). Ce marqueur n’est toutefois pas totalement spécifique du tissu ovarien, ni du cancer de l’ovaire : il est surexprimé dans les cancers thyroïdiens, des glandes salivaires et de l’endomètre et son expression est forte à modérée dans les adénocarcinomes pulmonaires, mammaires et les mésothéliomes.
Chez les patientes présentant une masse pelvienne ou un kyste ovarien, le ROMA permet une meilleure évaluation du risque de cancer. Il permet de réduire le nombre d’interventions chirurgicales inutiles ou, a contrario, d’orienter rapidement une femme ayant un risque élevé vers une équipe spécialisée.
Dans le suivi des cancers de l’ovaire : HE4 est utile notamment dans les cas où le CA125 n’est pas informatif. Sa concentration sérique augmente 2 à 5 mois avant la récidive clinique.
Symptômes et diagnostic
Les symptômes du cancer de l’ovaire sont très variables.
La situation la plus fréquente est la survenue d’une ascite. Il s’agit d’une augmentation du volume de l’abdomen liée à la présence de liquide. D’autres symptômes peuvent révéler un cancer de l’ovaire, tels que des ballonnements abdominaux, des saignements gynécologiques…
Des examens radiologiques peuvent permettre d’orienter le diagnostic, c’est-à-dire de préciser l’origine de douleurs abdominales, de l’ascite…
Le bilan diagnostique commence toujours par une échographie abdomino-pelvienne avec voie endovaginale et étude Doppler.
• Soit la lésion présente des caractéristiques évidentes de malignité (ascite avec implants de carcinose), et l’examen à faire est alors un scanner (thoraco)- abdomino-pelvien avec reconstruction dans des plans coronal et sagittal qui est l’examen le plus performant pour le bilan d’extension. Les implants tumoraux des lésions de carcinose péritonéale peuvent être de taille variable et sont disséminés à toute la cavité péritonéale du diaphragme au pelvis.
Soit le diagnostic n’est pas évident en échographie (masse indéterminée ou complexe), et l’examen à réaliser alors a pour but de caractériser la tumeur. Dans ce cas, l’IRM lombo-pelvienne est l’examen le plus performant pour évaluer la nature bénigne, borderline ou maligne d’une lésion afin d’orienter les patientes dans une structure adaptée.
Il s’agit notamment de l’échographie et du scanner. Comme pour les autres cancers, le diagnostic repose sur l’examen au microscope de la tumeur (examen anatomopathologique). Compte tenu du caractère difficilement accessible des ovaires, ces prélèvements seront réalisés au cours d’une intervention chirurgicale.
Celle-ci pourra être une cœlioscopie (c’est-à-dire ne comprenant qu’une ouverture minime de l’abdomen) ou une laparotomie (ouverture large de la paroi abdominale) en fonction du geste chirurgical à réaliser par la suite. Le chirurgien prélèvera de la tumeur au cours de l’intervention et celle-ci sera analysée par le médecin anatomopathologiste pour porter le diagnostic.
Une fois le diagnostic posé, le bilan d’extension sera réalisé.
En cas d’épanchement pleural ou d’ascite, une ponction avec cytologie peut être réalisée.
Types histologiques
Les types histologiques des lésions ovariennes organiques sont représentés par :
Tumeurs épithéliales (75% des cas) :
Cystadénocarcinome séreux +++
Cystadénocarcinomemucineux
Carcinome endométroïde
Cancer à cellules claires
Tumeurs germinales :
Tumeurs germinales séminomateuses
Tumeurs germinales non séminomateuses
La dissémination des cancers ovariens
Elle se fait par différentes voies:
– par infiltration directe aux organes adjacents : utérus, recto-sigmoïde, grêle et plus rarement la vessie ;
– par voie péritonéale en suivant la cinétique de circulation du liquide intrapéritonéal.
– par voie lymphatique avec 3 voies de drainage : lomboaortique, ilio-obturatrice et inguinale. Cette extension lymphatique peut se faire de façon bilatérale aussi fréquemment au niveau pelvien qu’au niveau lombo-aortique ;
– par voie hématogène avec tardivement dans l’évolution la survenue de localisations métastatiques hépatiques, pulmonaires et cérébrales. Le pronostic de la maladie et le traitement dépendent des localisations et de l’étendue de la carcinose péritonéale.
Classification des cancers de l’ovaire

Bilan d’extension pre-thérapeutique
Celui-ci a pour objectif d’évaluer l’extension de la tumeur au niveau des organes de voisinage (trompes, utérus…), de l’abdomen, et aussi l’extension au niveau des organes à distance (poumons…). Ce bilan d’extension sera réalisé essentiellement au moment de l’intervention chirurgicale, et cherchera l’extension du cancer de l’ovaire au niveau du péritoine. Au départ on réalise un scaner.
Il cherche à préciser la topographie et l’importance de la dissémination extra-ovarienne afin d’évaluer si une chirurgie de réduction maximale est envisageable. La recherche de critères de non-résécabilité chirurgicale apparaît ici comme déterminante dans le choix de la stratégie thérapeutique ultérieure.
Bien que l’approche chirurgicale à visée de réduction tumorale maximale première soit largement à privilégier, la présence de tels indices peut conduire à opter pour une chimiothérapie néoadjuvante avec chirurgie d’intervalle. En effet, la taille des lésions résiduelles après une chirurgie de réduction maximale est un facteur primordial et indépendant du pronostic. Les lésions sont dites réséquées de manière optimale s’il n’existe plus de lésions visibles en fin d’intervention. La présence de métastases à distance (poumon, foie), d’implants volumineux sur les coupoles diaphragmatiques, surtout s’ils sont proches du confluent cavo-sus-hépatique, de localisations péritonéales au niveau du pédicule hépatique et de la racine du mésentère, de ganglions para-aortiques suprarénaux, de masses volumineuses dans le mésentère imposant des résections digestives majeures, rendent impossible ou déraisonnable une chirurgie optimale et orientent vers une chimiothérapie première.
En pratique le premier examen est l’échographie abdomino-pelvienne. Les anomalies éventuelles qu’elle montre peuvent être:
-soit de type bénin; voir ci-après la cas des tumeurs ovariennes présumées bénignes;
-soit évocatrices d’un cancer et l’on pratique un scaner thoraco-abdomino-pelvien sans et avec injection (de produit de contraste iodé);
-soit il s’agit d’une masse pelvienne indéterminée et on demande une IRM pelvienne sans et avec injection de gadolinum. Si cette dernière va dans le sens du cancer on réalise ensuite le scaner. Sinon, on se dirige vers une prise en charge adaptée.
Une mammographie est toujours réalisée.
Les marqueurs tumoraux sont: CA-125 systématique et CA 19-9 et ACE en cas de suspicion de tumeur mucineuse.
Le bilan pré-pératoire comprend: NFS/Plaquettes, TP/TCA, Groupe sanguin, Ionogramme sanguin, Urée/Créatininémie, Glycémie à jeûn, Bilan hépatique complet (Bilan d’extension), Albuminémie/Pré-albuminémie.
Traitements
Le traitement du cancer de l’ovaire dépendra de l’extension de la maladie.
Il pourra comprendre de la chirurgie et de la chimiothérapie. La radiothérapie n’est que rarement utilisée dans les cancers de l’ovaire.
En plus de la chirurgie à visée diagnostique, il est pratiquement toujours réalisé une chirurgie à visée thérapeutique. Celle-ci pourra être faite au même moment que la chirurgie à visée diagnostique, ou bien dans un deuxième temps, en général deux ou trois mois après, ou bien dans les deux temps. La chirurgie consistera en général à retirer les ovaires, l’utérus et les lésions intra-abdominales présentes.
Pour une majorité des patientes, une chimiothérapie sera administrée soit pour éviter l’apparition de lésions, soit pour faire disparaître des lésions existant au moment du diagnostic. Cette chimiothérapie sera initialement administrée pendant 6 cycles, puis la décision de stopper le traitement sera laissée à la décision de l’équipe soignante.
A-Tumeurs épithéliales
1-Chirurgie des stades I à IIIB
La chirurgie est le premier temps du traitement. L’intervention standard minimale comprend une annexectomie bilatérale avec hystérectomie totale (femme ménopausée ou femme ne désirant plus d’enfant). La stadification complète sous réserve des conditions d’opérabilité comprend au minimum une omentectomie totale, une appendicectomie surtout pour les formes mucineuses, un curage ganglionnaire pelvien et aortique infrarénal bilatéral, des biopsies péritonéales, une cytologie péritonéale.
La laparotomie médiane xyphopubienne est l’incision standard (femme ménopausée ou femme ne désirant plus d’enfant). La voie cœlioscopique est envisageable en particulier pour les stades I sous réserve de réaliser une stadification complète.
En cas de stadification incomplète lors d’une première intervention chirurgicale, une restadification chirurgicale doit être systématiquement proposée.
Chez la femme désirant une grossesse, un traitement conservateur (annexectomie unilatérale) peut être proposé pour les stades IA G1 sous couvert d’une stadification péritonéale et ganglionnaire complète négative avec curetage utérin.
Le traitement conservateur doit être exceptionnel et faire l’objet d’une discussion en RCP pour les autres stades.
2-Chirurgie des stades IIIC et 4
L’objectif de la chirurgie est la résection complète (absence de résidu macroscopique). Si la résection complète ne peut être obtenue d’emblée, une chimiothérapie néoadjuvante est réalisée : une chirurgie d’intervalle (entre 2 cures de chimiothérapie, au plus tard après la 3e cure) est ensuite envisagée, avec objectif de réaliser une résection complète.
La résécabilité doit être fondée sur un faisceau d’arguments cliniques, biologiques et d’imagerie, éventuellement complétée par une cœlioscopie et discutée dans le cadre d’une RCP. Le risque chirurgical et l’altération de la qualité de vie associés aux exérèses multiples doivent être pris en compte.
Si la réduction tumorale est incomplète lors d’une première intervention, une reprise chirurgicale pour obtenir une résection complète, avant ou en cours de chimiothérapie (après 3 cures si réponse), est réalisée.
La chirurgie permet également de faire la stadification.
3-Chimiothérapie
Les indications de la chimiothérapie adjuvante dépendent du stade, du type et du grade de la tumeur.
Sous couvert d’une stadification chirurgicale complète :
-elle n’est pas recommandée en cas de tumeur de stade IA ou IB de grade 1 (G1) ;
-elle est indiquée à partir du stade IC ou G3 ou en cas d’histologie particulière de mauvais pronostic (cancers à cellules claires) ;
-elle est discutée dans les stades IA IB G2.
La chimiothérapie standard associe généralement le carboplatine et paclitaxel pour une durée de 6 cycles.
Cette chimiothérapie peut être réalisée par voie intraveineuse seule ou exceptionnellement combinée à une chimiothérapie intrapéritonéale (stades II et III).
Il n’y a actuellement pas de recommandation d’utilisation de thérapie ciblée dans la prise en charge des cancers de l’ovaire hors essais cliniques.
4-Suivi du cancer de l’ovaire
Un suivi postopératoire est fait 1 mois après l’intervention chirurgicale, et systématiquement un suivi biologique et cardiaque en fonction des drogues utilisées pour la chimiothérapie.
Sur le plan carcinologique :
-Un examen clinique est préconisé à 3 mois puis tous les 6 mois,
-Une IRM pourra être réalisée après 6 cures de chimiothérapie (pouvant éviter une intervention de second look),
-Le dosage du CA125 à 3 mois puis à chaque consultation peut être envisagé. Le dosage du CA 125 permet d’apprécier la réponse au traitement. Cependant, une élévation isolée chez une patiente asymptomatique avec un examen normal, ne relève pas d’une chimiothérapie.
En cas de récidives, le traitement sera avant tout une chimiothérapie.
En cas de signes d’appel, des examens pourront être prescrits des examens biologiques ; des examens d’imagerie (TDM, IRM thoracique et/ou abdominale et/ou pelvienne), en deuxième intention, tomodensitométrie à émission de positons thoracique et/ou abdominale et/ou pelvienne si élévation isolée du CA-125 avec TDM normale,ou récidive en apparence isolée à la TDM et accessible à une chirurgie.
En cas de traitement conservateur : Il n’y a pas de contre-indication spécifique à un nombre limité de
stimulations ovariennes après discussion en RCP.
Une annexectomie controlatérale après l’obtention des grossesses ou à partir de l’âge de 40 ans doit être discutée.
Il n’y a pas de contre-indication spécifique à l’hormonothérapie substitutive sauf en cas de mutation des gènes BRCA 1 ou 2.
En cas de récidive, si, au cours du suivi, une récidive est détectée, la prise en charge sera discutée en RCP. Elle peut comprendre : une chirurgie, en particulier pour les patientes opérables avec récidive localisée et en rémission complète pendant plus de 12 mois après traitement initial ; une chimiothérapie, dont les modalités dépendront du délai de la récidive ;une radiothérapie, qui peut être discutée pour des localisations tumorales limitées et particulières.
B-Cas des tumeursparticulières
1-Tumeurs germinales malignes
Elles touchent essentiellement les enfants et femmes jeunes sous la forme de tumeurs principalement solides. Elles peuvent représenter une urgence thérapeutique. Elles sont très chimiosensibles. Pour décider des modalités de prise en charge, l’avis d’un centre expert est indispensable. Certaines tumeurs sont non sécrétantes. D’autres sont caractérisées par la sécrétion de marqueurs : alpha-foeto-protéine, béta-HCG, LDH.
Le traitement repose sur l’annexectomie unilatérale. L’hystérectomie et la l’annexectomie bilatérale ne sont pas indiquées chez les femmes jeunes, même dans les formes étendues et les stades avancés.
Lorsqu’elle est indiquée, la chimiothérapie comprend bléomycine, étoposide et sels de platine.
2-Tumeurs des cordons sexuels
Certaines se révèlent par des manifestations endocrines :
-sécrétions œstrogéniques responsables de métrorrhagies postménopausiques pour les tumeurs de la granulosa ;
-virilisation pour les tumeurs à cellules de Sertoli-Leydig.
Les dosages sériques spécifiques pouvant être réalisés sont :
-pour les tumeurs de la granulosa : l’Inhibine B, l’AMH et estradiolémie
-pour les tumeurs de Sertoli Leydig : hormones masculines, testostérone et delta 4 androstènedione.
Le traitement de première intention est chirurgical, radical ou conservateur en fonction de l’âge et du stade.
Lorsqu’une chimiothérapie est indiquée, elle est similaire à celle utilisée pour les tumeurs germinales.
Ces tumeurs nécessitent un suivi à long terme, des récidives pouvant apparaître au-delà de 10 ans
3-Tumeurs frontière (dites tumeurs borderline)
Il s’agit de tumeurs épithéliales de l’ovaire à faible potentiel malin pouvant se présenter sous une forme :
-limitée à l’ovaire : son traitement est alors conservateur chez les femmes jeunes sans indication de chimiothérapie ;
-avec une extension péritonéale (implants) qui peut être invasive ou non : seuls les implants invasifs peuvent nécessiter une chimiothérapie.
4-Cancer de l’ovaire en cours de grossesse
Dans le cas particulier d’une tumeur maligne ovarienne découverte lors d’une grossesse, une prise en charge spécialisée est nécessaire.