L’examen de base : le spermogramme
Le spermogramme ou spermocytogramme représente l’examen de première intention à réaliser chez l’homme en cas d’hypofertilité du couple. Il vise à étudier la composition du sperme. Le sperme est un liquide opaque, blanchâtre produit par l’éjaculation, composé de spermatozoïdes en suspension dans le liquide séminal qui est un mélange des sécrétions des différentes glandes génitales mâles (prostate, vésicule séminal…).
Procédure de recueil
Dans la plupart des cas, le sperme est recueilli par masturbation (de préférence au laboratoire) dans un récipient stérile qui vous sera fourni. Une période d’abstinence de 3 jours est recommandée. Ces deux à trois jours sont aussi recommandés pour les inséminations ou la FIV. Il convient de se laver les mains soigneusement et de réaliser une toilette intime avant le recueil (de l’eau et du savon). A titre exceptionnel, il est possible de réaliser le recueil chez soi et d’apporter le prélèvement ensuite. Il convient de bien respecter les instructions (notamment en termes de délai) afin de ne pas fausser le test. En règle général, le prélèvement doit être gardé au chaud (à 37°c) et apporté au laboratoire dans un délai de 30 minutes. La première partie de l’éjaculation qui est constitué des sécrétions prostatiques et épididymaires contient la grande partie des spermatozoïdes (jusqu’à 80 % de la totalité des spermatozoïdes contenus dans l’éjaculât) d’où l’intérêt, dans certaines situations de fragmenter l’éjaculât et garder le premier jet qui est riche en spermatozoïdes dans un flacon et le reste dans un deuxième flacon. Dans certains cas le sperme peut être obtenu par vibromassage ou par électro-éjaculation réalisée chez certains paraplégiques initiés en centre. Enfin, dans certain cas d’éjaculation rétrograde (éjaculation dans la vessie) on peut trouver des spermatozoïdes dans le premier jet d’urine. En cas d’azoospermie, une intervention est nécessaire pour recueillir le sperme au niveau des canaux déférents, de l’épididyme ou des testicules.
Les paramètres du spermogramme
Différents paramètres vont alors être étudiés:
1 -La viscosité
le sperme doit se liquéfier en moins de 30 minutes à 37°c. La viscosité s’évalue après liquéfaction en faisant goutter le sperme à partir d’une pipette. Une viscosité anormalement élevée, lorsque les gouttes forment des filaments de plus de 2cm peut gêner la la numération des spermatozoïdes, la mesure de leur mobilité et la recherche d’anticorps anti-spermatozoïdes.
2-Le volume
le volume de l’éjaculat doit normalement être compris entre 2 et 6 ml. Un volume trop faible ou trop élevé témoigne d’un dysfonctionnement de la prostate et des vésicules séminales, et compte tenu de l’interaction entre le plasma séminal et les spermatozoïdes on peut facilement imaginer un effet délétère sur la mobilité et sur le pouvoir fécondant.
3-Le pH (ou degré d’acidité du sperme)
Il est généralement compris entre 7,2 et 8 et dépend de la sécrétion des glandes annexes. Un pH acide inférieur à 6,5 témoigne d’un défaut du fonctionnement des vésicules séminales, des déférents ou des épididtmes , dont les secrétions ont un pH basique, contrairement à celles de la prostate comprise entre 6,5 et 7. Un pH alcalin, >8, peut donc orienter vers une prostatite chronique avec altération quantitative et qualitative des secrétions prostatiques. Dans le cas de l’absence bilatérale congénitale des canaux déférents « où il existe une absence des vésicules séminales », on a un sperme constitué seulement de sécrétions prostatiques acides et azoospermiques.
4-La numération des spermatozoïdes
Le nombre de spermatozoïdes, est classiquement de 20 à 200 millions par millilitre et supérieur à 40 millions par éjaculat. Ces normes ont été revues par l’OMS en mai 2010 et la numération normale de spermatozoïdes dans l’éjaculât est maintenant supérieure à 15 millions/ml et supérieure à 39 millions par la totalité de l’éjaculât.
a-L’oligospermie
On parle habituellement d’oligospermie lorsque la quantité est inférieure à 20millions/ml ou inférieure à 40 millions par éjaculât. Elle est qualifié de sévère si les spermatozoïdes sont inférieurs à 5 millions par ml. Dans les , nouvelles normes de l’OMS -mai 2010, l’oligozoospermie correspond à une numération de spermatozoïdes inférieure ou égale à 15 millions spermatozoïdes/ml.
b-La polyspermie On parle de polyspermie ou polyzoospermie lorsque la concentration dépasse 200 millions/ml, voire 250 millions pour certains auteurs.
c-L’azoospermie
On parle d’azoospermie lorsqu’aucun spermatozoïde n’est retrouvé dans 3 spermogrammes consécutifs réalisés à 3 mois d’intervalle. On distingue :
-L’azoospermie sécrétoire, ou azoospermie non obstructive, si l’anomalie est une absence totale de la spermatogenèse qui se déroule dans le testicule, au niveau des tubes séminifères, l’origine de l’altération de la spermatogenèse peut être soit une affection testiculaire primitive congénitale ou acquise ; soit une insuffisance hypothalamo-hypophysaire acquise congénitale.
-L’azoospermie excrétoire, ou azoospermie obstructive si la spermatogenèse est conservée mais les spermatozoïdes ne sont pas excrétés dans le sperme en raison de la présence d’un obstacle au niveau des voies excrétoires (épididymes, canaux déférents, canaux éjaculateurs). Les lésions peuvent être acquises ou congénitales comme l’absence bilatérale des canaux déférents.
d-La cryptozoospermie
Enfin, on parle de cryptozoospermie lorsque l’on observe pas de spermatozoïdes à l’examen microscopique direct d’une goutte de sperme mais à l’opposé de l’azoospermie, une recherche approfondie permet d’en retrouver quelques uns (moins de 100 000 spermatozoïdes dans la totalité de l’éjaculât). La cryptozoospermie est dite sévère quand le nombre de spermatozoïdes est inférieur à 10 000 spermatozoïdes dans l’éjaculât ; La cryptozoospermie est modérée quand le nombre de spermatozoïdes est situé entre 10 000 et moins de 100 000 spermatozoïdes dans l’éjaculât ; La cryptozoospermie est une entité nouvelle qui n’a pris de l’intérêt que depuis l’apaparition de la technique de l’ICSI (Intra Cytoplasmic Sperm Injection) car avec cette technique, il suffit de quelques spermatozoïdes éjaculés ou prélevés dans l’épididyme ou du testicule, et indépendamment de la concentration et de la mobilité spermatique, pour obtenir une fécondation et une grossesse. L’apparition de la nouvelle technique de l’IMSI (Intra Cytoplasmic Morphologcical Sperm Injection) qui permet de faire une sélection très poussée des meilleurs spermatozoïdes dans l’éjaculât et d’augmenter de façon significative les chances d’obtenir de fécondation et de grossesse à partir de sperme cryptozoospermique.
5-Les cellules rondes
Ces cellules rondes forment en fait un groupe hétérogène composé de cellules urétrales, germinales et de leucocytes. Leur concentration est normalement inférieure à 5millions/ml. Les cellules germinales sont les cellules de base qui évoluent vers le spermatozoïde après une transformation complexe. Le pourcentage de ces cellules dans le sperme ne doit pas dépasser 10%. Un taux supérieur doit faire penser à un trouble de la synthèse des spermatozoïdes.
6-Le taux de globules blancs
Le taux de globules blancs (ou leucocytes) dans le sperme doit être inférieur à 1 million par ml. C’est un marqueur de l’existence d’une infection (leucospermie). Une leucospermie n’est pas forcément la traduction d’une infection génitale, mais il faut bien sûr la rechercher, et à l’inverse une infection génitale ne s’accompagne pas toujours de leucospermie. On parle parfois de taux de cellules dites rondes.
7-Les agglutinats: La présence de spermatozoïdes agglutinés dans le sperme doit faire rechercher des anticorps anti-spermatozoïdes. Les agglutinats correspondent un rassemblement (accolement) de plusieurs spermatozoïdes vivants ensemble soit au niveau des têtes, des pièces intermédiaires, des flagelles ou de façon mixte. Les agglutinats s’expliquent par la présence de spermatozoïdes vivants et porteurs des anticorps anti-spermatozoïdes. Leur présence doit donc faire rechercher l‘existence d’anticorps anti-spermatozoïdes. Les agglutinats de spermatozoïdes doivent être différencié des agrégats de spermatozoïdes, qui sont la réunion et l’accolement de plusieurs spermatozoïdes morts ensemble.
8-Vitalité La vitalité ou le pourcentage des spermatozoïdes vivants à l’éjaculation doit être égale ou supérieur à 75 % ; Selon les normes normales de l’OMS (1999) : le pourcentage des spermatozoïdes vivants doit être égale ou supérieur à 60 %. Selon les nouvelles normes de l’OMS de mai 2010, le pourcentage des spermatozoïdes vivants dans l’éjaculât doit être égal ou supérieur à (58 %) de l’ensemble des spermatozoïdes. Si aucun spermatozoïde n’est vivant, on parle de nécrozoospermie. Elle peut être due à une infection ou un problème oxydatif.
9-La Mobilité
La mobilité des spermatozoïdes s’observe à différents temps :
– 1 heure après le recueil: 50% minimum de spermatozoïdes doivent être mobiles.
– 3 heures après le recueil, 30% minimum de spermatozoïdes doivent être mobiles.Selon les normes de l’OMS-1999, dans l’éjaculât, au moins 50 % spermatozoïdes doivent avoir une mobilité normale (catégories a+b), et aussi, dans l’éjaculât, au moins 25 % des spermatozoïdes doivent avoir une mobilité de catégorie « a ». Selon les nouvelles normes de l’OMS de mai 2010, dans l’éjaculât, au moins 30 % spermatozoïdes doivent avoir une mobilité normale (catégories a+b), et aussi, dans l’éjaculât, au moins 40 % des spermatozoïdes doivent avoir une mobilité de catégorie « a+b+c ». La mobilité diminuée (asthénie) peut avoir trois origines :
– une malformation au niveau du flagelle (non corrigeable) et ceci est interprétable à partir de la description des anomalies (spermocytogramme): flagelles enroulés, angulation, pièce intermédiaire grêle etc. ou visible uniquement en microscopie électronique (après un grossissement de 1 million de fois ; on parle alors d’anomalies ultra structurales -pathologie rare)
– la présence d’anticorps anti-spermatozoïdes dirigés et fixés sur le flagelle ce qui modifie l’amplitude du battement flagellaire et donc sa progressivité
– la mauvaise qualité du plasma séminal (spermatozoïde bien constitué, pas d’anticorps). Le fait de placer les spermatozoïdes dans un milieu synthétique riche et approprié permet alors de booster la mobilité, d’augmenter le pourcentage de bonne mobilité et d’utiliser l’insémination intra utérine plutôt que la FIV.
10-Le pourcentage de formes normales
Le pourcentage de spermatozoïdes de forme normale doit être au moins de 30% (normes OMS 1999). On parle de tératospermie pour une valeur inférieure. En dessous de 12% de formes typiques, la seule alternative est la FIV avec micro injection (FIV-ICSI).
11-En bref D’après les nouvelles normes de l’OMS, un sperme « normal » doit avoir un volume spermatique compris entre 2 et 4 ml. Le nombre de spermatozoïdes doit être supérieur à 15 millions/ml ou à 39 millions/éjaculat. la mobilité a+b supérieure à 30% et le pourcentage des formes normales supérieur à 15% . La vitalité doit être sup. à 58%. Enfin, le nombre de leucocytes inf. à 1 millions/ml.
12- Prise de rendez-vous pour un spermogramme. Quelques règles sont à respecter
-Toujours faire 2, voire 3 spermogrammes à 2 mois environ d’intervalle, même en cas d’azoospermie. Il a été prouvé qu’il existait, dans des conditions parfaitement normales, des fluctuations importantes des différents paramètres du sperme. Ceci résulte des conditions de prélèvement, du délai d’abstinence et de l’imprécision de certaines mesures. Toute interprétation est donc difficile sur une seule mesure. Un spermogramme déficient devra donc être renouvelé au minimum 3 mois plus tard (car la durée de la spermatogénèse et du transport des spermatozoïdes dans les différents canaux est estimée à 3 mois) pour confirmer ou infirmer le résultat.
-En cas de cryptozoospermie, il peut y avoir intérêt à répéter les spermogrammes afin d’obtenir par congélation une plus grande quantité de spermatozoïdes.
Interrogatoire et examen clinique
Devant une oligoasthénotératospermie, on s’enquiert d’antécédents de maladie sexuellement transmissible, de grossesses antérieures avec une autre partenaire, de chirurgie abdomino-pelvienne ou testiculaire, de maladie chronique ou héréditaire anomalie uro-génitale, troubles sexuels régularité des rapports sexuels, durée de vie commune profession prise de toxiques (tabac, alcool, drogues) date de début du désir de grossesse. On recherche la prise de certains médicaments ou drogues agissant sur la qualité du sperme, la quantité, ou sur le comportement sexuel :
-par inhibition hypophysaire : testostérone, analogues GnRH, stéroïdes anabolisants
-ou par ffets anti-androgéniques : Cimétidine, spironolactone,
ou par-par anéjaculation : antidépresseurs, phénothiazines, bétabloquant
-ou par dysfonctionnement érectile : bétabloquants, diurétiques thiazidiques, metoclopramine
-ou Drogues : cannabis, héroïne, cocaïne.
-Le tabac, le stress et la chaleur, peuvent participer à l’infertilité masculine. La température est un paramètre important dans la formation des spermatozoïdes. En effet, la formation des spermatozoïdes n’est pas possible si la température est trop élevée ; c’est pour cette raison que les testicules se trouvent dans les bourses, à une température inférieure à celle du reste du corps. Il existe des anomalies de migration des testicules : il s’agit de la cryptorchidie.
-Les médicaments anticancéreux ainsi que les radiations ont, dans la plupart des cas, une grande toxicité vis à vis des spermatozoïdes ou de leurs cellules d’origine. Dans ce cas il est recommandé d’effectuer une congélation d’un stock de spermatozoïdes avant le traitement, si l’on désire procréer plus tard.
L’examen de l’appareil génital externe note l’aspect des testicules ainsi que leurs taille, du pénis, de la prostate. La présence ou non des canaux déférents. On note l’existence ou non d’un varicocèle. C’est aussi, la taille, le poids et l’appréciation des caractères sexuels secondaires (aspect de la pilosité pubienne et axillaire, développement des seins). Cet examen est complété par un toucher rectal évaluant la prostate et les vésicules séminales, ainsi que l’examen des seins à la recherche d’une gynécomastie, et l’étude de la pilosité et des caractères sexuels secondaires (verge et méat urétral).
L’échographie est le prolongement de l’examen clinique. L’écho-doppler scrotale systématique permet l’étude du parenchyme testiculaire, des veines spermatiques et des épididymes. Deux autres échographies sont pratiquées si nécessaire : l’échographie endorectale pour l’étude des vésicules séminales, des ampoules déférentielles, des canaux éjaculateurs et de la prostate, et échographie des reins.
Le test de migration-survie des spermatozoïdes
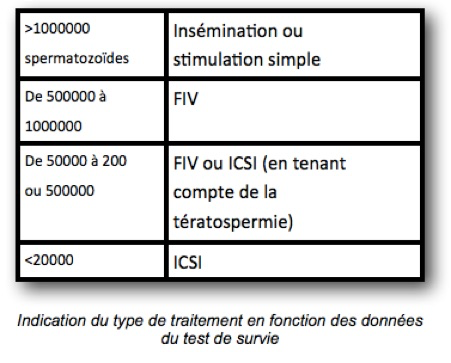
Le test de survie a pour but de sélectionner des spermatozoïdes mobiles à morphologie normale et d’éliminer le plasma séminal ainsi que des cellules épithéliales . Le nombre total de spermatozoïdes mobiles, récupérable dans l’éjaculat, a une valeur indicative pour le choix de la technique d’ AMP : insémination intra utérine, Fécondation in Vitro avec ou sans micro injection( ICSI) Ce test consiste à réaliser une centrifugation, à éliminer le plasma séminal, tous les éléments autres que les spermatozoïdes (cellules spermatiques, globules blancs, bactéries..) et à récupérer le maximum de spermatozoïdes bien formés et bien mobiles. Ceux ci sont ensuite incubés dans un milieu synthétique « capacitant » c’est-à-dire apte à les rendre fécondants. Les spermatozoïdes sont alors comptés, la mobilité de nouveau analysée, ainsi que le pourcentage de formes typiques. La survie à 20 h dans ce milieu (utilisé pour la FIV ) est également étudiée, car il est nécessaire que les spermatozoïdes y survivent pendant un certain nombre d’heures si l’on veut que la fécondation in vitro soit possible. A partir des résultats et après traitement de 1ml de sperme, on considère que:
1) si l’on dispose après sélection d’au moins 1 million de mobiles rapides directionnels typiques dans 300 micro litres (ces 300 micro litres correspondent en fait à la quantité maximale de liquide injectable dans la cavité utérine), on peut envisager des inséminations intra-utérines;
2) Que jusqu’à 90 000 mobiles rapides directionnels typiques dans 300 micro litres, c’est une indication de FIV,
3) qu’en dessous de cette dernière valeur, et /ou si moins de 20 % de mobilité directionnelle, et /ou si moins de 12 % de formes typiques: indication d’ICSI.
Chaque centre d’ AMP peut cependant avoir des critères de choix très légèrement différents, ces valeurs ne sont donc communiquées qu’à titre indicatif.
La recherche d’anticorps anti spermatozoïdes : MAR-test
Actuellement la recherche d’anticorps anti spermatozoïdes se fait par le MAR-test.
Signes d’appel
On devra suspecter la présence d’anticorps anti-spermatozoïdes sur la présence d’agglutinats sur le spermogramme, une nécrozoospermie, un test post-coïtal anormal, une infertilité inexpliquée, certains antécédents chez l’homme (vasectomie, inflammation, obstruction mécanique, traumatisme de la région périnéale, varicocèle, intervention chirurgicales, HIV+. Mais parfois, il n’y a rien et la notion d’anticorps est évoquée à la suite de plusieurs échecs de FIV.
Le problème est que beaucoup d’hommes sont porteurs d’auto-anticorps, sans que pour autant ils soient infertiles. On estime que 1% des hommes fertiles sont porteurs d’anticorps et 3 à15% des hommes infertiles. Le plus difficile est l’interprétation du MAR-test car le résultat s’exprime en pourcentage et il est très souvent positif, mais seul un MAR-test montrant plus de 90% de spermatozoïdes porteurs d’anticorps doit obligatoirement imposer un traitement spécial. Ce traitement est de recourir à l’ICSI et non pas à la FIV classique.
En résumé :
-Le test est dit positif si plus de 20% de spermatozoïdes sont porteurs d’anticorps.
-A partir de 50% de spermatozoïdes porteurs d’anticorps, on peut considérer qu’il s’agit d’un facteur d’infertilité mais sans qu’il s’agisse de la véritable cause.
-Au-delà de 90% de spermatozoïdes porteurs d’anticorps, il est impératif de recourir à l’ICSI.
Il existe d’autres tests qui sont maintenant moins utilisés :
-Le test aux immuno-billes : consiste à détecter directement sur les spermatozoïdes et localiser la région sur laquelle les anticorps anti spermatozoïdes sont fixés. Il faut au moins 100 spermatozoïdes mobiles pour réaliser le test.
-Le dosage des anticorps anti spermatozoïdes dans le plasma séminal et la circulation sanguine.
Le bilan hormonal
Si le spermogramme indique un problème, d’autres tests peuvent alors inclure des analyses de sang pour les éléments suivants: FSH,LH, testostérone, Prolactine et parfois AMH.
1-L’Hormone Folliculo-Stimulante (FSH)
Ses valeurs normales chez l’adulte vont de 3 à 15UI/l. La LH est entre 2 et 12UI/l. Le dosage, basal ou sous Gn-RH, de cette hormone est utile dans les cas d’azoospermie ou oligospermie sévères, pour savoir si elles sont d’origine sécrétoire. Mais certaines causes des azoospermies sécrétoires n’induisent pas d’augmentation de FSH. Dans ces cas là, la biopsie testiculaire pour montrer l’absence de spermatozoïdes est donc nécessaire. L’augmentation de FSH peut être la conséquence d’une insuffisance testiculaire primitive : c’est le testicule lui-même qui est atteint et on a un défaut de production de spermatozoïdes et de testostérone (l’hypophyse ne reçoit pas de signe de bonne sécrétion des spermatozoïdes par les testicules (testostérone) et elle augmente alors la production de FSH pour aller les stimuler).) On note aussi une augmentation de FSH dans l’atteinte isolée des tubes séminifères. Un taux inférieur peut être le signe d’un hypogonadisme via une insuffisance hypophysaire (insuffisance testiculaire secondaire : le testicule ne reçoit pas le signal lui indiquant de fabriquer les spermatozoïdes). Pour distinguer un hypogonadisme primaire à une insuffisance secondaire résultant d’un déficit hypothalamo-hypophysaire, on fait un test à la LHRH (on dose la FSH après l’administration de LHRH). Si, au cours de ce test, la FSH est augmentée, on est face à une insuffisance testiculaire primitive avec trouble de la spermatogenèse. En pratique, le dosage de FSH est utile en cas d’azoospermie ou d’oligospermie sévère (<5millions/ml). Il n’a pas d’intérêt si la concentration en spermatozoïdes est supérieure à 5 millions et le volume testiculaire normal.
2-L’Hormone lutéinisante (LH)
Lorsque le niveau de testostérone est bas, l’hypophyse libère la LH qui transmet aux testicules de faire plus de testostérone. La valeur normale est de 1 à 9 UI/L. Un niveau anormalement élevé indique le fait que les testicules sont absents ou ont été enlevés, que les testicules ne fonctionnent pas, ou la présence du syndrome de Klinefelter. Un niveau anormalement bas peut indiquer une anorexie nerveuse, la défection de la glande hypophyse, des dommages à l’hypothalamus, le stress, ou un faible poids corporel.
3-La testostérone
La testostérone circule dans le sang liée à une protéine. Pour compléter le dosage de la testostérone, on peut doser aussi la testostérone libre (qui n’est pas fixée sur la protéine de transport ; c’est cette forme qui agit sur les tissus). Les insuffisances testiculaires et hypophysaires ont pour conséquence une diminution du taux de testostérone. Certains traitements hormonaux (anti-androgènes, œstrogènes, androgènes de synthèse) sont aussi responsables de la diminution du taux circulant de testostérone. Les augmentations sont observées chez les patients traités par de la testostérone, en cas d’hyperthyroïdie et dans le syndrome des testicules féminisants (les testicules sont insensibles à l’action de la testostérone). Il vaut mieux éviter l’effort physique avant le prélèvement, car celui-ci augmente le taux de testostérone circulant ; il est conseillé de le faire le matin
4-La prolactine
Valeurs de référence: Entre 60 et 450 mUI/L (2 et 15 ng/L) . Un taux bas de prolactine s’observe essentiellement chez les personnes traitées par des médicaments dopaminergiques (levodopa, corticostéroïdes, etc.). L’augmentation s’observe chez des hommes présentant des baisses de libido ou dans les cas d’hypoandrogénisme (=faible expression des caractères sexuels secondaires) associée à des taux faibles de FSH et de testostérone. . Elle peut avoir des causes variées : une prise de médicaments : neuroleptiques et antidépresseurs, antiémétiques, antihistaminiques, etc., l’anorexie mentale, une tumeur hypophysaire, des troubles endocriniens divers (acromégalie, hypothyroïdie primitive, syndrome de Cushing, insuffisance rénale ou hépatique, etc.). Remarque : la sécrétion de prolactine est influencée par le stress. Il convient d’éviter l’effort physique avant le prélèvement.
5-L’œstradiol
Le dosage de l’œstradiol dont la normale va de 10 à 40ng/ml est indiqué en cas de gynécomastie. Un taux anormal fait rechercher une imprégnation exogène ou une cause tumorale (testicule, surrénale).
6-l’inhibine B
L’inhibine B est secrétée par les cellules de Sertoli et sa sécrétion est régulée par interaction avec les cellules germinales. Elle constitue un marqueur de la spermatogenèse. Son taux chez l’homme fertile est normalement de 94 à 327pg/ml.
7-le dosage de l’AMH (Hormone Antimüllérienne)
L’AMH est synthétisée par les cellules de Sertoli dès la différentiation de la gonade et par les cellules de Leydig chez l’adulte. A partir de la puberté, sa sécrétion, freinée par la testostérone, devient indétectable dans le sang circulant mais demeure en quantité significative dans le plasma séminal. C’est ainsi que chez l’enfant, le dosage de l’AMH dans le sang est utile en cas de cryptorchidie car sa positivité témoigne de l’existence de tissu testiculaire. Par contre, chez l’adulte, l’AMH sera dosée dans le plasma séminal (et non dans le sang) où sa présence est considérée comme un bon marqueur de la spermatogenèse en cas d’azoospermie non obstructive. VI-Echographie-doppler testiculaire Cet examen permet la recherche d’un varicocèle, mesure les testicules et visualise les épididymes et les déférents.
La biochimie du sperme
Elle donne une indication sur le niveau d’obstruction des voies spermatiques par l’absence de la sécrétion d’amont dans le sperme. Ainsi, en pratique :
-pour les vésicules séminales : le fructose ; -pour la prostate : les phosphatases acides , le zinc, le citrate (ou acide citrique) ;
-pour l’epididyme : l’alpha-glucosidase et la L-carnitine.
Le bilan infectieux
Au niveau sanguin, il comprend de manière obligatoire en cas de procréation médicalement assistée les sérologies pour HIV, hépatite B et C, syphilis. Ce bilan doit être renouvelé au bout d’un an.
Le sperme peut être mis en culture pour rechercher la présence d’éventuels agents infectieux. C’est la spermoculture. Elle est demandée dans les anomalies du spermogramme, dans les anomalies des dosages biochimiques du sperme et les antécédents infectieux de l’appareil urinaire et génital. La spermoculture est positive lorsqu’on met en évidence une bactérie pathogène avec un nombre de colonies égale ou supérieur à 1000 bactéries/ml. On considère que la normalité de la spermoculture est valable trois mois.
L’analyse génétique
Le caryotype masculin doit être systématiquement demandé lorsque le spermogramme est inférieur à 5millions/ml. Il peut cependant être intéressant au dessous de 10millions/ml. Il est anormal chez 4% de l’ensemble des hommes infertiles. Il peut s’agir d’anomalies de nombre ou de structure des chromosomes, de microdélétions du chromosome Y et des mutations du gène CFTR (=Cystic Fibrosis Transmembrane conductance Regulator).
Les anomalies chromosomiques numériques et structurales
On considère qu’elles concernent près de 6% des hommes oligospermiques (c’est-à-dire possédant moins de 10 millions de spermatozoïdes /ml), et près de 20% des hommes ayant une azoospermie non obstructive. On distingue les anomalies portant sur les gonosomes (=chromosomes sexuels) et celles portant sur les autosomes (=autres chromosomes).
1-Les anomalies gonosomiques (=des chromosomes sexuels)
a-Anomalies de nombre
On parle d’aneuploïdie. Ces aneuploïdies sont essentiellement représentées par le syndrome de Klinefelter où un individu de phénotype masculin aura un chromosome X en trop avec une formule chromosomique 47 XXY. Des situations dites de mosaïcisme existent, par exemple 46XY/47XXY ou seul un pourcentage de cellules est porteur de l’anomalie. Dans sa forme complète, le syndrome de Klinefelter associe une gynécomastie, de petits testicules et une azoospermie. La présence de spermatozoïdes est cependant possible dans certaines formes.
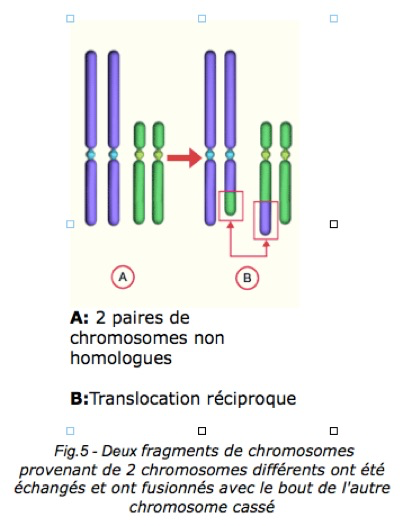
b-Translocations autosomes-gonosomes
Il s’agit d’un échange de segment entre deux chromosomes. Une translocation est une anomalie chromosomique au cours de laquelle un chromosome ou un fragment de chromosome vient se souder à un autre chromosome. La translocation est équilibrée lorsque le phénotype de l’individu est normal : il n’y a alors ni perte , ni gain de matériel génétique. Si cet échange s’accompagne d’une perte de matériel génétique, il est déséquilibré.
-La translocation réciproque entre l’X et un autosome engendre systématiquement une infertilité masculine.
-La translocation entre l’Y et un autosome est rare. Elle affecte la fertilité seulement si elle est déséquilibrée.
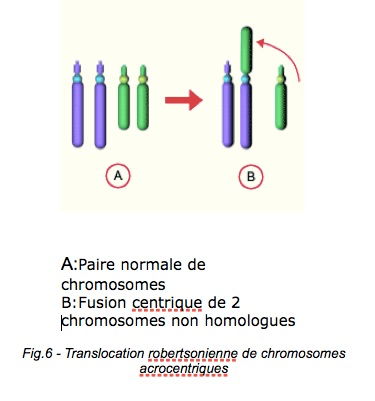
2-Les anomalies autosomiques
a-Les translocations robertsoniennes ont un impact variable sur la fertilité.b-Les translocations réciproques ont un impact sur la fertilité. c-les inversions ont également un impact. d-Les aneuploïdies autosomiques (anomalies de nombre portant sur les autosomes) favorisent des diploïdies et disomies des chromosomes 13 ou 21, ce qui a une conséquence sur l’enfant potentiel.
Les microdélétions du chromosome Y
Les micro délétions du chromosome Y représentent une des causes génétiques les plus fréquentes de l’infertilité masculine. Cette cause concerne plus précisément les azoospermies ou oligozoospermies sévères d’origine sécrétoire. Ces micro délétions portent sur une partie du bras long du chromosome Y (Yq), appelée locus AZF (Azoospermia Factor). Au sein du locus AZF, on distingue les sous régions AZFa, AZFb et AZFc sur lesquelles portent les micro délétions par ordre de fréquence croissant. Les délétions peuvent être situées sur une ou sur plusieurs régions.
La recherche de micro délétions du chromosome Y est a envisager pour tous les patients ayant moins de10 millions de spermatozoïdes/ml. Le diagnostic est fait par caryotype sanguin (effectué par simple prise de sang) avec PCR (amplification des gènes concernés). Il n’existe pas de signes cliniques visibles ou d’autres symptômes chez les hommes porteurs de délétions du chromosome Y, en dehors de l’infertilité.
Une biopsie testiculaire permet la recherche de spermatozoïdes dans le testicule, en cas d’azoospermie. Les profils histologiques sont variables en fonction de la région sur laquelle portent les délétions :
-Sous région AZFa : absence totale des cellules de la lignée germinale (Sertoli cell only syndrome, de type I).
-Sous région AZFb : arrêt de maturation de la spermatogenèse au niveau spermatocytaire (Spermatogenic Arrest).
-Sous région AZFc : plusieurs tableaux sont possibles, allant de l’azoospermie avec présence de quelques cellules germinales à la biopsie testiculaire (Sertoli cell only syndrome, de type II) à une oligozoospermie. Les chances de retrouver des spermatozoïdes à la biopsie testiculaire dans ce cas est d’environ 50 %.
Les délétions complètes des régions AZFa, AZFb, AZFb+c sont toujours associées à une azoospermie. En cas de délétions partielles, il est possible de retrouver une oligozoospermie sévère.
Chez la plupart des hommes infertiles présentant cette micro délétion, la micro délétion est apparue de novo, c’est-à-dire que leurs pères ne portaient pas la micro délétion. Par contre, la technique ICSI permettant à ces hommes d’avoir des enfants, toute leur descendance mâle sera porteuse de la micro délétion. Le mode de transmission est qui est lié au chromosome Y ne se transmet donc qu’aux garçons, avec une pénétrance variable (le pourcentage d’expressivité de la maladie est variable). Les délétions héritées du père sont des cas encore rares à cause de l’infertilité qu’elles provoquent, de la faible chance de conception spontanée et du caractère récent des techniques ICSI.
Lorsque des spermatozoïdes matures sont retrouvés dans le sperme ou dans le testicule (par biopsie testiculaire) il est en effet possible d’avoir recours aux techniques de procréation médicalement assistée de type ICSI (Intracytoplasmic Sperm Injection) avec sperme éjaculé ou avec sperme testiculaire. Si l’enfant à naître est un garçon, il peut donc hériter les délétions du chromosome Y et présenter également une infertilité une fois arrivé à l’âge adulte.
Le couple doit bénéficier d’une consultation de conseil génétique avant d’être inclus dans un protocole d’assistance médicale à la procréation par ICSI. Certains points seront alors évoqués :
-Peu de recul afin d’identifier les risques encourus de ces techniques dans ce contexte.
-Risque de stérilité pour les enfants de sexe masculin.
-Nécessité d’un suivi de ces enfants après la naissance.
-La détection de micro délétions du chromosome Y représente une indication possible de l’autoconservation de spermatozoïdes, compte tenu de l’aggravation des altérations des spermatozoïdes avec l’âge. Leur conservation pour une future paternité doit donc être proposée le plus tôt possible. Par voie de conséquence, il y a Intérêt d’une congélation préventive du sperme de fils d’un homme porteur de délétions du chromosome Y après la puberté afin de préserver ses possibilités de concevoir.
En l’absence de spermatozoïdes retrouvés, le couple peu avoir recours à une insémination artificielle ou à une fécondation in vitro avec sperme de donneur.
L’agénésie bilatérale des canaux déférents
L’agénésie bilatérale des canaux déférents est responsable d’une stérilité masculine par azoospermie excrétoire et représente 1 à 2% de l’ensemble des stérilités masculines. Cette forme de stérilité peut bénéficier maintenant d’un programme de fécondation in vitro utilisant un prélèvement de sperme épididymaire qui impose un conseil génétique en raison d’une parenté génétique avec la mucoviscidose.
La mucoviscidose est la plus fréquente des maladies génétiques en Occident.. Il s’agit d’une maladie autosomique récessive. Récessive, cela signifie qu’il faut que les gènes provenant des deux parents soient anormaux pour que la maladie soit présente. Hommes et femmes sont donc indifféremment atteints. Une personne sur 25 de la population caucasienne est porteuse de la mutation génétique de la mucoviscidose dans ce gène sans que la maladie soit présente. On dit qu’il s’agit de porteurs sains. La maladie a été définie en 1938. Le gène malade est situé sur le bras long du chromosome 7. Ce gène sert normalement pour la fabrication d’une protéine située sur la membrane des cellules, appelée protéine CFTR. Cette protéine possède de multiples fonctions dont certaines sont encore inconnues mais globalement elle agit comme un petit canal laissant passer les ions (Chlore, sodium…). Le mauvais fonctionnement de ce canal aboutit à un épaississement de toutes les sécrétions de l’organisme (bronchiques, digestives, génitales…). Cette protéine est présente sur de nombreux organes, ce qui explique que la maladie atteigne plusieurs sites. L’atteinte la plus fréquente est celle de l’appareil respiratoire (dans plus de 90 % des cas). Il existe également (chez 80 à 90 % des patients atteignant l’âge adulte) une insuffisance pancréatique externe (l’absence de sécrétions de sels biliaires) se traduisant par une mauvaise digestion des graisses. Cela entraîne des troubles digestifs (le plus souvent une diarrhée graisseuse) et un retard de croissance et de poids chez l’enfant, une carence en vitamines. On peut voir apparaître un diabète sucré chez 20 % des adultes. Enfin, plus de 95 % des hommes sont stériles. Il existe un très grand nombre de types de mutations de ce gène CFTR. En 2002, près de 1300 mutations du gène CFTR avaient été identifiées. Elles sont réparties en 5 classes. Les mutations de classe 1 à 3 sont dites sévères car elles entraînent une perte totale de la fonction CFTR. Les mutations de classe 4 et 5 entraînent une perte partielle de cette fonction et sont dites atténuées ou modérées.
L’agénésie bilatérale des canaux déférents est une forme incomplète de la mucoviscidose. Elle s’associe en effet presque toujours à la découverte d’au moins une mutation du gène CFTR et cela à priori chez des hommes en bonne santé (porteurs sains). Cliniquement, elle est caractérisée par une régression bilatérale de sections variables des épididymes, des canaux déférents et le plus souvent d’une anomalie des vésicules séminales. Cependant une certaine proportion de ces hommes peut présenter des signes cliniques atténués de mucoviscidose.
Cette obstruction sur les voies génitales entraîne une azoospermie responsable de l’infertilité de ces hommes. La production des spermatozoïdes au niveau testiculaire est cependant souvent normale ce qui permet d’envisager une fécondation à partir de prélèvements testiculaires. Cela n’est cependant pas toujours le cas et il existe parfois une spermatogenèse plus ou moins altérée. Ce fait doit faire informer les patients d’un risque potentiel d’échec de prélèvement de spermatozoïdes.
Un bilan minimum sera réalisé chez tout homme suspect d’agénésie bilatérale des canaux déférents :
-examen clinique et andrologique : palpation des canaux déférents ;
-examen respiratoire et digestif par un spécialiste de la mucoviscidose ; -réalisation de trois tests à la sueur ;
-échographie endorectale des voies génitales ;
-échographie rénales à la recherche d’une agénésie rénale associée ;
-spermogramme bien sûr pour évaluer l’importance du volume de l’éjaculat, du pH du sperme ;
-dosage des marqueurs séminaux (importance du fructose) ;
-recherche de mutations CFTR chez le patient et sa conjointe. En raison de la transmission probable de gène CFTR mutés par l’homme présentant une agénésie bilatérale des canaux déférents, il est impératif d’évaluer le risque de mucoviscidose pour la descendance, une grossesse étant envisageable par ICSI et prélèvement testiculaire. Une consultation de conseil génétique s’impose là encore, mais la situation est rendue difficile du fait du grand nombre des mutations et de l’absence de prédiction possibles des conséquences cliniques pour certaines d’entre elles. L’étude des deux membres du couple est bien sûr indispensable.
Absence unilatérale des canaux déférents (AUCD) et mutations du gène CFTR
L’AUCD liée à des mutations du gène CFTR peut se rencontrer au cours du bilan étiologique d’azoospermie obstructive. Dans cette situation, le tableau clinique et paraclinique est très proche de celui des ABCD, à la différence que l’un des deux canaux déférents est palpable à l’examen clinique.
L’absence de spermatozoïde s’explique alors :
– soit par une obstruction mécanique du canal déférent palpable par le fluide de l’anse épididymodéférentielle qui est beaucoup plus visqueux en cas d’anomalie fonctionnelle ou d’absence de la protéine CFTR (théorie du « bouchon muqueux ») ;
– soit par l’absence d’une portion intrapelvienne de ce même canal – portion non accessible à l’examen clinique. Ce dernier processus serait lié à la survenue d’un phénomène pathologique d’atrésie segmentaire déférentielle induit par les formes mutées de la protéine CFTR.
Les AUCD se rencontrent également chez des patients n’ayant pas d’azoospermie. Les patients peuvent présenter des anomalies spermatiques de sévérité variable, voire ne pas présenter d’anomalies spermatiques. Ces AUCD sont, dans la très grande majorité des cas, associées à des perturbations des caractéristiques physicochimiques du sperme. L’hypospermie (volume spermatique < 1,5 mL) est l’élément le plus constant chez les patients présentant une AUCD . Il peut s’y associer de manière plus variable un pH spermatique acide. Ce signe est en effet moins fréquent, car la vésicule séminale homolatérale du canal déférent palpable peut fonctionner suffisamment pour « contrebalancer » l’acidité des sécrétions prostatiques lors de la formation de l’éjaculat et maintenir un pH spermatique physiologique. La viscosité du sperme peut également être augmentée de manière inconstante.
Lors du reste du bilan paraclinique, on peut mettre en évidence:
– au niveau de la biochimie séminale : une baisse du fructose (marqueur des vésicules séminales) et/ou de l’α-glucosidase et de la carnitine (marqueurs épididymaires), selon le niveau de l’obstruction. Les valeurs constatées sont souvent inférieures de 50 % par rapport à la valeur limite de chaque marqueur ;
– au niveau de l’échographie endorectale : des anomalies, des vésicules séminales (absence, hypoplasie, aspect dystrophique, etc.).
La possibilité qu’un canal déférent puisse présenter une atrésie secondaire d’une seule portion profonde de son trajet non accessible à l’examen clinique justifie la réalisation systématique dans tout bilan d’hypospermie d’une échographie complète de l’appareil urogénital, qui pourra être complétée par une IRM pelvienne. En outre, en cas de mutations du gène CFTR, il est possible que les déférents soient présents (mais peut-être non fonctionnels) et que seules une ou les deux vésicules séminales présentent des anomalies en imagerie.
La mesure du taux de fragmentation de l’ADN des spermatozoïdes ou indice de fragmentation des spermatozoïdes
Il existe un test récent qui peut donner des informations sur la qualité de l’ADN (chromosomes) : c’est l’indice de fragmentation de l’ADN des spermatozoïdes. L’ADN du spermatozoïde, support du génome d’un individu est une longue molécule fragile et fortement compactée. La stabilité de la chromatine (ADN + protéines) du spermatozoïde est indispensable à une fécondation normale et au développement embryonnaire. La stabilité de l’ADN dépend des protéines qui y sont associées (protamines et/ou histones). La condensation maximale de la chromatine du noyau des spermatozoïdes éjaculés est liée à la présence des protamines et les défauts de condensation peuvent être à l’origine de certaines formes anormales de la tête. Pour des raisons diverses et pas toutes répertoriées aujourd’hui, il peut arriver que les brins d’ADN se « coupent » d’une manière excessive : il y a alors fragmentation de L’ADN. Habituellement, La fragmentation est souvent présente en faible quantité dans la plupart des spermatozoïdes mais après fécondation, l’appareil ovocytaire peut contribuer à réparer ces coupures anormales, sous réserve qu’elles se trouvent dans une proportion raisonnable. Au delà d’un certain seuil, la réparation n’est plus possible (actuellement, le seuil admis est compris entre 20 et 30 % (Nbre de spermatozoïdes fragmentés sur 100 spermatozoïdes). Au-delà, les mécanismes de réparations sont alors dépassé et le développement embryonnaire ne peut pas se poursuivre.
Le principe du test est d’incorporer des nucléotides marqués par un fluorochrome au niveau de l’ADN fragmenté puis de mesurer l’intensité de la fluorescence. On utilise généralement la technique TUNEL avec le kit in situ cell death detection fluorescein de Roche Diagnostic.
Le taux de fragmentation est considéré comme anormal quand il est supérieur à 30%. Un taux anormal a une incidence directe sur les taux de succès en procréation assistée.
L’étude de la décondensation de la chromatine du spermatozoïde
Cet examen, en cours d’évaluation est un marqueur de la mauvaise qualité de l’intégrité de la double hélice d’ADN.
Les prélèvements de spermatozoïdes chirurgicaux et percutanés
Ce paragraphe a été rédigé par les docteurs Pierre Monod (Grenoble), Fouad Shakir (Moscou), Urologues, et le docteur Jacques Chouteau, Biologiste de la reproduction (Grenoble, France).
Introduction
Lorsque dans un couple infertile l’homme présente une azoospermie, on peut réaliser un prélèvement chirurgical des gamètes males (spermatozoïdes) pour effectuer une fécondation in vitro avec micro injection (FIV-ICSI).
Les différentes techniques de prélèvement se sont développées avec l’avènement de l’ICSI au début des années 90. Elles sont réalisables par l’urologue compétent et agréé au sein de l’équipe de Procréation Médicalement Assistée.
La biopsie chirurgicale sous anesthésie générale reste la technique de référence mais d’autres procédés percutanés moins invasifs (SPERLING ; TOURNAYE ) ont vu le jour rapidement permettant un choix adapté au type de patient infertile.
La possibilité de cryo conserver les spermatozoïdes prélevés et les premiers succès de grossesse avec des spermatozoïdes congelés (KUPER ; OATES) ont permis un meilleur confort de prélèvement à la fois pour le partenaire masculin en évitant les recueils itératifs mais aussi pour la partenaire féminine en lui évitant d’être stimulée pour rien puisque dans la plupart des le recueil est maintenant asynchrone de la FIV.
Glossaire des techniques
TESE : testicular sperm extraction
MESA : microscopic epididymis sperm aspiration
PESA : percutaneous epididymis sperm aspiration
TEFNA : testicular sperm aspiration with fine needle
PTESE: percutaneous testicular sperm extraction…
La variété des acronymes, outre leur caractère actuellement désuet, reflète la volonté des équipes à rechercher le meilleur compromis entre l’invasif et la qualité du recueil.
En pratique on peut distinguer au plan technique
1-Les recueils pulpaires testiculaires et épididymaires par voie ouverte chirurgicale.
Anesthésie générale (possible sous rachis anesthésie et même anesthésie locale), incision scrotale soit transversale à cheval sur la ligne médiane soit longitudinale sur le raphé. L’extériorisation des deux gonades se fait par la même incision, alternativement, après incision du dartos puis de la séreuse vaginale, le testicule étant maintenu entre pouce et index.
Le recueil de la pulpe est facile à, l’œil nu, aux ciseaux à bouts ronds fins et courbes après ouverture de l’enveloppe albuginée. Nous conseillons l’hémostase des petites vaisseaux qui courent sous l’albuginée à la pince bipolaire. Les fragments de pulpe sont placés dans un liquide de conservation (B2 Menezo) pour l’envoi au laboratoire où la pulpe sera dilacérée à la recherche de gamètes mobiles.
Une petite partie du prélèvement est fixé à part pour l’étude histologique classique, qui viendra renseigner sur le l’état focal de la spermatogénèse, et permettra de certifier certains diagnostics comme l’OSCS.
Plusieurs abords peuvent être réalisés (pôles, partie médiane) pour augmenter les chances de positivité notamment dans les azoospermies sécrétoires où les déficits peuvent se répartir en mosaïque. On peut s’aider d’un microscope opératoire pour mieux visualiser les tubes séminifères turgescents à grossissement moyen (x 10).
Après l’ouverture de l’enveloppe séreuse vaginale par une petite moucheture on peut également prélever sans extérioriser le testicule en le faisant simplement rouler entre les doigts en regard de la fenêtre séreuse et inciser l’albuginée de façon élective. A l’inverse on peut réaliser une grande incision de l’albuginée sur un méridien, ouvrant la gonade comme un livre, la pulpe se prêtant alors bien à une vision au microscope si nécessaire. La fermeture de l’albuginée doit être soigneuse, points séparés ou surjet de fil résorbable 3 ou 4/0 aiguille point ronde.
Le recueil épididymaire se réalise sous microscope. Après avoir repéré la portion dilatée du canal pelotonné visible par transparence sous l’enveloppe séreuse péri épididymaire, cete dernière est incisée délicatement pour extérioriser une boucle du canal, que l’on sectionne tout en étant prêt à micro aspirer le liquide qui s’échappe alors sous pression. Un micro tube polyethilène de 18G coupée obliquement et raccordé à une seringue permet la succion minutieuse. La réintégration est douce, les différents plans (enveloppe vaginale, dartos, peau scrotale) sont reconstitués par sutures résorbables en soignant l’hémostase. Un pansement pour 48 heures suffit en général assorti à une contention scrotale simple par suspensoir. L’antibioprophylaxie n’est pas nécessaire, les anticoagulants non plus. La complication la plus fréquente est la douleur par hématome intra testiculaire. Elle se traite par le repos, suspensoir obligatoire, antalgiques, éventuellement anti-inflammatoires et surveillance du retour à la normale. L’ecchymose du scrotum est banale, parfois impressionnante mais en règle indolore. La perte d’un testicule par complication grave de type fonte purulente ou nécrose ischémique est très rare mais doit à notre avis être dans le contenu des informations fournies au patient.
2-les recueils pulpaires testiculaires ou épididymaires percutanés
Ils s’agit des ponctions aspirations à l’aiguille (FRIEDLER) ou des biopsies avec un système BioptyGun* (ABI MOUSSA) Ces alternatives restent « chirurgicales » avec le même potentiel de complication malgré leur caractère moins invasifs. L’intérêt est de les réaliser sous anesthésie locale, par infiltration du cordon, et en hospitalisation de jour de courte durée. Le choix d’une technique ouverte ou percutanée dépend de l’expérience de chaque équipe. Après un période de pratique percutanée notre préférence est revenue aux techniques ouvertes, sous anesthésie générale, loco régionale et parfois locale, en ambulatoire. Nous pratiquons les recueils depuis 1992. Initialement synchrones d’une stimulation ovarienne ils sont maintenant et depuis 10 ans pratiquement toujours asynchrones, grâce à la congélation, ce qui permet d’éviter des stimulations inutiles si le test de décongélation, élément pronostique majeur, effectué dans les 24h n’est pas favorable. Du même coup la simple biopsie à visée informative n’a plus guère d’intérêt dans une pratique « asynchrone ». Une simple TEFNA risque de pêcher par son manque d’exhaustivité. Une biopsie ouverte d’exploration simple sans congélation prévue risque de faire regretter…
Les indications
1-les azoospermies excrétoires ou obstructives (AO)
Le volume testiculaire est normal, la FSH est normale basse et l’INHIBINE B est régulièrement élevée > 75 : ce sont les indications de choix à tel point que la microchirurgie de reperméation se pratique de plus en plus rarement au profit des prélèvements, plus simples, d’autant qu’il est peu fréquent qu’une microchirurgie de l’obstruction puisse se passer ensuite de FIV.
Dans le cas particulier d’azoospermie obstructive par Agénésie Bilatérale des Canaux Déférents (ABCD) le recueil chirurgical des gamètes, toujours productif, est assujetti à la normalité du bilan génétique préalable du couple par rapport au risque de mucoviscidose.
Dans les obstructions déférentielles acquises (vasectomies…) où les épididymes sont dilatés, et si aucune chirurgie réparatrice n’est prévue ou possible, le recueil épididymaire est facile et parfois très productif. Mais il est souvent nécessaire d’aller recueillir également de la pulpe testiculaire lorsque l’on craint une altération des spermatozoïdes ayant stagnés longtemps dans un canal épididymaire dilaté mais biologiquement détruit par une obstruction ancienne…
2-les azoospermies sécrétoires ou non obstructives (ANO)
Le volume testiculaire est diminué ( < 6 cc par unité), la FSH est élevée, l’INHIBINE B est fréquemment basse. L’enquête génétique systématique (caryotype et recherche de micro délétions de l’Y) permettra d’identifier les cas où un conseil génétique sera le préalable au recueil : Klinefelter, micro délétions de l’Y, translocations… Dans tous les cas les chances de succès sont variables. Les facteurs prédictifs de mauvais pronostic sont un volume de parenchyme testiculaire faible (< 2,5 cc par unité ), des gonades molles, une Inhibine B basse (<15). Les patients doivent être informés en conséquence.
3-les oligospermies extrêmes
Elles entrent naturellement dans le champ des indications à partir du moment où le recueil naturel n’a pas permis d’obtenir des paillettes et sont assimilables aux azoospermies AO et ANO pour le raisonnement diagnostique.
Les résultats
En cas d’AO le recueil est constamment productif. La prise en charge des ABCD est particulièrement démonstrative des progrès réalisés dans ce domaine de l’AMP. En cas d’ANO le taux de recueils « congelables » varie de 30 à 40% selon les publications, soit un bon tiers en moyenne de patients qui ont la chance d’avoir des paillettes. A partir du moment où des spermatozoïdes mobiles sont obtenus par le recueil et si le test de décongélation est positif alors le taux de grossesse pour ces ponctions est de 30 % par cycle d’ICSI selon le l’Agence de Biomédecine en France.
Conclusion
Le recueil chirurgical des spermatozoïdes est maintenant une pratique courante de PMA avec de bon résultats en FIV-ICSI. Qu’il soit ouvert ou percutané le geste mérite d’être décidé en concertation multidisciplinaire et après le consentement éclairé du patient. Ainsi l’espoir est redonné à bon nombre de couples infertiles en particulier dans les AO et dans une bonne proportion des ANO.
Abrévations :
-PMA : procréation médicalement assistée
-AO : azoospermie obstructive
-ANO : azoospermie non obstructive
-FSH : folliculing stimulating hormon
-ABCD : agénésie bilatérale des canaux déférents
-OSCS : only Sertoli cell syndrome
Le cas particulier des varicocèles
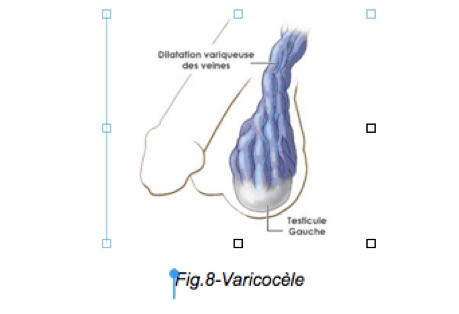
La varicocèle est une dilatation avec incompétence valvulaire des veines du cordon spermatique, on peut donc parler de varice du cordon. Sa fréquence est estimée à 10 % des hommes et elle est unilatérale dans 90 % des cas (le plus souvent à G). Elle est le plus souvent bénigne mais est parfois à G, la conséquence d’un obstacle au drainage veineux par compression ou thrombose de la veine rénale G, il faut donc éliminer un cancer du rein G par une échographie. Elle est le plus souvent asymptomatique mais est parfois responsable de douleurs er de pesanteurs. Le volume du testicule est parfois augmenté mais il peut être diminuer chez l’adolescent.
La varicocèle est évoquée dans le diagnostic de stérilité masculine par diminution du nombre et de la mobilité des spermatozoïdes d’où la nécessité de réaliser un spermogramme. Le diagnostic est réalisé par l’examen clinique et confirmé par un examen écho-Döppler (dilatations et reflux dans les veines du cordon).
La varicocèle ne doit être traitée qu’en cas de gène esthétique, de douleurs, d’atrophie testiculaire de l’adolescent ou de stérilité induite par une modification du spermogramme sans autre cause. Jusqu’à récemment, le traitement reposait sur la chirurgie, classique ou cœlioscopique avec ligature veineuse. Les progrès des thérapies endovasculaires permettent de réaliser des gestes plus légers : les petites varicocèles sont traités par injection écho-guidée de mousse sclérosante (ambulatoire), les plus grosses peuvent bénéficier d’une embolisation à l’aide d’un coïl (qui remplace la ligature) après injection de liquide ou mousse sclérosante en amont pour éviter les recanalisations par les collatérales (hospitalisation de jour). Ces techniques permettent la disparition de la varicocèle dans plus de 95 % des cas tout en simplifiant le geste par rapport à la chirurgie classique.
Quelques mots sur les anti-oxydants
Les compléments alimentaires en vitamines ou micronutriments, prescrits dans le but d’améliorer les paramètres spermatiques, ont rarement été validés par des études randomisées en double aveugle contre placebo. Ainsi, les antioxydants permettraient de booster la fertilité des hommes qui ont du mal à concevoir un enfant naturellement. Reste à déterminer quels sont ceux qui sont les plus favorables.
Les antioxydants contribueraient à améliorer la fertilité masculine. Selon une ONG internationale, l’effet néfaste du stress oxydatif sur le sperme provoquant des dommages cellulaires serait réduit par la prise d’antioxydants. Ainsi, la prise de vitamine E, de carnitine, de zinc ou de magnésium chez l’homme souffrant d’hypofertilité inexpliquée augmenterait les chances de grossesse de sa femme. Les chercheurs ont constaté l’augmentation du taux de naissance chez les couples où l’homme a ingéré des antioxydants par voie orale. Bien qu’aucun effet secondaire nocif n’ait été constaté, d’autres recherches seraient nécessaires pour déterminer et comparer l’efficacité des différents antioxydants.
Les compléments alimentaires en vitamines ou micronutriments, prescrits dans le but d’améliorer les paramètres spermatiques, ont rarement été validés par des études randomisées en double aveugle contre placebo. De nombreuses études ont tenté d’étudier l’impact de la prise de suppléments alimentaires d’antioxydants dans la prévention de différentes maladies. Les résultats de ces études sont discordants. Ces résultats discordants pourraient s’expliquer par l’origine de l’antioxydant : les formes chimiques naturelles, qui existent dans la nature (aliments) seraient les seules efficaces. Un excès d’antioxydants, notamment synthétiques, serait souvent nocif.
Il en résulte que la supplémentation en anti-oxydants n’a pas lieu d’être recommandée, par contre il est important de conseiller aux hommes infertiles (ainsi qu’à tout le monde), une nourriture saine et variée et une vie saine éloignée le plus possible des polluants environnementaux.