Le SIDA est l’abréviation de syndrome d’immunodéficience acquise. C’est une maladie sexuellement transmissible, causée par un virus appelé VIH, ou virus d’immunodéficience humaine.
En France, on compte environ 1 500 accouchements de femmes VIH+ par an.
La prise en charge des femmes enceintes VIH+ a pour but de diminuer le risque de transmission materno-foetale (TMF) au cours de la grossesse, de l’accouchement et du post-partum. L’introduction des multithérapies anti-VIH chez l’adulte a repoussé l’échéance du stade symptomatique de la maladie. Chez la femme enceinte, des progrès considérables ont été effectués en 10 ans, et le taux de transmission materno-foetale est passé de 25 % à moins de 3 %.
I-Généralités sur l’infection par le SIDA
A-Le virus du SIDA
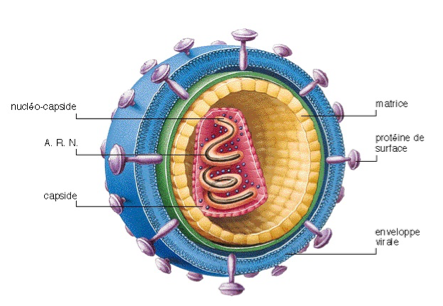
Le virus du Sida fait partie de la famille des lentivirus. Il s’agit d’un virus possédant un génome sous forme d’ARN, contenu dans une capside protéique, elle-même entourée par une enveloppe formée d’une membrane lipidique. Son nom correspond à son effet pathologique : VIH = Virus de l’Immunodéficience Humaine. La maladie qu’il cause chez l’Homme est le Sida : Syndrome d’Immuno Déficience Acquise.
On distingue actuellement deux types de VIH : le VIH-1 et le VIH-2. Ces deux virus sont très proches (42 % d’homologie au niveau de leur génome).
B-Origine
Selon la théorie majoritairement admise, le virus de l’immunodéficience humaine aurait été transmis à l’homme par le singe. On parle d’origine « simienne ». En effet, un lien a été découvert entre les deux types de VIH humains, que sont le VIH-1 et le VIH-2, et le virus d’immunodéficience simien (VIS). La date de la transmission du virus à l’homme est estimée entre la fin du XIXe siècle et le début du XXe siècle. La théorie du chasseur de viande de brousse permettrait d’expliquer le passage du virus à l’homme. En effet, le singe est un animal qui a longtemps été chassé. Des expositions à du sang contaminé est une explication plausible.
C- Modes de transmission
Le virus du Sida peut être transmis de diverses manières.
1-par voie sexuelle : Le virus est présent dans les sécrétions génitales, et peut donc être transmis lors d’un rapport sexuel, qu’il soit homosexuel ou hétérosexuel (la majorité des sidéens africains sont ainsi contaminés lors de rapports hétérosexuels). Une personne peut être contaminée par le VIH sans présenter de symptômes pendant une période pouvant s’étaler sur plusieurs mois voire plusieurs années. Cette personne, porteuse sain du virus, peut ainsi transmettre le virus, tout en l’ignorant, à son ou ses partenaires lors de relations sexuelles non protégées. Il est impossible de savoir avec certitude si l’on est porteur du virus sans avoir effectué un test sanguin (sérologie).
Le risque de contamination par le VIH s’aggrave si les partenaires sexuels sont nombreux. Le risque s’aggrave également lors de rapports sexuels avec un nouveau partenaire dont on ignore sa sérologie vis-à-vis du VIH. Un partenaire porteur du virus et présentant des lésions de la peau ou des muqueuses risque de le transmettre plus facilement
Pratiquer une fellation entraîne également un risque de transmission du virus HIV. Ce risque est toutefois plus faible que pour la pénétration vaginale ou anale
On doit citer également les rapports avec un partenaire qui consomme ou a consommé des drogues administrées par voie intraveineuse et a pratiqué l’échange de seringue ou les tatouages et divers « percing » avec du matériel qui n’est pas à usage unique ou non stérile.
2-par voie sanguine : Le virus étant présent dans le sang, il peut être transmis lors de tout « don » de sang d’un individu à un autre : lors de pratiques toxicomanes (échanges de seringues), de manière accidentelle, ou lors de transfusions.
Un dépistage systématique des dons du sang a permis de réduire ce dernier mode de transmission (risque résiduel maintenant estimé à 1/500 000).
3-Transmission materno-fœtale qui va nous intéresser ici: Le virus est capable de traverser la barrière hémato-placentaire, et ainsi de contaminer, in utero, un fœtus. Le cas le plus fréquent semble être toutefois lors de l’accouchement.
De plus, le virus se retrouve dans le lait maternel, d’où une contamination lors de l’allaitement (cas fréquent surtout en Afrique).
D-Mode d’attaque du virus sur le système immunitaire
Le VIH appartient à la catégorie des rétrovirus (virus à ARN). Observés en dehors des cellules, les virus apparaissent sous forme de particules virales de très petites taille, associant acides nucléiques porteurs de gènes et protéines. Ces particules sont inertes au plan métabolique et ne se multiplient qu’a l’intérieur des cellules : ce sont des parasites intracellulaires obligatoires.
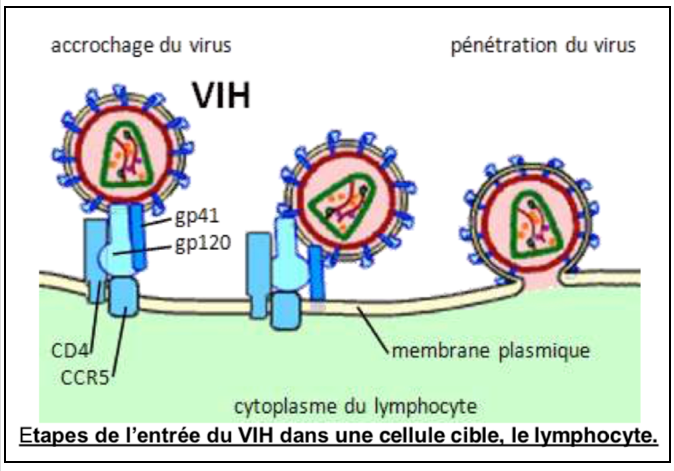
L’entrée du virus dans ces cellules fait suite à la fixation de celui ci à une protéine de leur membrane, la protéine CD4, par l’intermédiaire d’une autre protéine, la protéine gp120 portée par l’enveloppe du virus. Les macrophages et les LT4 possèdent la protéine CD4 et peuvent DONC abriter le virus. LT4 et macrophages sont donc les cellules cibles du VIH. Les macrophages et les monocytes jouent le rôle de véritable réservoir, notamment dans les ganglions lymphatiques. Après entrée du virus dans la cellule hôte, les molécules d’ARN, ainsi que les enzymes virales, dont la transcriptase inverse, se trouvent alors dans le cytoplasme de la cellule cible. Une enzyme virale, la transcriptase inverse, transcrit l’ARN viral en ADN dans les cellules infectées. L’ADN est alors intégré au génome de la cellule hôte ; son expression engendre par transcription de nouvelles molécules d’ARN qui seront traduites en protéines. Les ARN et protéines s’assemblent ensuite pour former de nouvelles particules virales infectieuses.
Une fois formées, les particules virales quittent la cellule par bourgeonnement, et acquiert au passage leur enveloppe lipidique. Leur prolifération et leur libération hors de la cellule cible provoquent généralement la mort de celle-ci. Après libération, les particules virales sont disséminées dans le sang. Leur quantité dans le sang (charge virale) varie selon le stade de la maladie.
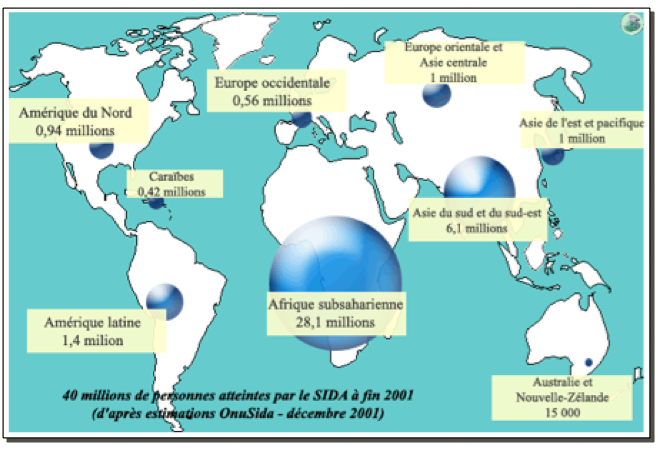
E-Répartition mondiale
F-Le SIDA : signes cliniques et complications
On décrit trois phases successives.
1-Première phase ou primo-infection. Lors de l’entrée du VIH dans l’organisme on assiste dans un premier temps à une augmentation importante de la charge virale : le virus se réplique et se dissémine de façon importante. Cette prolifération provoque les symptômes d’une maladie virale bénigne. Les symptômes ressemblent donc à ceux de la grippe ou de la mononucléose et sont présents dans un cas sur deux environ. La primo-infection peut donc passer inaperçue. Au moment de leur apparition, la personne venant de contracter le VIH présente un risque particulièrement élevé de transmettre le virus, car le nombre de virus présent dans le corps, c’est-à-dire la charge virale est particulièrement élevé. Ces symptômes persistent durant 1 semaine à 1 mois, puis disparaissent. Ce sont : fièvre, maux de tête, maux de gorge, rougeurs sur la peau, fatigue, douleurs musculaires et articulaires.
2-Deuxième phase ou phase asymptomatique. La personne est séropositive et ne présente pas de symptômes, même si le virus s’attaque en sourdine au système immunitaire. En effet, la phase précédente provoque une intense réaction immunitaire de l’hôte, l’organisme produit des anticorps anti-VIH que l’on pourra déceler. La présence de ces anticorps marque le début de la séropositivité (le sujet étant alors dit « séropositif » pour le VIH). La période qui la sépare de l’infection initiale est généralement de 2 semaines à trois mois (d’ou la nécessité d’attendre plusieurs semaines pour un test fiable).
Apparaissent en même temps dans le sang du sujet contaminé des lymphocytes T cytotoxiques (LT8) spécifiques dirigés contre les cellules infectées par le VIH, par exemple les LT4 qu’ils détruisent.
En détruisant les LT4, les LT8 limitent la prolifération du virus et la charge virale diminue. Leur activité contrôle pendant un temps la prolifération du virus : c’est la phase asymptomatique de durée variable (1-10 ans)
Cette phase correspond donc à une infection chronique très active limitée en permanence par des réactions immunitaires importantes, auxquelles le virus finit cependant par échapper.
3- Troisième ou phase de SIDA. L’infection par le VIH se traduit à long terme par une diminution constant des lymphocytes T4 (détruit par les LT8), dont le nombre devient inférieur à 200 par microlitre (valeur normale 1 200). Le système immunitaire est alors moins efficace contre toutes les maladies : c’est le début de la phase symptomatique qui signe le déclenchement de la maladie SIDA.
Certains symptômes deviennent plus fréquents, persistants et parfois chroniques, par exemple : fièvre, sueurs nocturnes, perte de poids importante, gonflement des ganglions , diarrhées persistantes, infections de la peau, toux sèche persistante, essoufflement.
A cette phase apparaissent des maladies opportunistes. A cause de l’affaiblissement du système immunitaires, diverses maladies peuvent survenir, particulièrement de type maladies infectieuses ou cancers. On parle de maladies opportunistes. Cette phase survient en moyenne 10 ans après la primo-infection.
G-Diagnostic
La sérologie du test VIH est l’unique examen permettant le diagnostic formel de l’infection par le virus VIH. Le test de dépistage du VIH permet une prise en charge la maladie le plus précocement possible et permet d’éviter que des personnes ignorant qu’elles sont porteuses du virus contaminent leurs partenaires à leur tour.
Un organisme infecté par un virus fabrique des anticorps spécifiques contre ce virus afin de le combattre. Une personne présentant par exemple une hépatite, atteinte donc du virus de l’hépatite, fabriquera des anticorps contre ce virus. De la même manière, une personne contaminée par le VIH aura fabriqué au bout de quelques semaines, 2 à 3 semaines environ, des anticorps spécifiques contre ce virus. Le dosage sanguin de ces anticorps anti-VIH correspond à la sérologie VIH: ce dosage sera positif si la personne a été contaminée. Elle sera ainsi séropositive vis-à-vis du VIH. La présence des anticorps est négative pendant les 2 à 3 premières semaines suivant l’infection par le virus. Les anticorps contre le virus seront fabriqués au bout de 2 à 3 semaines. Le test sérologique peut ainsi être négatif s’il est réalisé très peu de temps après l’infection, à moins que la personne ait déjà été infectée auparavant.
Si la première sérologie est positive, il faut reconfirmer le résultat en effectuant un second test. Un test du VIH négatif 3 mois après l’exposition au virus peut être considéré comme négatif.
Lorsque la séropositivité est confirmée, une équipe spécialisée prend immédiatement en charge le patient.
Parallèlement à l’évolution de l’infection, un certain nombre de paramètres varie : la quantité de CD4 (correspondant au nombre de lymphocytes) diminue donc pendant la phase asymptomatique), la quantité d’ARN viral (correspondant au nombre de virus), et les anticorps anti-VIH augmentent. Ces derniers montrent la réaction du système immunitaire face à l’infection par le VIH. Ils apparaissent lors de la primo-infection (qui dure de 3 à 8 semaines).
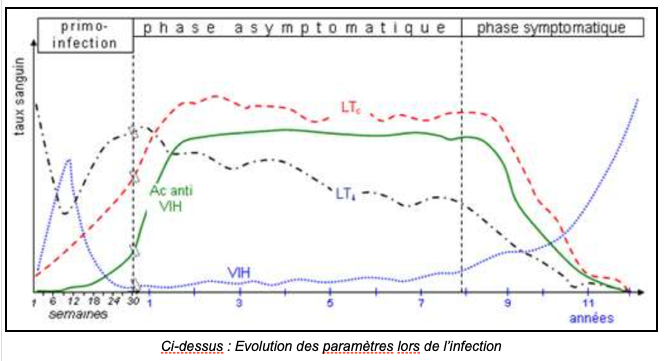
Chez les adultes, cette apparition d’anticorps anti-VIH est utilisée pour diagnostiquer une infection par le virus du Sida. On recherche ainsi leur présence, par deux tests de dépistage ELISA (fixation des anticorps), puis par un test de confirmation par Western blot (séparation de protéines sur gel). En cas de résultat positif, on dit que l’individu est séropositif : il possède des anticorps anti-VIH dans son sérum.
Chez le nouveau-né, on réalise un diagnostic direct : coculture de cellules sanguines prélevées chez l’enfant avec des lymphocytes, puis détection de l’ARN viral par PCR. En effet, les anticorps franchissant la barrière hémato-placentaire, une séropositivité à la naissance n’est que le reflet de celle de la mère du nouveau-né…
Un patient séropositif est suivi, pour observer l’évolution de la maladie. Pour cela, on recherche l’ARN viral dans le plasma et on le quantifie. Ceci donne la quantité de virus présent, ou charge virale.
II-Dépistage de l’infection à VIH chez les femmes enceintes
On estime qu’environ 1500 nouveaux-nés naissent par an en France de mères infectées. 20%d’entre elles découvrent leur séropositivité au cours de leur grossesse. Le dépistage est régit par la loi n°93-121, art48 du 27 juillet 1993 : « à l’occasion du 1° examen prénatal, après
information sur les risques de contamination, un test de dépistage de l’infection par le VIH est systématiquement proposé à la femme enceinte». Les traitements antirétroviraux permettent un prévention quasi-complète de la transmission mère-enfant . Aussi, même si la prescription du dépistage n’est pas actuellement rendu obligatoire (à l’instar de la toxoplasmose ou de la syphilis), mais recommandé et soumis au consentement maternel.
Un nouveau test est proposé au 6° mois si
– partenaire ou conjoint infecté par le VIH,
– partenaire ou conjoint n’ayant pas effectué de test de dépistage,
– partenaires multiples.
Chez le futur père et partenaire de la femme enceinte, ce dépistage fait partie de l’examen du 4° mois prévu par l’assurance maladie dans le cadredu suivi de grossesse.
Un test rapide au moment de l’accouchement doit être proposé systématiquement à toute femme n’ayant pas bénéficié de dépistage
antérieur. Il est effectué sur sang total.
III-Transmission Mère-Enfant
Le principal élément pronostic est l’état immunovirologique de la mère avec un lien étroit avec l’importance de la charge virale plasmatique maternelle à l’accouchement.
L’objectif du suivi chez la femme enceinte est simple : obtenir la suppression de la réplication virale tout au long du 3° trimestre grâce au traitement antirétroviral afin de réduire aumaximum le risque de transmission verticale.
Principaux facteurs de risques de TME du VIH en dehors des aspects thérapeutiques :
-Facteurs maternels : Charge virale plasmatique élevée, déficit immunitaire (lymphocytes CD4 bas), symptômes cliniques liés au VIH (SIDA)
-Facteurs viraux : Virus VIH-1 (versusVIH-2)
-Facteurs fœtaux : Génétique (HLA, CCR-5), sexe féminin, hypotrophie
-Facteurs placentaires : Chorioamniotite bactérienne, paludisme
-Facteurs obstétricaux : Rupture prématurée des membranes, accouchement prématuré, infection génitale, MST, gestes invasifs, accouchement par voie basse (versus césarienne programmée)
-Allaitement maternel : Etat maternel (sida, charge virale, CD4), charge virale élevée dans le lait maternel.
Ce risque de transmission mère-enfant afortement diminué ces trente dernères années notamment grace à l’introduction de l’AZT en 1994, de la césarienne prophylactique en 1995 puis en 1996 avex l’appartition des associations d’antirétroviraux encore appelées multithérapies. Le taux de transmission est ainsi passé de 20-25% au début des années 1990 à moins de 1% actuellement.
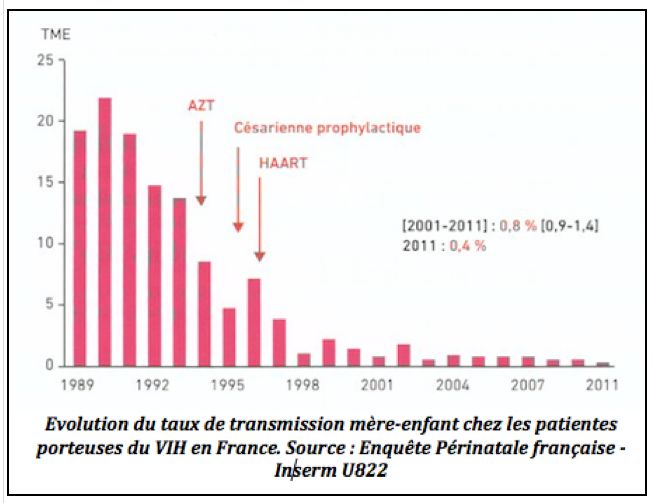
IV-Suivi obstétrical d’une femme séropositive pour le VIH
A-Information
Il est indispensable d’exposer clairement les risques d’aggravation de la maladie et la possible contamination de son enfant si la patiente est à un stade symptomatique de la maladie et que ses paramètres immunologiques et virologiques sont défavorables. Il faut aborder également le problème de l’élevage de l’enfant en cas de disparition de ses parents (problème des orphelins).
En pratique, certaines situations sont manifestement favorables chez des femmes non traitées ayant un bon statut immunitaire et une charge virale faible. À l’inverse, il existe des situations défavorables, chez des patientes traitées présentant un déficit immunitaire et un échappement virologique. Mais quedire à une femme qui reçoit une trithérapie avec une charge virale indétectable ? Quel est le risque résiduel de transmission et quels sont les risques dus aux médicaments pour le foetus et pour l’enfant à plus long terme ? Les intérêts des deux patients, la mère et l’enfant, sont-ils compatibles ou contradictoires ?
B-prise en charge psychologique et sociale
La prise en charge doit dépasser largement les problèmes purement médicaux. Un soutien psychologique est souvent nécessaire. Dans le cas particulier des femmes toxicomanes, il faut tenter un sevrage ou une substitution en tenant compte des motivations individuelles.
L’aide des services sociaux est souvent utile : ouverture de droits sociaux, femmes marginales, situations irrégulières, etc.
C-Le suivi
Il est au moins mensuel et s’assimile à celui d’une grossesse à risque. Certains éléments sont à surveiller en particulier
1- le risque de rupture prématuré des membranes et d’accouchement prématuré
2-Le suivi biologique
a-En début de grossesse les examens classiques communs à toute grossesse sont réalisés.
b-En cas d’initiation du traitement au cours de la grossesse: nadir de CD4, charge virale, génotype de résistance, recherche de HLA B*5701.
c-Chaque mois: charge virale, NFS plaquettes, transaminases, creatinine et bandeltte urinaire.
d-Chaque trimestre: CD4.
e-Dosage des antirétroviraux en cas de charge virale non indétectable au 3ème trimestre.
f-Les autres examen sont ceux habituels pour toute grossesse.
3- dépister les infections cervicovaginales et les MST :
a-Les infections cervico-vaginales et vulvaires à papillomavirus (HPV) exposent à un risque plus élevé de dysplasie cervicale intra-épithéliale. Ces femmes doivent bénéficier d’un frottis cervico-vaginal. Les lésions acuminées nécessitent un traitement compte tenu du risque d’atteinte du nouveau-né au niveau laryngé. Les topiques actuellement disponibles (5-fluoro-uracile = Efudix® ; podophyllotoxine = Condyline®) sont contre-indiqués pendant la grossesse en raison de leurs effets antimitotiques. Il faut recourir à la vaporisation des lésions au laser CO2 ou à la cryothérapie vers le 8e mois de grossesse.
b-Recherche de chlamydia : un prélèvement de l’endocol devra être réalisé chez toute patiente présentant une sérologie chlamydia positive. Si la femme est porteuse du germe, afin d’éviter une éventuelle contamination du nouveau-né (conjonctivite, pneumopathie), un traitement par érythromycine doit être entrepris (1 sachet de 1 000 mg, 2 fois par jour, pendant 14 jours). Un contrôle de l’efficacité du traitement doit être réalisé 3 semaines après l’arrêt du traitement.
c-Hépatite B : Une séro-vaccination doit être réalisée en cas de présence d’antigène HBs chez la mère. Pour certains, la vaccination néonatale est systématique.
d-Hépatite C
4-Limiter les gestes invasifs pouvant entraîner une infection ascendante ou des échanges sanguins foetomaternels (cerclage, amniocentèse….). Certains gestes sont à proscrire : électrode au scalp, amnioscopie, version par manœuvres externes, chorio ou placentocentèse, cordocentèse.
5-Infections opportunistes
La pneumopathie à pneumocystis carinii est l’infection opportuniste de loin la plus fréquente signalée chez la femme enceinte séropositive. En cas de lymphopénie CD4 importante, se pose le problème du traitement préventif de la pneumocystose. L’élément principal sur lequel se fonde la décision d’une prophylaxie primaire est un taux de lymphocytes CD4, inférieur à 200/mm3 à deux reprises. Deux schémas thérapeutiques
actuellement utilisés en routine sont la pentamidine en aérosol et le cotrimoxazole. Le traitement curatif de choix pendant la grossesse demeure le cotrimoxazole : Bactrim®. L’attitude pendant la grossesse n’a pas été définie mais le cotrimoxazole est à éviter juste avant l’accouchement. Quant à la pentamidine, sa fiche signalétique mentionne : « aucune contre-indication absolue à ce jour », mais déconseille son utilisation durant la grossesse et l’allaitement, sauf si son utilisation paraît indispensable. En pratique, il convient d’utiliser le Bactrim® fort jusqu’à 34-35 SA pour la prophylaxie en évitant le 1er trimestre. Les autres infections opportunistes ne sont que très rarement rapportées. Leur traitement doit être adapté à chaque cas en fonction de l’âge gestationnel, du bénéfice maternel et du risque foetal.
6-La toxoplasmose
Des cas de toxoplasmose congénitale chez des enfants nés de mères séropositives qui avaient une sérologie toxoplasmique déjà positive en début de grossesse ont été signalés. Il est probable que chez les femmes immunodéprimées, une réactivation des kystes toxoplasmiques ou une réinfection a lieu avec un parasitisme chronique ou intermittent dans le sang circulant et risque plus élevé de passage transplacentaire. Les règles hygièno-diététiques habituellement dispensées aux femmes enceintes avec une sérologie toxoplasmique négative doivent être
recommandées : s’abstenir de manger de la viande pas ou peu cuite, éviter le contact avec les chats, bien laver les crudités et les fraises. De plus, une surveillance sérologique s’impose : des titres d’anticorps IgG ascendants ou même stables, mais inhabituellement élevés doivent attirer l’attention.
7-Thrombopénies
Les thrombopénies se diagnostiquent chez 4 à 5 % des femmes enceintes. Le traitement antirétroviral est efficace dans la majorité des thrombopénies dues au VIH. L’administration IV d’immunoglobulines humaines lyophilisées est nécessaire en cas de persistance d’une thrombopénie sévère. Les avantages sont la rapidité d’action, l’efficacité et l’excellente tolérance maternelle.
8- les comorbidités les plus fréquentes sont les troubles psychiatriques (anxiété, dépression ) et du métabolisme ( prise de poids importante , diabète). Elles sont à rechercher et à prendre en charge en collaboration avec les infectiologues.
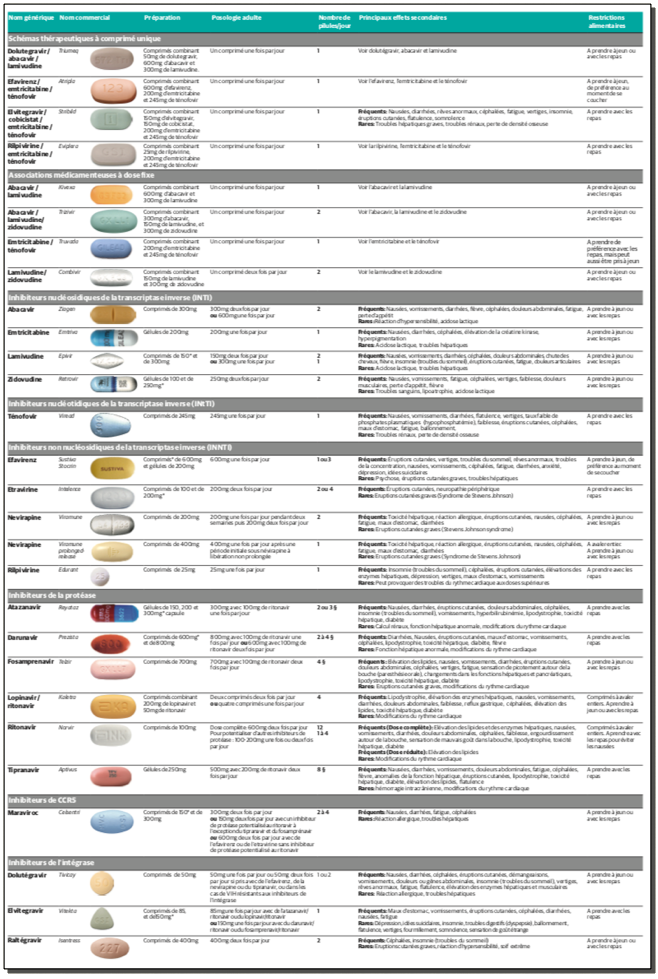
D-Le traitement antirétroviral
Il est nécessaire de faire une évaluation du rapport bénéfices/ risques pour la mère et pour l’enfant vis-à-vis des 3 points suivants : la prévention de la transmission maternofoetale, l’embryo/foeto-toxicité potentielle et le risque de progression de la maladie VIH chez la mère. Il ne doit pas y avoir de décision dans l’urgence. Il faut expliquer qu’on ne peut jamais garantir à la mère que l’enfant ne sera pas contaminé, et que le risque de transmission au foetus est corrélé aux taux de CD4 et à la charge virale de la mère, sans qu’il existe une valeur seuil au-dessous de laquelle le risque serait nul.
Ci-dessous: présentations des antirétroviraux (2011):
E-La naissance
Quelque soit la voie et le timing de l’accouchement, une prophylaxie perpartum par Retrovir ® intraveineux sera instaurée jusqu’à clampage du cordon.
1- La voie d’accouchement
Le risque de transmission maternofoetale est augmenté en cas de rupture prolongée de la poche des eaux, de chorio amniotite, de fièvre pendant le travail, d’infection cervico-vaginale, et/ou d’accouchement prématuré. Le mécanisme précis de cette transmission n’est pas complètement élucidé. Elle survient dans 70 à 80 % des cas dans les derniers jours de la grossesse, pendant le travail ou lors de l’accouchement. Des arguments plaident pour une transmission in utero en fin de grossesse ou en per-partum, cela explique l’importance du traitement antirétroviral administré pendant le 3ème trimestre, l’accouchement et chez le nouveau-né où, chez ce dernier, il équivaut à une prophylaxie de type post-exposition. L’allaitement maternel augmente le risque de 5 à 15 %.
L’effet protecteur d’une césarienne programmée à membranes intactes avant tout début de travail est maintenant établi. Elle est proposée à 38 semaines. La rachi-anesthésie ou la péridurale gardent leurs indications habituelles. Le cordon doit être désinfecté avant d’être coupé immédiatement. Le nouveau-né doit être lavé puis trempé dans un bain de dakin ou de chlorure de benzalkonium. Les précautions prises par le personnel soignant sont les précautions habituelles devant tout sujet séropositif : protection des yeux, bottes, double paire de gants…
Toutefois, Cette attitude peut être un peu revue depuis l’apparition des multithérapies antirétrovirales. l’attitude qui se fait jour actuellement est la suivante:
-si charge virale>400 copies/ml: césarienne programmée;
-si charge virale <50 copies/ml: essai de voie basse (en l’absence de contre-indication obstétricale);
-si charge virale entre 5 et 400 copies/ml: discussion au cas par cas.
l’effet bénéfique de la césarienne n’existe plus une fois que la travail a débuté ou après rupture des membranes.
2-Prophylaxie pendant l’accouchement
Elle concerne toutes les femmes enceintes connues séropositives pour le VIH, qu’elle soit traitée ou non, quel que soient son bilan immunitaire et sa charge virale
Si césarienne programmée :
– au moins 4h avant la césarienne, poser une perfusion de retrovir selon ce schéma :
2mg/kg la 1° heure puis 1mg/kg les heures suivantes c’est-à-dire jusqu’auclampage du cordon même si la perfusion doit s’écouler au-delà de 4h.
– arrêt de la perfusion après clampage cordon
– reprise du traitement habituel antirétroviral le lendemain.
Si la patiente arrive en travail et quel que soit le mode d’accouchement choisi
– perfusion de retrovir sur le même schéma que précédemment jusqu’à l a naissance
et le clampage du cordon
– Si rupture des membranes avant travail : ne pas attendre le lendemain pour déclencher ou décider d’une césarienne et poser la perfusion de retrovir
3- Conduite à tenir pour le nouveau-né
a-Pour le nouveau né de mère séropositive pour le VIH dont la prise en charge a été acceptée et de qualité ( CV maternelle indétectable à 30 SA): Retrovir 4 mg/kg toutes les 12h pendant 4 semaines.
b- Pour le nouveau né de mère séropositive pour le VIH dont la mère n’a pas été traitée : traitement renforcé obligatoire
c-Pour le nouveau né de mère séropositive pour le VIH dont la mère présente les caractéristiques suivantes :
-durée insuffisante du traitement maternel (3èmetrimestre)
-CV maternelle > 1000 copies/ml,
-facteurs de risque à l’accouchement (RPDE prolongée, hémorragie, blessure NNé…) :
traitement renforcé à discuter. Ce traitement est a débuter le plus tôt possible (tjs avant 48-72h)
V-Projet de grossesse
Un projet de grossesse doit être discuté de manière multidisciplinaire entre l’infectiologue, le pédiatre, le psychologue, l’obstétricien et le couple. Trois éléments sont à considérer :
A-Le statut immunitaire (lymphocytes CD4) et virologique(charge virale)
En dehors de tout traitement, la transmission verticale est d’autant plus faible que le nombre de lymphocytes CD4 est normal ou proche de la normale (> 500/mm3) et que la charge virale (CV) est faible (< 10 000 cop/ml). Les traitements anti-rétroviraux modifient leur valeur pronostique. Avec la prophylaxie par AZT en monothérapie, ces paramètres biologiques conservent une valeur pronostique mais avant le traitement . Toutefois, il n’y a pas de seuil connu de charge virale en dessous duquel le risque de transmission est nul. Des cas de transmission ont été rapportés chez des mères ayant un ARN VIH plasmatique inférieur à 500 copies/ml.
L’existence d’un déficit immunitaire avéré (CD4 < 200/mm3) ou d’une charge virale élevée (CV > 100 000 cop/ml) doit conduire à faire reconsidérer le désir de grossesse par le couple.
B- Les antécédents thérapeutiques (molécules, ancienneté du traitement, efficacité ou échec thérapeutique…)
La patiente naïve de tout traitement constitue le cas le plus favorable pour la mère et l’enfant car l’embryon ne sera pas exposé à un risque tératogène au premier trimestre. Par ailleurs, le traitement instauré en cours de grossesse aura d’autant plus de chances d’être efficace que la ou les souches dont est porteuse la patiente ne seront pas mutées. Au cours des dernières années, la proportion de femmes déjà traitées avant d’être enceintes a considérablement augmenté.
C-Les conditions sociales et personnelles.
Un nombre croissant d’enfants nés de mères séropositives sont élevés par une autre personne que la mère naturelle pour différentes raisons : incarcération, décès de la mère, statut social précaire incompatible avec l’élevage d’un enfant, maltraitance… Il faut savoir être vigilant et ne pas encourager une grossesse si le contexte personnel, conjugal et social est défavorable, indépendamment du VIH. Il est donc important d’aborder avec la femme les aspects psychologiques personnels de son projetd’enfant
VI-L’interruption thérapeutique de grossesse (IMG)
Devant un risque de transmission maternofoetale important ou une situation maternelle préoccupante, l’interruption médicale de grossesse (IMG) peut être demandée par la patiente ou son médecin. Jusqu’à 13 SA, une aspiration suivie d’un curetage évacuateur complémentaire sera réalisée. Ensuite, on utilisera une méthode médicamenteuse associant RU 486 suivi 48 heures plus tard des analogues de prostaglandines pour induire un travail artificiel, le plus souvent par voie orale.
Une antibiothérapie n’est en général pas nécessaire mais elle est d’indication large devant une patiente fortement immunodéprimée, une IMG qui se prolonge ou des gestes invasifs nécessaires (laminaires, curetage complémentaire, révision utérine).