Principe général
Le Diagnostic pré-implantatoire ou DPI, consiste à rechercher certaines anomalies génétiques sur des embryons obtenus par fécondation in vitro (FIV). Les embryons non porteurs de l’anomalie sont transférés dans l’utérus et les embryons atteints sont détruits. Cette technique est interdite dans certains pays, légalement encadrée dans d’autre ou encore totalement libre dans certains autres.
Le DPI se présente comme une alternative au diagnostic anténatal et s’adresse aux couples à risques génétiques, soit que l’un des membres du couple ou les deux, ait une anomalie génétique connue dans la famille, soit qu’un premier, voire un deuxième enfant, ait révélé l’existence d’une transmission génétique d’une maladie.
Malgré la difficulté d’obtenir une grossesse par cette méthode, un certain nombre de couples fertiles a recours à cette nouvelle technique afin d’éviter le traumatisme physique et psychique que représente une interruption médicale de grossesse au troisième ou quatrième mois de grossesse. Pourtant, comme le DPI est pratiqué pour chercher sur l’embryon un défaut génétique unique pour chaque couple demandeur, le DPI n’exclue pas au cours de la grossesse les tests de dépistage usuels et donc le recours à l’interruption médicale de grossesse en cas d’apparition d’un handicap.
Le DPI n’est pratiqué que dans certains centres. Les deux tiers des diagnostics concernent la détermination du sexe pour éliminer les embryons de sexe masculin à risque car peut-être porteurs d’une maladie liée au chromosome X.
Le DPI permet de caractériser le statut génétique d’un embryon, il est utilisé pour :
-déterminer le sexe de l’embryon ce qui permet d’identifier une/des affections liées au chromosome X (il en existe plus de 200). Les manifestations les plus fréquentes de ces anomalies sont la dystrophie musculaire (myopathie de Duchêne) et l’hémophilie. Le sexage des embryons permet donc de ne transférer que des embryons de sexe féminin sains ou porteurs hétérozygotes et de ne pas transférer les embryons masculins qui sont atteints une fois sur 2 ou indemnes dans un cas sur deux;
-chercher un défaut génétique unique, comme la mucoviscidose;
-rechercher une maladie chromosomique comme des translocations (réciproque ou robertsonienne) ou des inversions ; anomalies de nombre (Syndrome de Klinefelter, trisomies).
Dans certains pays il a des indications plus larges, comme la recherche de la trisomie 21 chez les femmes de plus de 38 ans, voire le dépistage de susceptibilité à un cancer familial, ou le choix du sexe par convenance. Aux Etats Unis, le DPI a même été utilisé pour créer un enfant qui puisse donner ses cellules à sa grande sœur atteinte d’une maladie génétique grave. Egalement, en février 2002 et pour la première fois en Angleterre, un enfant est né après avoir été conçu et sélectionné pour être donneur compatible avec son frère aîné, leucémique.
Technique
Le professeur Alan Handyside est l’initiateur de cette technique ( Handyside AH, Kontogianni EH, Hardy K, Winston RM. Pregnancies from biopsied human reimplantation embryos sexed by Y-specific DNA amplification, Nature 1990; 344: 768-70). Avec son équipe, il fut le premier, en 1990, à décrire l’obtention de grossesses après la détermination du sexe d’embryons obtenus in vitro. Cette détermination du sexe des embryons avait été proposée à 5 couples risquant de transmettre une maladie liée au chromosome X. L’approche utilisée pour ce travail était d’amplifier par PCR un fragment d’ADN répété, spécifique du chromosome Y, l’absence d’amplification attestant de la féminité de l’embryon.
La technique repose sur 2 étapes : le prélèvement d’une ou plusieurs cellules embryonnaires puis l’analyse génétique de cette cellule.
Il s’agit d’obtenir des embryons in vitro de trois jours, au stade de six à huit cellules, sur lesquels sont prélevées une ou deux cellules provenant des premières divisions de l’œuf fécondé (blastomère). Pour prélever cette/ces cellules, l’embryon est maintenu par une pipette à bord large, sur laquelle on exerce une légère dépression. Un trou est pratiqué dans la zone pellucide qui entoure et maintient les cellules ensemble, soit en injectant un jet d’acide tyrode grâce à une pipette très fine, soit, technique plus récente, à l’aide d’un laser. Une ou deux cellules sont ensuite prélevées par aspiration dans une micropipette au diamètre légèrement inférieur à celui des blastomères (Fig. 1 et 2).
La cellule une fois prélevée peut être fixée et acheminée jusqu’au laboratoire de biologie moléculaire et/ou de cytogénétique qui fera le diagnostic. Selon le type d’affection à diagnostiquer, tel ou tel laboratoire sera sollicité selon sa spécialisation. Ces cellules sont donc analysées dans le but de rechercher une anomalie génétique ou chromosomique. Seuls les embryons sains (qui peuvent néanmoins être porteurs du trait génétique mais ne pas l’exprimer) ou indemnes seront réimplantés dans l’utérus de la mère. Les embryons malades seront supprimés.
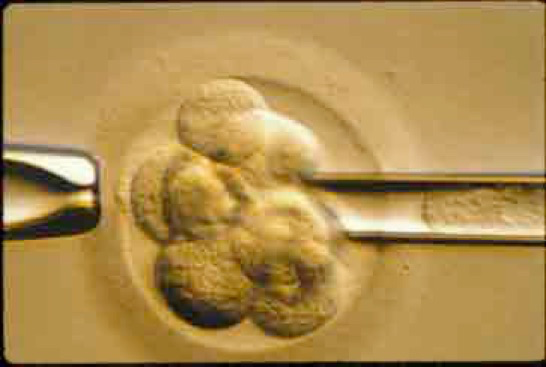
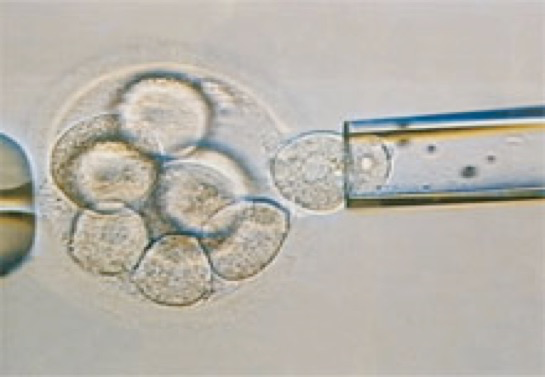
Difficultés et questions posées par le DPI
Les principales difficultés techniques sont liées aux techniques de diagnostic, à la qualité des embryons obtenus par FIV et aux sources de contaminations.
A la base, le DPI repose sur une fécondation in vitro. La première FIV date de 1978 et est de pratique courante depuis le milieu des années 1980. Les technologies de biologie moléculaire sont encore plus récentes, la réaction en chaîne de polymérase (PCR) date de 1987, et l’hybridation in situ avec des sondes fluorescentes (FISH) du début des années 90.
La pratique de DPI est possible du fait du grand nombre d’embryons obtenus lors de la FIV ( 6 à 8 dans les bonnes situations ) assurant statistiquement la présence d’au moins un embryon sain sur l’ensemble des embryons analysés. Mais cette production importante d’embryons pose ensuite le problème de l’avenir des embryons surnuméraires.
Il existe différentes méthodes de diagnostic dans le cadre de la pratique du DPI :
-diagnostic par PCR, Polymerase Chain Reaction – la PCR permet d’identifier des mutations et de reproduire en grandes quantités les fragments d’ADN.
-diagnostic par FISH – permet de déterminer partiellement le contenu chromosomique d’un noyau notamment développé pour déterminer le sexe de l’embryon. Diagnostic proposé pour les pathologies récessives liées au chromosome X. La FISH ne présente pas les problèmes de contamination liés à la PCR et nécessite un temps de manipulation très réduit.
Le dépistage ou screening génétique préimplantatoire (PGS) des embryons issus de fécondation in vitro (FIV) a en outre été proposé dans les indications d’âge maternel élevé, de fausses couches spontanées (FCS) à répétition ou d’échecs répétés d’implantation en FIV, d’autant que certaines études avaient montré. De nombreuses études non randomisées ont été publiées, retrouvant une augmentation du taux d’implantation, ainsi qu’une diminution des taux de FCS et de trisomies. Or, depuis ces dernières années plusieurs études, multicentriques et randomisées, donc assurant un bon niveau de preuve, ont mis en évidence que non seulement le PGS n’augmentait pas les taux de grossesse et de naissance après FIV chez les femmes de plus de 35ans, mais qu’au contraire il les diminuait significativement. Il n’élimine pas non plus le risque de fausses couches et peut être source d’erreurs s’il ne prélève qu’une cellule, des embryons normaux pouvant être éliminés. Le diagnostic serait plus fiable avec un prélèvement de deux cellules, mais dans ce cas les embryons ont un plus faible taux d’implantation. Enfin il est apparu que certains embryons porteurs d’une ou deux cellules à caryotype anormal peuvent spontanément s’adapter et avoir un développement normal par la suite.
Si on ajoute à cela les vastes débats éthiques posées par une pratique non contrôlée du DPI qui à grande échelle peut aboutir à l’eugénisme et à la volonté d’améliorer l’espèce, comme à la question éthique du choix du sexe pour convenances personnelles (pratiqué dans certains centres dans le monde), il faut en conclure que cette technique doit être proposée dans des indications médicales très précises.