Pourquoi la génomique ?
Les traitements appliqués aux cancers du sein sont des traitements souvent lourds, en particulier les chimiothérapies dont les effets secondaires sont bien connus. La décision de faire ou non une chimiothérapie est encore aujourd’hui dans la plupart des cas guidée sur les éléments pronostiques suivants : l’âge de la patiente, la présence d’embols vasculaires, la présence de ganglions envahis, la taille de la tumeur, le grade histologique, l’absence de récepteurs à l’estradiol, la surexpression Her2,le Ki67, etc. Malgré tout cela on sait maintenant qu’un certain nombre de patientes sont traitées par excès c’est-à-dire inutilement, sans bénéfice réel mais avec les effets secondaires de la chimiothérapie qui sont nombreux et responsables d’une dégradation de la qualité de vie qu’elle entraîne (perte de cheveux, neuropathies périphériques, déclassement social…). A l’opposé, il est aussi apparu qu’un (faible) pourcentage de patientes qui n’ont pas eu de chimiothérapie parce que les éléments pronostiques étaient bons auraient pu en bénéficier. Autrement dit, le raisonnement actuel fondé sur les critères pronostiques classiques peut se tromper dans les deux sens : soit il suggère une chimiothérapie à des patientes qui n’en ont pas besoin, soit il considère, au contraire, cette thérapie inutile pour des femmes qui en auraient besoin.
L’amélioration de la pertinence de ces indications repose actuellement sur l’étude du génome de la tumeur. Les 25000 gènes du génome humain ont été étudiés de façon a sélectionner ceux qui caractérisent le pronostic de ces tumeurs. On a ainsi mis en évidence des groupes de gènes qui sont indicateurs de tumeurs de bon ou de mauvais pronostic ainsi que du risque de récidive. On parle de signature de gènes ou de tests génomiques.
Avec plus de 50 000 cas de cancer du sein décelés chaque année et une chimiothérapie prescrite pour 80% des cas, le recours à ce type de test et la prise en compte de ses résultats peut permettre d’éviter la chimiothérapie à au moins 30% de ces patientes.
Les tests génomiques actuellement disponibles
Quatre tests génomiques sont utilisés à ce jour avec des validations cliniques différentes en termes de populations étudiées et de modalités d’études :
-ceux dits de première génération :
-Oncotype Dx® (Genomic Health),
-Mammaprint (Agencia).
-Ceux dits de deuxième génération :
-Prosigna® (NanoString),
-Endopredict® (Myriad) .
La validation de ces tests
L’intérêt de ces test est évalué selon
-des facteurs pronostiques, c’est-à-dire l’absence de récidives à 5 ou 10 ans sous hormonothérapie ;
-des facteurs prédictifs de bonne réponse au traitement de chimiothérapie ou de thérapie ciblée pour HER2. Les réponses attendues à l’utilisation de ces tests sont: la validation, la rigueur, la correspondance entre les tests, la reproductibilité entre les différents tests délocalisés, le panel de gènes utilisés : (cycle cellulaire, invasion, angiogenèse et métastase), la correspondance avec la classification moléculaire de la tumeur.
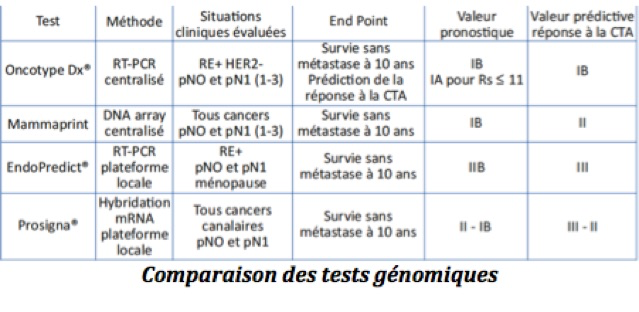
A-Oncotype DX
Il est commercialisée par la compagnie Genomic Health basée à Redwood en Californie. Le test est réalisé à partir d’un tissu tumoral du cancer du sein invasif fixé au formol et enrobé de paraffine. Le tissu est obtenu par tumorectomie, mastectomie ou microbiopsie. Il requiert un bloc tumoral et une lame HE du même bloc. Lors de l’envoi des blocs, 35 à 65 microns de tissu seront généralement utilisés. Les résultats du test Oncotype DX sont généralement disponibles sous 7 à 10 jours à compter de la date de réception de l’échantillon par Genomic Health. Les résultats du test seront envoyés par fax, par courrier express (du jour au lendemain) ou par transfert en ligne sécurisée.
La technique d’amplification des gènes de Oncotype Dx® est réalisée par qRT-PCR et est centralisée. Elle se base sur 21 gènes pour lesquels les valeurs respectives des gènes de prolifération (angiogenèse et invasion), de cycle cellulaire et de métastase. Les patientes incluses dans les études présentaient un statut pré- et post-ménopausique ; leur tumeur exprimait des récepteurs hormonaux positifs, un HER2 non surexprimé ; les patientes étaient initialement sans atteinte ganglionnaire. Afin d’élargir le test aux atteintes ganglionnaires, l’étude RxPonder en cours intègre l’atteinte d’au moins 3 ganglions envahis.
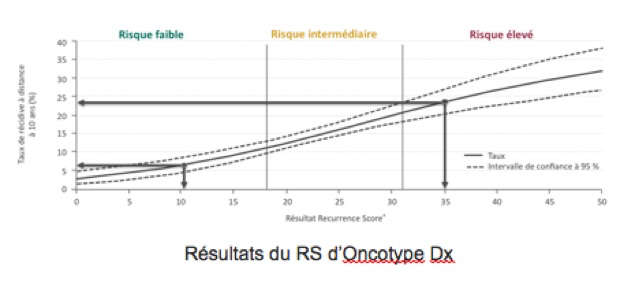
Le résultat du test exprime le risque de récidive appelé Recurrence Score (RS). Le recurrence score comprend 3 catégories de risque : élevé, intermédiaire et faible :
-Un RS faible correspond à un faible risque de récidive, une sensibilité à l’hormonothérapie et un bénéfice minime voire nul de la chimiothérapie.
-Un RS élevé correspond à un risque de récidive plus élevé, une moindre sensibilité à l’hormonothérapie et un bénéfice plus important de la chimiothérapie.
B-Mammaprint
Le test Mammaprint a été développé par l’équipe du NKI d’Amsterdam et commercialisée par la compagnie Agendia (Pays-Bas).
Il se fonde sur 70 gènes par une technique de micro-array ADN réalisée, contrairement aux autres tests, en tissus frais. L’analyse est centralisée. L’étude principale et prospective de validation est MINDACT. Les patientes incluses étaient pré- et post-ménopausées, présentant de 0 à 3 atteintes ganglionnaires quels que soient les récepteurs hormonaux et l’expression d’HER2. Un risque génomique par Mammaprint et un risque clinique calculé sur la base d’Adjuvant ! On line ont permis de classer les patientes en bas ou haut risque de récidive. L’étude a permis de valider la survie sans récidive à 5 ans pour les patientes appartenant au groupe discordant ayant un risque clinique élevé et un risque génomique faible non traitées par chimiothérapie.
C-Prosigna®
Le test pronostique d’expression génomique Prosigna® a été développé sur la base de la signature génique PAM50. Cette signature compare 50 gènes de la tumeur à la classification moléculaire selon les 4 sous-types luminal A et B, HER2+ et triple négatif sur une plateforme centralisée. Le test est réalisé par hybridation du mRNA sur des plateformes locales décentralisées. Les études de Prosigna® ABCSG8 réintègrent 46 de ces gènes à la taille de la tumeur afin de calculer le risque de récidive ROR (risk of recurrence) sur des plateformes délocalisées.
L’enjeu des tests décentralisés est d’assurer une bonne reproductibilité, ce qu’a pu confirmer Prosigna®.
La validation clinique a porté sur des patientes ménopausées, pour lesquelles les tumeurs exprimaient des récepteurs hormonaux positifs, un HER2 non surexprimé, avec ou sans atteinte ganglionnaire. Le ROR classe les patientes en 3 groupes de risque : haut, intermédiaire et bas.
D-Endopredict®
Le test Endopredict®, est fondé sur l’analyse en qRT-PCR sur des plateformes locales décentralisées à partir de la cohorte TransATAC sur la base des études ABCSG6 et 8. En France il est réalisé sur un site de référence à l’hôpital Saint-Louis à Paris. La validation clinique a intégré des femmes ménopausées avec récepteurs hormonaux positifs, HER2 non surexprimé et avec ou sans atteinte ganglionnaire. Le score EPclin est la résultante d’un algorithme intégrant le score moléculaire de 12 gènes associé à la taille et au nombre de ganglions envahis. Le score de risque est classé en bas et haut risque.
L’objectif de ces tests génomiques est d’informer sur le pronostic des patientes, à savoir le risque de récidive sous hormonothérapie. Pour Mammaprint, il est à 5 ans et pour les autres tests à 10 ans.
L’utilisation de la cohorte ATAC d’Oncotype Dx® a permis, en plus de la valeur pronostique du test et de la survie sans métastase, d’obtenir une donnée prédictive à savoir s’il existe un réel bénéfice à la chimiothérapie pour éviter une récidive à 10 ans. L’analyse Mammaprint a aussi été réalisée en prospectif ; elle permet de même d’obtenir une information sur la survie sans métastase à 10 ans et a une valeur prédictive.
C’est donc grâce aux informations fournies par les validations cliniques que ces tests ont été classés par les sociétés savantes comme l’AJCC (American joint committee on cancer) selon les critères de l’EBM (Evidence-based medecine).
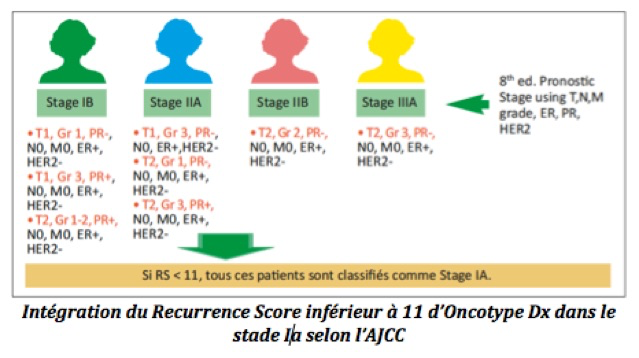
Le test Oncotype Dx® a été intégré dans la classification des cancers du sein avec un stade IA pour une tumeur avec un RS < 11. La valeur prédictive de réponse à la chimiothérapie calculée sur le RS d’Oncotype Dx® correspond à niveau de preuve IB, le score de Mammaprint à un niveau II et ceux d’Endopredict® et Prosigna® à un niveau III (voire II pour Prosigna®).
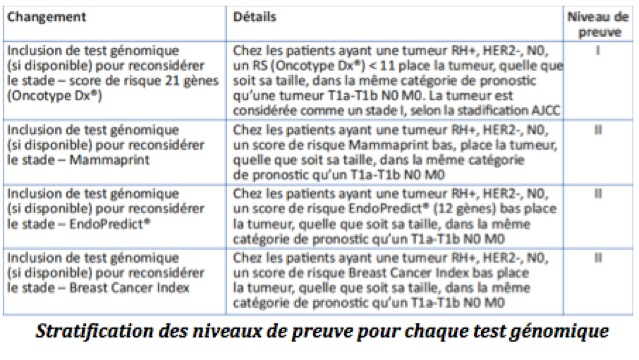
Bien que les tests Endopredict® et Prosigna® soient rétrospectifs contrairement à Mammaprint et Oncotype Dx®, l’apport des critères cliniques dans le calcul du risque de rechute est une donnée complémentaire qui peut être utile pour les équipes.
Les indications de ces tests
Les patientes concernées par cette nouvelle approche dépend du type de test utilisé. Les cas sont résumés dans le tableau ci-après :
Le remboursement de ces tests
Officiellement ces tests ne sont pas remboursés en France par la Sécurité Sociale. Dans d’autres pays tels que le Royaume-Uni, l’Espagne, le Canada, la Suisse ou encore l’Allemagne, ils sont remboursés. Toutefois, il est de plus en plus évident que l’économie générée par la disparition de 30% de chimiothérapies présente un avantage économique comparé aux coûts de ces test (entre 1000 et 3000 euros chacun).
La Direction Générale de l’Organisation des Soins (DGOS) du Ministère de la Santé a mis en place un nouveau système de soutien à l’innovation en biologie et en anatomie et cytologie pathologiques (ACP) : le référentiel des actes innovants hors nomenclature ou RIHN. La volonté de la DGOS est que le référentiel RIHN accueille des actes réellement innovants de biologie médicale et d’anatomocytopathologie. Et, près bien des tours et des détours, un processus de remboursement a été proposé en 2016. Le système est complexe, comme souvent en France, mais il permet de ne plus limiter l’accès aux tests à quelques femmes chanceuses, riches ou bien informées. Le dispositif est financé par la Direction Générale de l’Offre de Soins qui dépend du Ministère de la Santé (et pas de l’Assurance Maladie) avec, pour les établissements demandeurs, un remboursement fixé à 1850 Euros.
On notera cependant que le dispositif ne fait pas le tri dans les tests remboursés, remettant à demain les choix nécessaires car les signatures génomiques ne sont pas identiques (le nombre de gènes, les gènes testés, les technologies utilisées et la qualité des études de validation diffèrent beaucoup.