Décrit pour la première fois en 1935 par Stein et Loeventhal, le syndrome dit aujourd’hui des « ovaires polykystiques » ou PolyCystic Ovary Syndrome (PCOS) en anglais est une anomalie fréquente, observable chez 5 à 10% des femmes, qui retentit sur bien des aspects de la santé féminine en particulier dans le domaine de la reproduction, mais qui grade encore une part de mystères malgré les progrès faits récemment dans sa compréhension.
Un syndrome difficile à définir
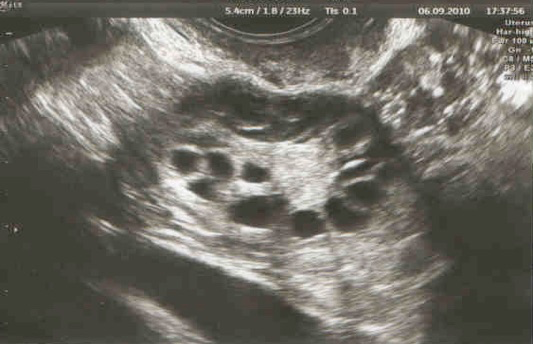
Le terme d’ovaires polykystiques fait en effet référence à ce qui est un aspect échographique, c’est-à-dire la constatation de trop nombreux follicules à la surface des ovaires. Or, les progrès des appareils d’échographies permettent maintenant d’observer un tel aspect de façon très fréquente, sans qu’il s’agisse pour autant d’un véritable syndrome des ovaires polykystiques. Ce diagnostic ne peut donc être raisonnablement porté sur le seul aspect échographique. Récemment, un groupe de travail international (consensus de Rotterdam) a proposé ce syndrome comme l’association d’au moins deux des critères suivants :
-un trouble net de l’ovulation (oligo ou anovulation) ;
-une hyperandrogénie, soit clinique (acnée, peau grasse, chute des cheveux, hyperpilosité), soit biologique ;
-des ovaires polykystiques à l’échographie (plus de 12 follicules de 2 à 9mm sur au moins un des ovaires.
Ces critères restent cependant discutés car ils mettent l’accent sur l’importance des troubles fonctionnels dans le diagnostic : il est en effet possible d’avoir un SOPK sans ovaire polykystique échographique et inversement, leur présence ne signe pas le diagnostic. Certains spécialistes critiquent cette définition qui, à leurs yeux, ne met pas suffisamment l’accent sur l’hyperandrogénie, élément physiopathologique essentiel mais actuellement non nécessaire au diagnostic. De plus Cinquante à 70 % des femmes atteintes du SOPK ont un excès pondéral. Beaucoup sont obèses, bien que l’obésité n’ait pas de rôle causal dans le développement du syndrome, mais soit plutôt la conséquence de l’insulinorésistance. L’excès d’adiposité pourrait d’ailleurs aggraver les troubles reproductifs et métaboliques associés.
On retiendra donc que le diagnostic de syndrome des OPK ne doit pas être porté à la légère ; que l’aspect échographique ne suffit pas ; qu’il est possible d’avoir un aspect échographique d’ovaires polykystiques sans avoir de trouble de l’ovulation associé ; qu’il ne faut pas confondre ovaires polykystiques (à l’échographie) et syndrome des ovaires polykystiques ; et que l’hyperandrogénie, qu’elle soit clinique ou biologique reste un signe majeur.
Cause et mécanisme du syndrome des ovaires polykystiques
Ce syndrome comprend de nombreuses anomalies qui interagissent entre elles selon ce qu’on a appelé un « cercle vicieux », sans qu’il soit possible d’y reconnaître une cause unique. Il semble aujourd’hui que cette maladie soit primitivement d’origine ovarienne.
Prenons ces éléments un par un.
1-Au niveau de l’hypophyse, il y a une hypersécrétion de la LH hypophysaire. Et généralement le bilan hormonal effectué en début de cycle montre un taux de LH supérieur au taux de FSH, ce qui est anormal. On sait par ailleurs que la sécrétion de FSH et LH sont sous la dépendance de l’hormone gonadolibérante hypothalamique (Gn-RH) et que c’est la pulsatilité de la sécrétion de GnRH qui détermine les caractéristiques de ces sécrétions et en particulier la proportion relative de LH et de FSH synthétisée par l’antéhypophyse : plus la fréquence de libération de GnRH est grande plus la synthèse de LH est favorisée au détriment de la FSH. Or, il semble que les femmes atteintes du syndrome des ovaires polykystiques aient une fréquence accrue de libération de LH (et donc de Gn-RH). Cette accélération de l’horloge hypothalamique pourrait être due aux niveaux relativement bas de la progestérone résultant de la pauci-ovulation ou (et) à une anomalie intrinsèque du générateur de GnRH dont l’origine est l’oscillateur arqué.
2-l’hyperandrogénie et l’hyperinsulinisme. Ce taux accru de LH provoque une sécrétion accrue d’androgènes par la thèque interne de l’ovaire. Mais aussi, l’hyperinsulinisme contribue de manière directe et indirecte à l’hyperandrogénie : au niveau de la thèque, l’insuline potentialise la synthèse des androgènes induite par la LH. Elle inhibe également la synthèse hépatique de la sex hormon binding globuline (SHBG), protéine sérique de liaison à la testostérone. La conséquence est une augmentation de la fraction libre (biodisponible) de testostérone circulante. Ainsi, les femmes porteuses du syndrome des ovaires polykystiques associent-elles souvent hyperandrogénémie, insulinorésistance, LH élevée et SHBG basse, alors que la testostérone sérique totale peut être normale ou modérément augmentée.
Bien entendu, les autres maladies pouvant causer une symptomatologie identique doivent être exclues (acromégalie, maladie de Cushing, bloc en 21-hydroxylase, hyperprolactinémie, tumeur endocrinienne sécrétante, prise occulte d’androgènes…).
3-Au niveau de l’ovaire. L’hyperandrogénie stimule l’entrée en croissance des follicules primordiaux et diminue les phénomènes d’atrésie des follicules. Cela a pour effet de créer et de maintenir un grand nombre de follicules de petite taille. Cela conduit à un véritable arrêt folliculaire et à l’absence de sélection d’un follicule dominant. L’hyperinsulinisme contribue également à perturber le mécanisme de dominance en induisant une acquisition trop précoce des récepteurs à la LH sur les cellules de la thèque interne des ovaires. Cette perturbation du mécanisme de la dominance folliculaire a pour conséquence l’absence d’ovulation.
4-L’hyperinsulinisme. Il va de pair avec une résistance à l’insuline (insulinorésistance). Cette insulinorésistance semble être d’origine génétique, transmise par la mère ou peut-être par le père.
Les conséquences du syndrome des ovaires polykystiques
Le syndrome a des conséquences sur la fertilité, ce qui nous intéresse ici, mais aussi tout un ensemble de conséquences importantes pour la santé des femmes.
-L’infertilité est présente, selon les études, dans 20 à 74% des cas de ce syndrome. Elle est liée à l’anovulation qui est la conséquence, comme on vient de le voir, de l’arrêt de la maturation folliculaire et de l’absence de dominance. On observe en outre une plus grande fréquence des fausses couches spontanées (dues à l’hyperandrogénie) et de certaines complications de la grossesse (hypertension artérielle gravidique, diabè, prématurité) en relation avec l’obésité et l’hyperinsulinisme.
-Les autres conséquences :
-L’obésité est présente dans 30 à 75% des cas et plus une population est obèse, plus le syndrome est fréquent, comme c’est le cas aux Etats-Unis. Cette obésité est un facteur d’hyperinsulinisme et de risque de complications cardio-vasculaire.
-L’altération de la tolérance au glucose, associée à un certain degré d’insuffisance de sécrétion d’insuline constitue un facteur de risque de diabète gestationnel ou de diabète permanent.
-Le risque de maladies cardiovasculaires et d’hyperlipidémie est augmenté.
Eléments de traitement du syndrome des ovaires polykystiques
Le traitement proposé va être différent selon qu’il existe ou non une infertilité. Mais dans tous les cas, si une obésité est associée, une perte de poids sera toujours bébéfique.
Les traitements du SOPK en cas d’infertilité
Il s’agit ici de l’infertilité liée uniquement au syndrome des ovaires polykystiques, car si par exemple un facteur masculin ou de perméabilité tubaire ets associé, on aura directemnt recours à la fécondation in vitro.
La perte de poids
Une réduction modeste (2 à 7 %) du poids corporel par la modification de style de vie s’accompagne, en pratique, d’une baisse du taux d’androgène circulant et régularise les cycles menstruels des patientes atteintes du SOPK. De la même manière, la diminution de l’insulinémie conduit souvent à la normalisation du cycle menstruel et de la fertilité. Si l’obésité exacerbe la symptomatologie due à l’insulinorésistance, la perte de poids entraîne tout naturellement une amélioration de cette symptomatologie en améliorant la fonction ovarienne et les anomalies hormonales associées. La perte de poids s’accompagne d’une réduction de concentrations en insuline et en androgène et une augmentation du taux de SHBG. Étonnement, chez les SOPK obèses, une perte de 5 à 10 % de poids corporel entraîne le rétablissement de la fonction ovarienne chez 55 à 100 % des patientes dans les six mois suivant la réduction pondérale. C’est donc une mesure simple efficace, bon marché et sans effet secondaire qui constitue donc tout naturellement la première ligne du traitement de la femme obèse. Cependant, l’adhésion au traitement est souvent difficile.
La Metformine
La Metformine est un hypoglycémiant (Glucophage®, laboratoire Lipha Santé ; Stagid®, laboratoire Merck-Clévenot ; Glucinan®, laboratoire Lipha Santé) qui est utilisé dans le traitement du diabète de type 2. Elle semble intéressante dans le traitement des troubles de l’ovulation des syndromes des ovaires polykystiques essentiellement en cas d’obésité associée. Elle ne modifie pas l’insulino-sécrétion mais agit sur l’insulino-résistance périphérique, musculaire et hépatique. Elle est donc efficace en cas d’hyperinsulinisme chez les patients en surpoids. La dose habituelle va de 1 à 2,5 g/j en deux à trois prises, à débuter progressivement en trois semaines du fait d’une tolérance médiocre (douleurs abdominales). Aucun effet tératogène n’a jamais été décrit, ni chez l’homme, ni chez l’animal. Cependant, même s’il reste intéressant chez les femmes en surpoids, l’effet de la Metformine sur la restauration de l’ovulation ainsi qu’en terme de grossesse, semble inférieur à l’utilisation du Citrate de Clomifène, qu’il soit utilisé seul ou en association avec la Metformine .
Le Citrate de Clomifène
Le Citrate de Clomifène (CC) inhibe la fixation des estrogènes à leur récepteur hypothalamohypophysaire et perturbe le rétrocontrôle négatif exercé par ce dernier sur la sécrétion de gonadotrophines. L’hypophyse va réagir en pensant qu’il existe une baisse du taux d’estrogènes et va augmenter sa sécrétion de gonadotrophines.L’induction de l’ovulation par CC (Clomid®, laboratoire Marion Merrell Dow ; Pergotime®, laboratoire Serono) allie simplicité et efficacité. est recommandé de le donner à dose croissante en commençant par 50 mg par jour pendant cinq jours en débutant entre le deuxième et le cinquième jour du cycle spontané et d’incrémenter la dose par palier de 50 mg/j à chaque nouveau cycle entrepris jusqu’à obtenir une ovulation ou jusqu’à la dose maximum de 250 mg/j. Ce traitement doit s’accompagner d’un monitorage de l’ovulation afin d’éviter le risque de survenue de grossesse multiple et de synchroniser l’ovulation avec les rapports sexuels ou l’insémination. Ce traitement ne doit pas être poursuivi trop longtemps car les ¾ des grossesses sont obtenues lors des trois premiers cycles, au-delà il est préférable de passer à un autre traitement. Vingt à 25 % des SOPK anovulatoires ne répondent pas au CC et sont classées résistantes au CC. En général, ces patientes sont plus obèses et présentent une insulinorésistance et une hyperandrogénie plus marquées que celles qui y répondent.
L’adjonction d’une corticothérapie
Une corticothérapie comme la dexaméthasone 0,5 mg/j peut, dans les cas de SOPK avec concentrations élevées du sulfate de déhydroépiandrostérone (SDHEA), éliminer la part surrénalienne de l’hyperandrogénie et permet une réponse au CC chez des patientes initialement résistantes. Bien qu’il s’agisse d’une pratique à la mode, les effets secondaires d’une corticothérapie (même limités dans le temps) comme l’aggravation d’une résistance à l’insuline ou des troubles du comportement alimentaire altéreront sans doute le pronostic reproductif. Utilisée de répétée, cette pratique exposera la patiente au risque d’insuffisance surrénalienne.
Les inhibiteurs de l’aromatase
Ces traitements pourraient remplacer le CC puisque le mécanisme d’action de ce dernier repose sur la perception d’une carence estrogénique au niveau hypothalamohypophysaire et qu’en inhibant l’étape finale de la biosynthèse de l’estradiol, les inhibiteurs de l’aromatase diminuent l’estradiolémie. Les inhibiteurs de l’aromatase n’auraient apparemment pas les effets défavorables du CC au niveau cervical et utérin mais conserveraient en revanche ses propriétés inductrices de FSH. Le Létrozole (Femara®, laboratoire Novartis) est l’anti-aromatase le plus étudié dans cette indication. Il se prescrit à partir du troisième jour du cycle pendant 5 jours. En cas de SOPK anovulatoire n’ayant pas répondu au CC, il a montré son efficacité en étant capable de restaurer l’ovulation et la grossesse . Plusieurs études ont retrouvé un meilleur taux de grossesses et de naissances après traitement d’induction de l’ovulation par létrozole comparé au CC. Une métaanalyse de 2014 a sélec- tionné 14 études prospectives randomisées comparant ces 2 produits sur un total de 2 066 patientes et a mis en évidence un taux de grossesses un peu supérieur dans le groupe ayant reçu du létrozole comparative- ment à celui ayant eu du CC. Elle retrouve également un meilleur taux de naissances chez les patientes traitées par létrozole . Une étude récente compare de façon pros- pective randomisée un traitement par CC augmenté en l’absence de réponse (dose progressive de 50 à 150 mg/j/ 5 jours) à un traite- ment par létrozole également augmenté en l’absence de réponse (de 2,5 à 7,5 mg/j/5 jours) dans une population de 750 patientes ayant un SOPK avec un IMC moyen de 35. Les taux cumulés de naissances vivantes sont de 27,5 % dans le groupe létrozole contre 19 % dans le groupe CC . Les taux cumulés de cycles ovulatoires sont de 62 % dans le groupe létrozole contre 48 % dans le groupe CC. Il n’y a pas de différence dans cette étude dans les taux de malfor- mations, de FCS ni de grossesses multiples entre les 2 groupes. Les auteurs ont analysé les taux de naissances selon l’IMC : la supé- riorité du létrozole est mise en évidence pour les IMC > 30 (p = 0,03 pour IMC entre 30 et 39, et p = 0,09 pour IMC > 39), mais la différence n’est pas significative pour les IMC < 30. Or, l’IMC élevé est un facteur de résistance au CC connu. En revanche, d’après ces données, il ne semble pas impacter l’efficacité du létrozole. Cependant, l’engouement pour le létrozole n’est pas à l’ordre du jour. Il persiste à l’heure actuelle un doute sur l’innocuité des inhibiteurs de l’aromatase pendant la grossesse. En effet, chez l’animal, le létrozole administré en continu pendant l’organogenèse est tératogène. La demi-vie du produit est de 48 heures, entraînant sa clairance complète 10 jours après la dernière prise. Tel qu’il est prescrit actuellement (5 jours en début de cycle), il devrait être éliminé au moment du développement embryonnaire précoce. Les études, jusqu’à ce jour, ne mettent pas en évidence de risque accru de malformation après prise de létrozole comparé au CC. Néanmoins, même si le suivi des grossesses entreprises sous ce traitement n’a pas montré d’effet tératogène, l’effectif est faible et ne permet pas de garantir son innocuité. Des études complémentaires, incluant un nombre important de patientes porteuses d’un SOPK, sont nécessaires pour s’assurer de l’innocuité du létrozole et déter-miner sa place dans l’arsenal thérapeutique.
Le Drilling ovarien
Le « drilling » ovarien consiste à coaguler 4 à 10 points à la surface de chaque ovaire à l’aide coagulation diathermique ou de laser sur une profondeur de 4 à 10mm. Ce geste est réalisé au cours d’une coelioscopie. Il semble que cinq points de coagulation soient suffisants pour rétablir l’ovulation. L’efficacité du drilling semble être proportionnelle à l’énergie délivrée et plaide donc pour l’emploi de 600 Joules. Le drilling permet d’obtenir le retour de l’ovulation et la grossesses dans un certain nombre de cas d’OPK résistant au Citrate de Clomifène. Son effet semble persister une dizaine d’années. Le mécanisme d’action du drilling reste obscur. Il pourrait passer par la destruction du stroma ovarien produisant les androgènes. On constate une diminution de la testostéronémie, de la LH, et (modérément) de l’insulinémie, avec une augmentation de la SHBG. Certaines études ont cerné le profil de patientes susceptibles de répondre au drilling ovarien : jeunes, peu androgynes, aux surpoids modérés et à la LH élevée, âge précoce de la puberté et glycémie perturbée.
Stratégie thérapeutique
La première ligne thérapeutique repose sur le citrate de clomifène pendant 6 cycles. L’échec de ce traitement doit conduire à proposer en seconde intention : les gonadotrophines, la multiperforation et la metformine qui peut être utile. Les données ne permettent pas de conclure à une supériorité d’une stratégie par rapport à une autre. Le groupe de travail a considéré que la multiperforation ovarienne représentait un avantage en termes d’une plus faible fréquence des grossesses multiples et des syndromes d’hyperstimulation ovarienne. La metformine pourrait apporter un intérêt chez les patientes obèses.La prise en charge de l’infertilité liée au syndrome des ovaires polykystiques repose en premier lieu sur la mise en oeuvre de règles hygiéno-diététiques et sur le citrate de clomifène en première intention.Ensuite viennent les gonadotrophines et la multiperforation ovarienne, le tout pouvant entrer en compétition avec la FIV selon les cas. Aucune étude thérapeutique randomisée n’a permis d’établir la place de la multiperforation ovarienne dans la stratégie thérapeutique. Aucune étude ne permet de déterminer l’énergie la plus adaptée : laser ou électrocoagulation, de même que la quantité d’énergie à délivrer.
En cas d’échec de la Metformine, du Citrate de Clomifène et du drilling ovarien la stratégie thérapeutique devient plus difficile puisque la réponse de ces patientes à l’induction de l’ovulation par les gonadotrophines est souvent imprévisible. Parfois, une stimulation ovarienne laborieuse aboutit à une annulation du cycle par défaut de croissance folliculaire mais il arrive aussi qu’avec les mêmes doses, une stimulation polyfolliculaire (explosive) impose elle aussi l’annulation pour risque d’hyperstimulation ovarienne (HSO) et de grossesse multiple. Le syndrome d’hyperstimulation ovarienne est d’ailleurs ce que le médecin de la reproduction redoute le plus lorsque l’échec des précédents traitements ou l’association avec une infertilité masculine lui imposent une stimulation ovarienne sur un SOPK. L’utilisation des gonadotrophines s’accompagne d’un risque sept fois plus élevé de cette complication potentiellement grave et purement iatrogène et ce risque augmente encore lorsqu’on les associe aux analogues de la Gn-RH. D’où la nécessité de commencer par de faibles doses de FSH. Des doses supra physiologiques de FSH provoquent le développement d’une grande cohorte de follicules, en recrutant des follicules normalement destinés à l’atrésie. Ces patientes souffrent donc d’un seuil de stimulation poly folliculaire anormalement bas. Quand les taux sériques de FSH dépassent ce seuil, un développement multi folliculaire est observé. Ce phénomène est utile lorsqu’on pratique une stimulation ovarienne en vue d’une fécondation in vitro. En revanche, quand le but est une stimulation mono folliculaire en vue d’un rapport sexuel programmé ou d’une insémination, la survenue d’une stimulation poly folliculaire oblige à ’annulation. En fait, ce phénomène ne serait pas réellement dû à une sensibilité abaissée du follicule à la FSH mais s’expliquerait par le grand nombre de follicules antraux sensibles à la FSH contenus dans l’ovaire (deux fois plus que un ovaire normal au même âge). Pour ces raisons, l’administration des gonadotrophines se fait préférentiellement selon le protocole step-up low dose, parfois step-down que nous avons décrit dans le chapitre correspondant..
Il semble possible d’utiliser les antagonistes du Gn-RH, dès que les follicules atteignent 14mm, afin d’éviter une ovulation prématurée, comme on les utilise maintenant couramment dans certains protocoles de FIV.
Enfin, le recours à la fécondation in vitro est indiqué en cas d’échec des traitements précédents ou si une stérilité masculine est associée.
En dehors du désir de grossesse, les traitements de ce syndrome peuvent faire appel à d’autres types de traitements:
-dans tous les cas la perte de poids est utile si une obésité est associée;
-si les signes d’hyperandrogénie sont au premier plan on peut proposer la pilule contraceptive (en privilégiant des progestatifs peu ou pas androgéniques), les anti-androgènes comme l’acétate de Cyprotérone (Androcur®), l’épilation au laser ou électrique;
-si l’on veut régulariser les cycles on peut utiliser soit la pilule contraceptive comme précédemment, soit un traitement progestatif par exemple du 16ème au 25ème jour du cycle.
-La Metformine reste intéressante en cas d’obésité et de résistance à l’insuline