I-Le diagnostic des anomalies chromosomiques (aneuploïdies)
Le seul moyen d’être certain que le fœtus est ou n’est pas porteur de trisomie 21 est d’étudier ses chromosomes.
A-Les méthodes d’étude
1-Méthodes invasives
La biopsie de trophoblaste est réalisée entre 11 et 13+6 semaines d’aménorrhée. Elle consiste à prélever une toute petite quantité de tissu placentaire. L’amniocentèse consiste à prélever du liquide amniotique dans lequel flotte le fœtus. Elle est le plus souvent réalisée à partir de 15 semaines d’aménorrhée (3 mois de grossesse)
2-Méthode non invasive : le DPNI
Le DPNI (Diagnostic Prénatal Non Invasif) étudie l’ADN libre circulant dans le sang maternel.
a-Par dépistage ultrasensible
Il est désormais possible dès la 11ème semaine d’aménorrhée de faire le diagnostic prénatal des principales aneuploïdies sur une simple prise de sang maternel sans réaliser d’amniocentèse ou de biopsie de trophoblaste, dont le risque de fausse couche, même très faible, n’est pas nul.
Il existe en fait deux types de tests:
-Un premier test recherchant seulement les anomalies les plus fréquentes, à savoir: Trisomies 21, 13 et 18. C’est le test qui est généralement proposé en France. Ce n’est pas un caryotype. Ce test ne permet pas de détecter les anomalies de structure des chromosomes. Il ne détecte pas les anomalies chromosomiques situées sur les autres chromosomes que ceux qui sont étudiés. Il ne détecte pas les maladies génétiques. Il ne permet pas de détecter les rares trisomies 21, 13, 18 ou les anomalies des chromosomes sexuels lorsqu’elles sont en mosaïques, en particulier en mosaïques faibles (pas présentes dans toutes les cellules). Un problème technique (insuffisance d’ADN libre circulant par exemple) peut exceptionnellement nécessiter de prélever la mère une seconde fois. L’ADN fœtal étudié étant d’origine trophoblastique, ce test ne permet pas de détecter les rares discordances chromosomiques entre fœtus et placenta. Compte tenu de la méthode utilisée et des performances du test, il peut être utilisé en cas de grossesses multiples d’après l’expérience du laboratoire. Un test négatif ne permet pas d’être absolument certain que le fœtus n’est pas atteint d’anomalie chromosomique. En cas de résultat positif la probabilité que l’enfant soit atteint de trisomie 21 est quasi certaine mais devra être confirmée par une amniocentèse avant toute décision éventuelle d’interruption de la grossesse. Enfin, la sensibilité de ce test n’a pas encore été validée dans les population à risque faible d’anomalies chromosomiques.
-Un test qui permet de dépister les trois principales trisomies (21, 13 et 18) et les anomalies des chromosomes sexuels. C’est une extension du précédent. Il s’est graduellement enrichi de la recherche des trisomies 16 et 22 ainsi que des principales microdélétions dépistables de manière non invasive avant la naissance. La plupart sont rares, certaines plus fréquentes, telles le syndrome de Di George (environ 1/2000). Sont actuellement disponibles les recherches de délétion 22q11 (syndrome de Di George), 5p (syndrome du cri du Chat), délétion 1p36, délétion 15q (syndromes d’Angelman et Prader-Willi), 11q (syndrome de Jacobsen), 8q (syndrome de Langer Giedon), 4p (syndrome de Wolf-Hirschorn).
b-Par un véritable cayotype fœtal non invasif
Ce progrès attendu depuis des décennies par les professionnels (et les mères…) est maintenant accessible mais n’est pas remboursé par la Sécurité Sociale. Il est proposé depuis janvier 2013 à l’Hôpital Américain de Paris avec la collaboration du laboratoire d’analyse américain qui a la plus grande expérience dans ce domaine (SEQUENOM CMM). Cet examen dépiste, en plus du dépistage des trisomies 13,18 et 21, plus de 95% des anomalies déséquilibrées supérieures ou égales à 7 Mégabases. Ce test porte sur chaque chromosome du génome, ce qui en fait un test de dépistage dont le seuil de détection est équivalent à celui d’un caryotype fœtal réalisé à partir d’une biopsie de trophoblaste ou d’une amniocentèse. C’est le plus complet et le plus précis actuellement disponible, mais dont le prix est de plus de 1000 euros et qui n’est réalisé qu’aux Etats-Unis. Il est en général considéré que ce test a la même fiabilité qu’un caryotype fœtal étudié par analyse directe des cellules d’une biopsie de trophoblaste.
B-Stratégie de dépistage
La généralisation du caryotype fœtal par méthode invasive pour toutes les grossesses n’a jamais été proposé en raison des risques de ces prélèvements, même s’ils sont faibles.
La généralisation du diagnostic par méthodes non invasives se heurte à un problème de coût. Il faut compter 400 euros environ pour le DPNI simple et plus de 1000 euros pour un caryotype complet.
L’année 2019 a vu une nouvelle avancée avec, en France, avec le remboursement par l’Assurance maladie du DPNI (simple). Un arrêté publié ce 27 décembre 2018 au Journal officiel précise que le dépistage de la trisomie 21 dans l’ADN du fœtus après prise de sang chez la mère figure désormais dans la liste des actes de biologie médicale remboursés.
Ce remboursement ne s’applique qu’aux patientes ayant un risque élevé d’avoir un fœtus porteur d’aneuploïdie. D’où la nécessité de disposer de moyens de calculer ce risque.
Ce calcul de risque repose sur :
-principalement sur le dépistage combiné du premier trimestre, qui se fonde sur la mesure échographique de la clarté nucale (entre 11+0 et 13+6 semaines d’aménorrhée et que la longueur cranio-caudale est comprise entre 45 et 84 mm) et le dosage des marqueurs sériques du 1er trimestre. C’est le calcul intégré du premier trimestre ;
-si ce précédent test n’a pas été fait, sur le dépistage par les marqueurs sériques seuls au deuxième trimestre de grossesse (le prélèvement sanguin pour les dosages biochimiques étant réalisé entre 14+0 SA et 17+6 SA) ; mais ce test est nettement moins pertinent que le précédent ;
-enfin un dépistage séquentiel intégré, qui repose sur la mesure de la clarté nucale au 1er trimestre de grossesse et le dosage des marqueurs sériques du deuxième trimestre est possible mais il pourrait être abandonné compte tenu de ses moins bonnes performances.
Par ailleurs, en cas de clarté nucale ≥ 3,5 mm ou autres signes d’appel échographiques, un caryotype fœtal peut être réalisé.
Les recommandations (HAS) actuelles en France de proposition de prescription du DPNI par test d’étude de l’ADN libre circulant pour Trisomie 21 sont les suivantes :
-Les femmes enceintes dont le niveau de risque de trisomie 21 fœtale est compris entre 1/1 000 et 1/51 à l’issue du dépistage combiné du premier trimestre. Un caryotype fœtal invasif sera proposé d’emblée pour les femmes enceintes dont le niveau de risque de trisomie 21 fœtale est supérieur ou égal à 1/50. Dans ce dernier cas, un test ADNlcT21 pourra cependant être réalisé avant un éventuel caryotype fœtal selon la préférence de la femme enceinte.
-Les grossesses survenant chez des patientes âgées de plus de 38 ans, chez des couples ayant eu un enfant ou un foetus touché par une maladie génétique, chez des couples dont un des deux membres est porteur d’un remaniement chromosomique, et chez des couples ayant un risque important d’avoir un enfant atteint de maladie génique.
-Le DPNI est également pris en charge lorsqu’une échographie de la grossesse a mis en évidence une anomalie morphologique du fœtus.
II-Echographie et facteurs de risque d’aneuploïdie
On le voit, l’étude de’ l’ADN fœtal dans le sang maternel peut être utilisé quand le dépistage classique met en évidence un risque accru.
A-La clarté nucale entre 11+0 et 13+6 semaines d’aménorrhée

C’est à Kypros Nicolaides que revient le mérite d’avoir le premier observé que les fœtus trisomiques avaient statistiquement une clarté nucale plus épaisse que les non trisomiques. Ces observations ont été à la source du dépistage actuel du premier trimestre.
1-Définition
La clarté nucale désigne une collection liquidienne, habituellement très fine, située juste sous la peau de tous les embryons et fœtus entre 2 et 3 mois. Ce terme est utilisé au premier trimestre pour des clartés purement liquides et localisées ou contenant parfois quelques échos et des cloison voire pour les collections qui s’étendent au-delà du cou. Cette clarté nucale disparaît habituellement au deuxième trimestre, mais parfois elle évolue rapidement ou forme d’emblée un œdème permanent et important réalisant l’hygroma kystique du cou ou hygroma colli et, à un stade de plus, le lymphœdème généralisé (fœtus « bibendum ») puis l’anasarque.
2-Technique de mesure
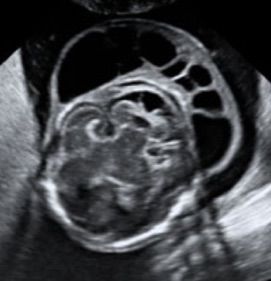
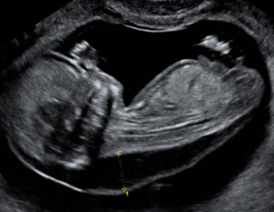
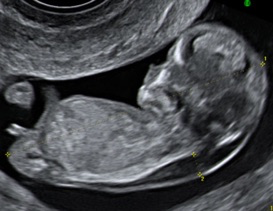
La clarté nucale se mesure chez un fœtus dont la longueur crânio-caudale (LCC) est comprise entre 45 et 84 mm, soit entre 11 SA et 13 SA+6j.
Dans 90 à 95 % des cas l’abord abdominal est suffisant (et c’est la voie utilisée dans les publications initiales). Sinon, l’abord vaginal doit être utilisé si nécessaire mais il faut observer que si la sonde abdominale peut « tourner» autour du fœtus, la sonde vaginale ne tourne que sur elle-même et peut ne pas permettre toutes les incidences souhaitées.
On mesure la longueur cranio-caudale du fœtus sur une coupe sagittale. Cette mesure est nécessaire pour le calcul de risque intégré car elle correspond à l’âge du fœtus.
La mesure de la clarté nucale doit se faire sur une coupe sagittale par un abord orthogonal sur un fœtus « détendu », en position neutre, en utilisant soit l’image de la LCC zoomée soit une coupe spécifique. L’hyperflexion du fœtus peut réduire l’épaisseur de la clarté de 0,4 mm et l’hyperextension la majorer de 0,6 mm. La coupe médiane parfaite montre la pointe du nez, les os propres du nez s’ils sont présents, le centre du menton, sans montrer l’os malaire. Ce paramètre os du nez a été intégré par Nikolaides dans le logiciel qu’il utilise. Le fœtus doit classiquement occuper au moins la moitié de l’image pour mesurer lalongueur cranio-caudale. Pour la clarté nucale, la région cranio-dorsale doit occuper au moins 75 % de l’écran (pas plus car on ne verrait plus le profil et la position du cou d’où une validation impossible a posteriori). Le gain doit être diminué pour définir au mieux les repères de mesure et il est préférable de couper les harmoniques pour la mesure nucale. Il faut mesurer l’épaisseur maximale de la clarté nucale entre la peau et les parties molles recouvrant le rachis cervical. Les calipers sont placés « On-On », la croix du caliper est « posée sur » la ligne de bordure de la clarté, sa barre horizontale est donc « tangente » à la clarté, sans la pénétrer. Plusieurs mesures peuvent être faites au cours de l’examen et on retient la plus grande (des bonnes mesures évidemment).
3-Contrôle de la qualité des mesures : le score de Herman
Pour l’établissement du score de Herman, 6 points essentiels sont à vérifier : 1- coupe sagittale (= 0 ou 2) ; 2- continuité de la peau de la région cervico-dorsale (= 0 ou 2) ; 3- positions des calipers (= 0 ou 2) ; 4- tête en position neutre (= 0 ou 1) ; 5- taille de l’image (= 0 ou 1) ; 6- individualisation de l’amnios (= 0 ou 1). On considère que le score est inacceptable entre 0 et 1, insuffisant pour 2 et 3, acceptable de 4 à 7, excellent pour 8 et 9.

4-Intégration de la clarté nucale au calcul de risque
Si dès 1992, Nicolaides a montré que dans une proportion élevée de fœtus trisomiques, la clarté nucale est augmentée au premier trimestre, c’est-à-dire qu’elle est supérieure au 95e percentile dans 75-80 % des cas et que donc le risque d’anomalie chromosomique est d’autant plus élevé que la clarté nucale est épaisse, on ne raisonne pas en fonction de la mesure elle-même mais en terme de dépistage combiné tenant compte de l’âge maternel, la longueur cranio-caudale du fœtus (= âge du fœtus), l’épaisseur de la nuque et le résultat de marqueurs sériques, cela calculé par un logiciel agréé. Toutefois, au delà de 3,5 mm, le risque sera toujours considéré comme élevé quelques soient les marqueurs sériques et un caryotype peut être proposé (mais par rigueur, il est recommandé d’appliquer la procédure combinée).
Un épaississement nucal associé à un caryotype normal doit faire rechercher une malformation cardiaque.
La grossesse trisomique est associée, statistiquement, à des modifications de concentration dans le sang maternel de différentes molécules d’origine fœto-placentaire (on parle de marqueurs sériques). Pour chaque marqueur, il y a un assez large chevauchement des valeurs entre la population normale et la population avec trisomie. Par exemple, la production de béta-HCG est en moyenne un peu plus élevée dans les grossesses trisomiques par rapport à une population de grossesses normales et c’est l’inverse pour d’autres molécules comme l’alpha-fœtoprotéine (AFP) ou la PAPP-A (Pregnancy Associated Plasma Protein-A). Ces différences sont à l’origine des différents tests sériques, en particulier le FRT 21. Mais ce qui intéresse surtout l’échographiste, c’est l’indépendance des variations de ces marqueurs et de celles de la clarté nucale : par exemple, il n’y a pas de relation statistique entre le taux de béta-HCG et l’épaisseur de la nuque. Ceci permet d’intégrer les deux paramètres dans un calcul de risque combiné dont la performance est supérieure à celle de chaque méthode prise isolément.
B-Autres signes échographiques des aneuploïdie au premier trimestre
En supplément de la mesure de la clarté nucale beaucoup d’autres marqueurs échographiques ont été décrits. Le but est d’augmenter les performances du dépistage au premier trimestre en réduisant le taux de faux positifs. Les quatre marqueurs secondaires significatifs sont l’absence des os propres du nez (OPN), l’augmentation de l’angle facial, le flux inversé dans le canal d’Arantius et la régurgitation tricuspidienne. L’intégration de ces autres marqueurs au calcul intégré est délicate, demande de l’expérience et une certification telle que la réalise à Londres l’équipe de Nicolaides à la Fetal Medecine Foundation.
C-Signes échographiques aux deuxième et troisième trimestre
Nous ne ferons que les énumérer car si elles doivent être connues et reconnues leur importance va diminuer avec le développement du DPNI.
-Malformations cardiaques, digestives, du système nerveux, de la face.
-Retard de croissance intra-utérin.
-Humérus et fémur courts.
-Hydramnios.
-etc.