Définition
L’acné (du genre féminin, sans e à la fin) est une affection dermatologique extrêmement fréquente puisqu’elle atteint plus de 80% des adolescents. Elle commence aux alentours de la puberté, souvent elle en est même le premier signe, car c’est une affection hormono-dépendante sous le contrôle des hormones mâles (androgènes). Chez les sujets de sexe féminin les androgènes sont sécrétés par les ovaires et les surrénales.
Formes cliniques
On distingue :
-L’acné dite rétentionnelle
Les lésions rétentionnelles correspondent à des follicules pilo-sébacés distendus : comédon ouvert (ou encore point noir), comédon fermé ou microkyste. Les manifestations classiques de l’acné dite rétentionnelle, sont la présence de points noirs et de microkystes (boutons blancs ou «papules»).
-l’acné inflammatoire
Les lésions inflammatoires peuvent être superficielles, il s’agit de papules et pustules, et profondes ; on parle alors de nodules. Elle se signale par la présence boutons rouges, et inflammatoires, principalement sur le visage.
-L’acné rétentionnelle et inflammatoire
Ce type d’acné coriace aux traitements classiques associe boutons rouges, boutons blancs et points noirs.
Evolution
Il est classique de dire que l’acné disparaisse avant l’âge de 20 ans mais ce n’est pas toujours la règle. En fait son évolution est imprévisible, influencée en grande partie par l’existence ou non d’antécédents familiaux dans les deux sexes, et l’association ou non de signes de virilisation (hyperpilosité, chute de cheveux, troubles du cycle menstruel).
Toutes les variations hormonales peuvent avoir une influence sur l’acné chez les filles qu’il s’agisse du cycle menstruel (poussées avant les règles), de la prise ou de l’arrêt d’une pilule contraceptive selon les cas, la grossesse, l’accouchement, la ménopause, et a fortiori un mauvais fonctionnement des ovaires… C’est dire que les femmes qui ont acquis génétiquement cette sensibilité aux androgènes (rôle de la 5-alpha réductase ) risquent d’être ennuyées toute leur vie.
Causes et mécanismes de l’acné
1-Le rôle du follicule pilosébacé
L’acné est due à une hyperactivité des follicules pilosébacés soumis à une action excessive des androgènes.
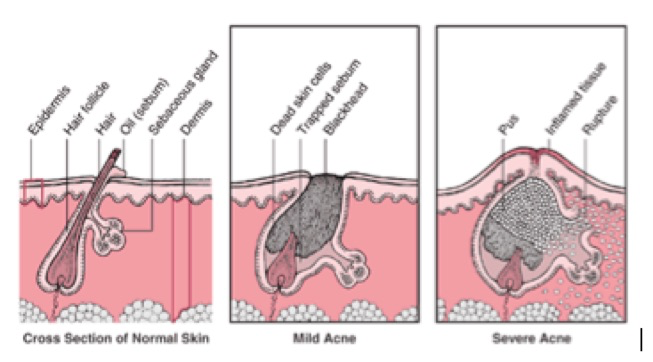
Le follicule pilo-sébacé est une unité constituée par le poil et la glande sébacée. Là se situe le point de départ de l‘acné, car il contient des récepteurs aux androgènes (hormones mâles). Dans la majorité des cas cette sensibilité aux androgènes est héritée génétiquement ce qui explique qu’il y ait des « familles d’acné ». mais ce n’est pas toujours le cas car d’autres facteurs pas toujours bien définis, interviennent : extrinsèques comme l’environnement (pollution, stress, soleil, tabac…) ou intrinsèques comme un dysfonctionnement hormonal chez les filles…
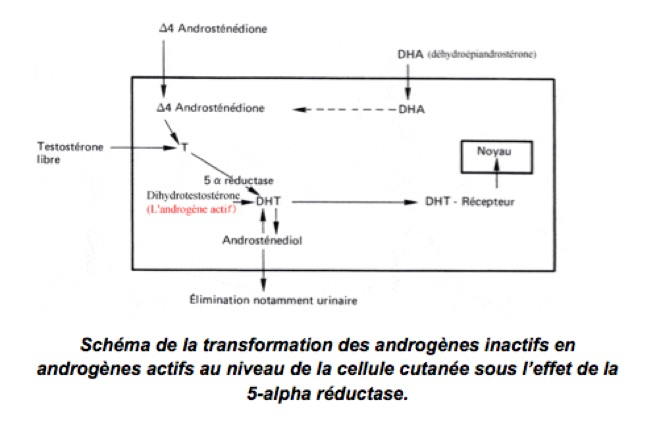
2-Le rôle des androgènes
Il existe plusieurs types d’androgènes circulants dans le sang, par ordre décroissant de concentration plasmatique: DHA, delta-4-androsténedione, testostérone, dihydrotestostérone (DHT). En particulier au niveau de la peau, seule la DHT est active sur les follicules pilosébacés, les autres devant être considérées comme des pro-hormones. Donc, au niveau de la peau, les androgènes circulants (DHA, delta-4-androsténedione, testostérone) doivent être transformés en DHT qui est la seule hormone active. Cette transformation est réalisée par une enzyme spéciale : la 5-alpha réductase.
En revanche, dans d’autres organes cibles, cutanés en particulier, des androgènes faibles comme la DHA peuvent avoir un effet hormonal important du fait de son taux circulant élevé et de son métabolisme in situ conduisant par action des pro hormones (DHA, D4 androsténedione, testostérone) à l’hormone active, la DHT. La glande sébacée semble posséder ces activités enzymatiques à des niveaux élevés.
3-On entrevoit ainsi plusieurs types de mécanismes conduisant à l’acné :
-Soit une hyperactivité de la 5-alpha réductase, comme cela se produit au moment de la puberté ou dans les acnés familiales.
-Soit une hyperproduction d’androgènes, et chez la femme les sources d’androgènes sont :
-Les ovaires qui produisent normalement une certaine quantité d’androgènes et anormalement en cas d’ovaires micropolykystiques ou de tumeurs ovariennes secrétantes (rares).
-Les glandes surrénales (blocs surrénaliens, maladie de Cushing)
-Ou certaines prises médicamenteuses dont la plus fréquente est la pilule contraceptive dont le composant progestatif a une action plus ou moins androgénique (à l’exception de la pilule Diane). Chez certaines patientes peut aussi s’observer un effet androgénique (et donc acnéique) avec les stérilets à la progestérone. Mais il faut citer aussi : les stéroïdes anabolisants.
4-facteurs aggravants
Ces facteurs sont bien connus : le stress, le tabagism, le bronzage et l’exposition à un milieu chaud et humide, certains polluants notamment chlorés et l’alimentation : les aliments à indice glycémique élevé, le lait écrémé aggravent l’acné, par contre, chocolat et charcuterie et aliments riches en lipides n’entraîneraient pas d’acné.
Bilan biologique
En général, aucun bilan n’est nécessaire pour une acné isolée avec peau grasse.
Si une tendance à l’hyperpilosité ou un hirsutisme sont observés on peut faire un dosage des androgènes . Il comporte : testostérone, delta-4 androstène dione, sulfate de DHA. En général seule la delta-4 androstène dione va être légèrement élevée. Ce bilan sert surtout à éliminer une cause tumorale qui montrerait une forte élévation de la testostérone.
En cas d’hirsutisme, Un bloc surrénalien par déficit en 21-hydroxylase peut également être mis en évidence par l’élévation du dosage de la 17-alpha-hydroxyprogestérone.
Enfin , en cas d’ovaires micropolykystiques, on aura, outre l’aspect typique des ovaires en échographie, une inversion du rapport FSH/LH.
Traitement
Les diverses Méthodes
les traitements locaux
Dans le cas d’une acné très légère, un traitement local, en gel ou en pommade, suffira : gel ou lotion pour nettoyer la peau + traitement anti-acnéique local + crème hydratante pour compenser les effets desséchants du traitement. Deux molécules au choix: le peroxyde de benzoyle ou les rétinoïdes (trétinoïne ou adapalène). Il est possible de cumuler les deux si l’amélioration à 3 mois n’est pas satisfaisante.
Les antibiotiques
Bien que l’acné ne soit pas une maladie infectieuse, beaucoup prescrivent des antibiotiques de la famille des cyclines dans le traitement de l’acné inflammatoire. La durée du traitement est limitée à trois mois en continu. Les cyclines sont contre-indiquées en association avec les antiacnéiques oraux contenant de l’isotrétinoïne et pendant la grossesse. Elles peuvent provoquer des réactions de photosensibilisation (sensibilité anormale de la peau lors d’exposition aux rayons du soleil). L’utilisation d’un écran solaire adapté est indispensable cas d’exposition au soleil pendant le traitement.
Depuis juin 2012, les médicaments contenant de la minocycline ne sont plus recommandés dans le traitement de l’acné, car ils exposent à des réactions allergiques cutanées parfois graves (éruption cutanée étendue avec fièvre et présence de ganglions enflés).
Un antibiotique de la famille des macrolides, l’érythromycine, peut également être utilisé dans le traitement de l’acné inflammatoire en cas de contre-indication à l’utilisation des cyclines.
L’isotrétinoïde
L’isotrétinoïne est un dérivé de la vitamine A qui bloque la production de sébum et possède une action anti-inflammatoire sur les follicules pileux. Elle est prescrite pour soigner les formes sévères d’acné, mais également les formes étendues ou prolongées d’acné modérée après échec des traitements usuels bien menés (c’est-à-dire suivis de manière scrupuleuse pendant au moins trois mois). L’isotrétinoïne a d’abord été commercialisée sous le nom de Roacutane®. Actuellement, seuls ses génériques sont encore commercialisés.
Les principaux effets indésirables de l’isotrétinoïne sont :
– Une aggravation transitoire de l’acné en début de traitement (appelée « acné fulminans »),
-Une sécheresse de la peau.
-En raison de graves malformations du fœtus en cas de prise pendant la grossesse, la prescription d’isotrétinoïne chez les femmes en âge de procréer est soumise à des règles très strictes : un accord de soin et de contraception doit être signé par la patiente. Elle s’engage à utiliser au moins une méthode de contraception efficace (par exemple pilule, préservatif, ou stérilet et spermicide) au moins un mois avant de débuter le traitement. La contraception doit impérativement être poursuivie pendant toute la durée du traitement et se prolonger un mois après l’arrêt de l’isotrétinoïne. La patiente reçoit un carnet-patiente qui doit être présenté à chaque consultation et au pharmacien pour obtenir le médicament.
-Prafois signes de dépression. Récemment, une étude a mis en évidence un risque plus élevé de tentative de suicide chez les personnes recevant un traitement par isotrétinoïne dans le cadre d’une acné sévère.
En France, les autorités de santé recommandent aux médecins qui prescrivent de l’isotrétinoïne de porter une attention toute particulière aux patients présentant un antécédent de dépression et, chez tous les patients, de surveiller l’apparition d’éventuels signes de dépression, même après la fin de leur traitement.
Les pilules contraceptives (à l’exception de Diane 35® et de ses génériques)
Les pilules contraceptives peuvent avoir des effets variables d’une femme à l’autre sur l’acné.
-Elles ont un effet favorable dans la mesure où elles bloquent les secrétions hormonales ovariennes et donc les secrétions d’androgènes. D’autre part l’estrogène qu’elles contiennent a un certain effet anti-androgénique.
-Elles ont un effet défavorable dans la mesure où elles ne bloquent pas l’activité de la 5-alpha réductase et où tous les progestatifs contenus dans les pilules ont un effet de type androgénique. Cet effet est certes plus ou moins puissant selon les types de progestatifs, mais il existe, contrairement aux dires de la publicité des laboratoires pharmaceutiques à ce sujet. Dans tous les cas, aucun de ces progestatifs n’a d’effet anti-androgénique (on verra plus loin l’exception de l’acétate de Cyprotérone.
Donc l’effet final va un peu dépendre de l’importance de l’acné et de son mécanisme. Il peut être favorable dans le cas d’ovaires micropolykystiques par exemple , comme il peut être sans effet ou aggravant sur l’acné en cas d’hyperfonctionnement de la 5-alpha réductase.
La pilule de Diane 35® et ses génériques
Comme toutes les pilules, la pilule Diane® contient un estrogène et un progestatif. Cette pilule a un effet anti-acnéique car son progestatif est l’acétate de cyprotérone qui est un puissant anti-androgène et qui agit en bloquant la 5-alpha réductase. Notons que cet effet anti-androgénique s’additionne à l’effet anti-androgénique de l’estrogène (etinylestradiol).
Alors comment se fait-il que Diane® (et ses génériques) n’améliore pas toujours l’acné ? C’est parce que le produit qui est actif qu’elle contient, l’acétate de cyprotérone, est trop peu dosé dans cette pilule. Rappelons que sa formule est : Ethinylestradiol 0,035mg + Acétate de Cyprotérone 2mg. Cela veut dire que Diane® va améliorer les acnés légers ou modérés mais paraitra inefficace sur des acnés sévères. En réalité elle n’est pas inefficace mais simplement insuffisamment dosée en progestatif.
L’association éthinylestradiol-cyprotérone (Diane 35® et génériques) a longtemps été autorisée comme traitement de l’acné chez la femme. En raison d’un effet contraceptif, elle était utilisée comme pilule, sans avoir d’autorisation de mise sur le marché (AMM) pour cette indication. En 2013, à la suite d’une polémique sur certaines pilules dites de 3ème génération, l’Agence française du médicament a suspendu l’autorisation de mise sur le marché de Diane 35® et de ses génériques. Tout cela sans fondement scientifique sérieux puisque cette suspension n’a concerné que la France, tous les autres pays continuant la prescription de Diane®. Cette décision s’expliquait peut-être en partie pour limiter l’utilisation non officielle comme pilule de ces médicaments. Ces médicaments ont été recommercialisés en France depuis janvier 2014, avec (enfin) la caractéristique de contraceptif, et réservés au traitement de l’acné.
Les anti-androègenes
L’acétate de cyprotérone (Androcur®)
L’acétate de cyprotérone est un progestatif de synthèse antiandrogène et antigonadotrope. Dérivé de la 17-alpha-hydroxyprogestérone, il possède avant tout une action antiandrogène. Cet effet spécifique antiandrogénique s’exerce par inhibition compétitive de la liaison de la 5-alpha-dihydrotestostérone à son récepteur cytosolique dans les cellules cibles.
Chez la femme, l’action progestative s’exerce au niveau des récepteurs mammaires et endométriaux, en particulier par une importante transformation sécrétoire de l’endomètre. Il possède également une action antigonadotrope relativement puissante (une dose de 1 mg par jour pendant 21 jours par cycle inhibe l’ovulation) mais cet effet contraceptif, bien qu’indiscutable, n’a pas d’AMM.
Les traitements hormonaux des auteurs de violences sexuelles ont été introduit suite à la constatation de l’efficacité de la castration chirurgicale des délinquants sexuels. L’acétate de cyprotérone (Androcur ®) a ainsi été d’abord utilisé dans cette indication dès fin des années 60.
L’Androcur ® existe en France sous deux formes :
-ANDROCUR 50 mg : comprimé sécable (blanc) ; boîte de 20
Sur ordonnance (Liste I) – Remboursable à 65 % – Prix : 9,25 €.
-ANDROCUR 100 mg : comprimé sécable (blanc) ; boîte de 60
Sur ordonnance (Liste I) – Remboursable à 100 % – Prix : 80,19 €.
Il possède d’autres indications comme le cancer de la prostate chez l’homme, mais dans le cadre de l’acné, on remarquera qu’un comprimé d’Androcur® à 50mg est 25 fois plus dosé qu’un comprimé de pilule Diane®. Cela explique sa remarquable efficacité sur l’acné et que l’on peut l’obtenir avec seulement ½ comprimé par jour (soit 12,5 fois plus que Diane®) voire même 1/2 comprimé un jour sur deux ce qui équivaut à 1/4 de comprimé par jour, soit 12,5mg/jour même si le fractionnement en deux d’un demi comprimé ne donne pas deux parts parfaitement équivelentes. Cela n’est pas très important dand la mesure où l’acétate de cyprotérone agit avc un certai effet retard qui «lisse» ces petites variations. On peut d’ailleurs regretter que l’Androcur 10mg qui est disponible dans certains pays n’existe pas en France !
D’autres anti-androgènes existent
mais ont des indications plus marginales car moins spectaculaires: Spironolactone,Flutamide, Progestérone naturelle, Cimétidine, oestrogènes, Finastéride, Kétoconazole.
Comment traiter ?
L’acné s’améliore plus vite si on associe au traitement prescrit par son médecin une bonne hygiène de vie sur le plan alimentaire . Le soleil, le tabac et le stress sont à éviter.
On l’a dit, dans le cas d’une acné très légère, un traitement local, en gel ou en pommade, peut suffire.
Mais chez la femme et en particulier les jeunes filles, la question de la contraception orale doit se poser et même être recommandée en cas d’acné. La prise d’antibiotiques en continu n’est pas sans inconvénient et il faut noter que la prescription de Roacutane®, outre les risques qu’elle comporte, doit s’accompagner d’une contraception, donc la pilule le plus souvent. Il est donc à la fois plus logique et plus efficace de prescrire directement un traitement de type hormonal à base d’acétate de cyprotérone. Notons que ce dernier agissant en bloquant l’action des androgènes au niveau de la peau est efficace quelle que soit l’origine de l’acné (hyperproduction d’androgènes, ou emballement de la 5-alpha réductase).
L’Androcur® seul est efficace et est contraceptif. Toutefois il n’a pas d’AMM (Autorisation de Mise sur le Marché) pour la contraception. On notera qu’il n’a pas non plus d’AMM pour le traitement de l’acné ce qui est incompréhensible. Au long cours il est préférable de lui associer un œstrogène. Les schémas classiques sont du type : 1 comprimé à 50 mg par jour pendant 20 jours par mois, en association avec un estrogènesuivi d’une pause de 7 jours.
Personnellement je préfère l’association avec une minipilule (dosée à 20 microgrammes d’ethinylestradiol), à prendre en continu avec seulement ½ comprimé d’Androcur 50®, soit 25mg/jour et même 1/4 de comprimé ou 1/2 un jour sur deux (=12,5mg/jour) ce qui donne une dose cumulée sur 1 an de 4,5 grammes. Cela à l’avantage d’ajouter un estrogène, d’assurer une contraception efficace et officielle (avec une AMM), et de supprimer les règles (ce qui est toujours une bonne chose pour peu que la patiente en soit convaincue). Bien évidemment ce type de traitement doit respecter les contre-indications classique de la pilule et de l’Androcur (méningiome préexistant). Il peut être suivi pendant un an ou deux avec un résultat visibles dès le troisième mois.
Les autres traitements, chez la femme, ne devraient être proposés qu’en cas de contre-indication au traitement hormonal ainsi décrit.
Acétate de Cyprotérone et risque de méningiome
Suite à un signal de pharmacovigilance lancé par la France à l’échelle européenne, un risque de méningiome est identifié depuis 2008 chez les femmes suivant un traitement par acétate de cyprotérone aux doses de 50 mg ou 100 mg. Un méningiome est une tumeur cérébrale produite à partir de cellules des enveloppes du cerveau et de la moelle épinière appelées les méninges. Développés en dehors du système nerveux, les méningiomes sont des tumeurs bénignes dans environ 75-80 % des cas ; plus rarement, ils peuvent se présenter sous des formes plus agressives.
Concernant ce risque, il existe une relation avec la dose totale absorbée. C’est pourquoi il est préférable de limiter la prise à 1 ou 2 ans en fonction des résultats et avec seulement 25mg/jour voire 12,5mg/jour, ce qui est largement suffisant. Le risque augmente également avec l’âge de la patiente et surtout diminue très fortement après l’arrêt du traitement.
Pour en savoir plus
Une première étude française de Sébastien Froelich en 2008 a suspecté un lien entre acétate de Cyprotérone et méningiome, sans aucune autre description dans la littérature mondiale, sur 9 patientes traitées à la dose de 50mg/jour pendant une durée allant de 10 à 20 ans: Does cyproterone acetate promote multiple meningiomas? Sebastien Froelich, Nassim Dali-Youcef, Patrick Boyer, Pierre Kehrli, Daniel Maitrot, Johan Auwerx & Jean-Louis Schlienger..: Patients and methods: We report 9 female patients (33–62 yo, mean: 46 yo) with multiple meningiomas (2 to 11) without any clinical evidence of neurofibromatosis. All patients were treated with cyproterone acetate (50 mg/day) for various indications for a time period ranging from 10 to 20 years.
Les choses ont prises une tournure plus inquiétante en 2019 suite à une étude beaucoup plus large menée par le même Sébastien Froelich à l’hôpital Lariboisière à Paris. On trouvera un peu plus loin le rapport complet de cette étude qui a porté sur 253777 femmes. Mais il en ressort les éléments suivants:
-Le risque augmente avec l’âge. En dessous de 35 ans le risque n’existe pas avec un Hazard Ratio (HR de 0,2.
-le risque dépend surtout de la dose utilisée et de sa durée, et donc surtout de la dose totale cumulée. Ainsi il apparaît dans cette étude que le risque est absent en dessous de 12 grammes d’exposition cumulée. le risque commence à apparaître et augmente pour des doses cumulées supérieures, avec un HR à 6,4 pour 12 à 36 grammes et qui monte à 11,3 pour 36 à 60grammes et 21,7 pour plus de 60 grammes de dose cumulée d’acétate de cyprotérone (soit par exemple 5 ans de traitement à 50 mg/jour 20 jours par mois).

Pour en revenir au traitement de l’acné tel que nous le préconisons, il n’a été observé aucun risque pour les doses que nous utilisons qui donnent (à 1/2cp 1 jour/2) une dose cumulée de 4,5 grammes sur un an voire 9 grammes sur deux ans. Ce type de traitement n’est prescrit que 1 ou 2 ans. On voit que même sur 2 ans on reste nettement au dessous des 12 grammes cités dans l’étude. Ce traitement est en outre généralement prescrit chez des femmes jeunes pour lesquelles le risque n’existe pas avant 35 ans.
Cela a cependant poussé l’Agence nationale de sécurité du médicament et des produits de santé à lancer une alerte et une information sans distinguer correctement les notions d’âge et de doses. On y lit notamment: «Une étude a confirmé le risque de méningiome en cas d’utilisation de ce médicament. Ce risque est multiplié par 7 au-delà de 6 mois d’utilisation d’une dose moyenne supérieure ou égale à 25 mg par jour. Il est multiplié par 20 au-delà d’une dose cumulée de 60 g, soit environ 5 ans de traitement à 50 mg par jour ou 10 ans à 25 mg par jour». Les chiffres données sont justes pour les doses supérieures à 60g. mais ils ne correspondent pas aux conclusions de l’étude pour la dose citée de 25mg sur 6 mois. En effet, cette dose représente 4,5grammes (même en cas de prise continue) or il n’y a aucun risque en dessous de 12 grammes.
De même, concernant l’âge à l’instauration du traitement, « avec la tranche d’âge 25-34 ans comme référence, le hazard ratio (HR) était de 0,2 (IC 95% 0,0-1,2) pour les moins de 25 ans ; 10,4 (4,8-22,5) pour les 45 à 54 ans et 42,3 (15,9-112,7) pour les 65 ans et plus ». On voit que le sur-risque est nul chez les femmes jeunes qui sont les plus concernées par l’acné.
En conclusion, l’acétate de cyprotérone reste un excellent traitement de l’acné rebelle chez la femme et peut être considéré sans risque de méningiome à condition:
-de le réserver aux femmes jeunes,
-de donner de doses faibles (1/2 ou 1/4 de cp. par jour) ou même 1/2cp, un jour sur 2 ce qui fait 4,5mg sur un an en continu),
-et sur une durée de 1 ou 2 ans (ce qui en pratique est généralement suffisant). Les cas de méningiomes observés concernent des patients traités pendant une durée d’exposition de 14,7 ans en moyenne.
A la dose de 1/2 comprimé un jour sur deux, en continu, on arrive à la dose cumulée de 4,5 grammes sur un an et de 9 grammes sur deux ans, ce qui reste très en dessous du seuil de 12 grammes défini par cette étude à partir duquel le risque pourrait augmenter.
Le traitement est hors AMM dans cette indication, ce qui ne constitue pas une interdiction (la pilule Diane a été prescrite pendant des années hors AMM…)
La principale contre-indication reste l’existence d’un méningiome préexistant au traitement.
Citation du Pr Froelich chef du service de neurochirurgie de l’hôpital Lariboisière à Parisqui a mené cette étude: «Plus longtemps on prend de l’Androcur à des doses importantes, plus on encourt le risque de développer un ou des méningiomes. Les patientes que j’ai été amené à voir en consultation après un diagnostic de méningiome présentaient rarement une utilisation inférieure à cinq-six ans. J’ai donc peu d’inquiétudes pour les patientes qui prennent de l’acétate de cyprotérone depuis deux, trois ou quatre ans. Il faudrait probablement, pour des durées supérieures à cinq ans, faire une IRM de contrôle».
Extraits du texte de l’étude
Le texte intégral de cette étude peut être consulté sur le site ansm.sante.fr
Exposition prolongée à de fortes doses d’acétate de cyprotérone et risque de méningiome chez la femme. Etude pharmaco-épidémiologique de cohorte à partir des données du SNDS. Juin 2019. Rapport final.
Dr Alain Weill 1,2, Benjamin Cadier 1, Dr Pierre Nguyen 2, Pr Joël Coste 1,3
1. Département des études en santé publique – Caisse nationale de l’assurance maladie
2. Groupement d’intérêt scientifique – Epidémiologie des produits de santé (GIS avec l’expertise durant le projet du Pr Sébastien Froelich (Neurochirurgie, Hôpital Lariboisière APHP, Paris), Dr Moujahed Labidi (Neurochirurgie, Hôpital Lariboisière APHP, Paris), Dr Sylvie Fontanel (ARS Grand-Est, Nancy) et Dr Emilie Sbidian (dermatologie, Hôpital Henri Mondor, APHP, Créteil et Département études en santé publique – CNAM / GIS EPIPHARE ANSM-CNAM) ANSM-CNAM) 3. Unité de Biostatistique et d’épidémiologie – Hôpital Cochin APHP, Paris
Objectifs
L’objectif principal de cette étude était d’évaluer en vie réelle l’impact de l’exposition prolongée à l’acétate de cyprotérone à forte dose chez la femme sur le risque de méningiome. Cette étude comportait plusieurs objectifs secondaires 1) Evaluer la relation dose-effet du risque de méningiome chez les patientes exposées à l’acétate de cyprotérone ; 2) Préciser l’évolution du risque de méningiome après arrêt de l’acétate de cyprotérone; 3) Décrire les caractéristiques des méningiomes sous acétate de cyprotérone (patientes concernées, localisation, prise en charge…) ; 4) Mesurer le taux d’arrêt effectif de l’acétate de cyprotérone après le diagnostic et traitement d’un méningiome ; 5) Estimer le nombre de cas de méningiomes attribuables à une exposition prolongée à l’acétate de cyprotérone en France entre 2007 et 2015.
Méthode
Il s’agit d’une étude de cohorte de type « exposé/non exposé » réalisée à partir du système national des données de santé (SNDS – anciennement dénommé SNIIRAM). Elle compare la fréquence de survenue de méningiome traité par chirurgie ou radiothérapie (évènement d’intérêt) chez les femmes âgées de 7 à 70 ans exposées à l’acétate de cyprotérone à forte dose (définie comme au moins 3 boites de 20 comprimés à 50 mg, soit 3 grammes, lors des 6 premiers mois de traitement) et chez celles ayant été très faiblement exposées (une ou deux boites lors des six premiers mois). L’étude principale sur une cohorte dite « incidente » en termes d’exposition a concerné les femmes ayant débuté l’acétate de cyprotérone (comprimés à 50 mg ou 100 mg) entre 2007 et 2014 avec un suivi jusqu’à la fin de l’année 2015. Une analyse complémentaire (sur une cohorte dite « prévalente »)2 a concerné les femmes déjà exposées à l’acétate de cyprotérone en 2006 (année la plus ancienne accessible dans le SNDS) avec un suivi jusqu’à la fin 2015.
L’évènement d’intérêt a été défini par le traitement chirurgical (exérèse ou décompression) ou par radiothérapie en hospitalisation d’un méningiome intracrânien. Les comparaisons ont été faites à partir de modèles de Cox à risques proportionnels comparant l’incidence d’événements entre les
différents groupes (exposé, très faiblement exposé pour l’analyse principale, et, exposé, très faiblement exposé et arrêt pour l’analyse de sensibilité). Un ajustement sur les caractéristiques des femmes à l’inclusion (âge, CMUc, spécialité du prescripteur initial, contexte de prescription, œstrogènes associés), a été réalisé en ne conservant que celles ayant un effet indépendant. La dose cumulée d’acétate de cyprotérone et l’âge ont été traités comme des variables dépendantes du temps.
Résultats
Population d’étude
L’instauration d’acétate de cyprotérone entre le 1er janvier 2007 et le 31 décembre 2014 a concerné 279 678 femmes. Après exclusion des patientes de moins de 7 ans (n=487) ou de plus de 70 ans (n=1 259), des patientes en affection de longue durée (ALD) (tous motifs confondus) (n= 24 057), des patientes avec antécédent de méningiome ou de tumeur bénigne du cerveau (n=76) et des patientes décédées (n=22) avant le début du suivi (6 mois après la première délivrance d’acétate de cyprotérone), 253 777 femmes ont été incluses dans l’étude principale dont 139 222 (54,9%) dans le groupe «exposé» et 114555 (45,1%) dans le groupe contrôle «très faiblement exposé». A l’inclusion les femmes avaient un âge médian de 27 ans (Q1-Q3 : 21-37). Le prescripteur initial était un médecin libéral dans 97% des cas : gynécologue dans plus de la moitié des cas (56,7%), plus rarement dermatologue (11,5%), endocrinologue (10,1%) ou généraliste (18,3%). La part des femmes traitées pour hirsutisme probable (13%) était faible même si cette caractérisation de ces femmes était incertaine. Dans l’ensemble, la population « exposée » était très similaire à celle « très faiblement exposée ». Les femmes du groupe « exposé » étaient socialement un peu moins défavorisées (CMUc 6,5% versus 8,2%), un peu plus jeunes – moins de 25 ans pour 42,0% versus 37,7%, plus souvent suivies par un endocrinologue (13,1% versus 6,4%) et moins souvent par un dermatologue (9,3% versus 14,3%). En revanche, dans les deux groupes l’instauration des traitements relevait principalement de gynécologues (55,9% versus 57,8%).
Risque de méningiome associé à la prise d’acétate de cyprotérone, mesure de la relation dose-effet et impact de l’arrêt de l’AC
Comme attendu, l’âge à l’instauration du traitement était fortement lié au risque de méningiome. Avec la tranche d’âge 25-34 ans comme référence, le hazard ratio (HR) était de 0,2 (IC 95% 0,0-1,2) pour les moins de 25 ans ; 10,4 (4,8-22,5) pour les 45 à 54 ans et 42,3 (15,9-112,7) pour les 65 ans et plus. Compte tenu de l’effet majeur de l’âge sur le risque de méningiome, les autres variables ont été testées après un ajustement sur l’âge. La CMUc, le contexte de prescription médicale et la spécialité du prescripteur, n’étaient pas associés au risque de méningiome. En revanche une prescription simultanée d’œstrogène était associée de façon significative au risque de méningiome avec un HR ajusté sur l’âge = 1,6 (1,1-2,4).
Dans le groupe « exposé » et dans le groupe « très faiblement exposé » les nombres de femmes hospitalisées pour un méningiome traité (chirurgie dans 97% des cas) ont été respectivement de 69 et 20. Les taux d’incidence (risque absolu) dans les deux groupes étaient respectivement de 23,8 et 4,5 pour 100 000 personnes-années, soit un risque relatif brut de 5,2 [3,2-8,6] et un HR ajusté sur l’âge et les œstrogènes de 6,6 [4,0-11,1] pour l’exposition à l’acétate de cyprotérone.
L’analyse selon la dose cumulée d’acétate de cyprotérone montrait une forte relation dose-effet ; plus la dose cumulée était importante, plus le risque de méningiome était élevé. Le taux d’incidence atteignait ainsi près de 130 cas pour 100 000 personnes-années dans le groupe avec une exposition cumulée de plus de 60 g, soit un risque relatif brut de 28,4 [14,5-55,5]. Les HR, ajustés sur l’âge et les œstrogènes, n’étaient pas significativement différents de 1 en dessous d’une exposition cumulée de 12 grammes d’acétate de cyprotérone (qui correspondait au maximum à un an de traitement à 50 mg/jour 20 jours par mois). Au-delà, le risque croissait fortement avec la dose cumulée : HR = 6,4 [3,6-11,5] pour 12 à 36 grammes, 11,3 [5,8-22,2] pour 36 à 60 grammes et 21,7 [10,8-43,5] pour plus de 60 grammes de dose cumulée d’acétate de cyprotérone (qui correspondent à 5 ans de traitement à 50 mg/jour 20 jours par mois).
Après une année d’arrêt de prise d’acétate de cyprotérone, le risque de méningiome était 1,8 fois [1,0-3,2] supérieur au risque de survenue de méningiome en cas de très faible exposition. Le risque était 4,2 fois [2,2-8,0] supérieur quand la dose cumulée d’acétate de cyprotérone avant l’arrêt avait atteint 12 grammes et plus.
Chez les femmes déjà exposées en 2006 à l’acétate de cyprotérone (cohorte «prévalente» comprenant 131 485 femmes), nous avons observé, chez les exposées à au moins 3 grammes après 2006, 485 cas de méningiomes traités en hospitalisation par chirurgie ou radiothérapie. Dans cette cohorte le taux d’incidence (risque absolu) atteignait 133 pour 100 000 femmes-années. A partir d’une dose cumulée après 2006 de 60 grammes d’acétate de cyprotérone le taux d’incidence atteignait 387 pour 100 000, soit environ 4 cas pour 1000 femmes-années. C’est dans ce dernier groupe que se trouvaient les femmes exposées durant une très longue durée à de fortes doses, 15 à 30 ans par exemple, sans qu’il soit possible de déterminer de façon individuelle le début de l’exposition et la dose cumulée totale car les informations antérieures à 2006 ne sont pas disponibles dans le SNDS.
…/…
La majorité des méningiomes surviendrait, si l’on en croit les séries de cas publiées, après 10 à 30 ans d’exposition à l’acétate de cyprotérone.
…/…
Conclusion
Plus de 400 000 femmes ont consommé en France de l’acétate de cyprotérone à forte dose entre 2006 et 2015, dont une grande partie « hors AMM ». Il existait, chez ces femmes, une forte association entre l’exposition à l’acétate de cyprotérone et le traitement invasif (chirurgie ou radiothérapie) d’un méningiome avec un risque multiplié par 7.
Il existait également une puissante relation dose-effet avec un risque multiplié par plus de 20 au-delà d’une exposition cumulée de 60 grammes commencée entre 2007 et 2014 (soit par exemple 5 ans de traitement à 50 mg / jour 20 jours par mois) et un risque multiplié par 30 pour cette même exposition si le traitement était déjà en cours en 2006 ; le risque absolu atteignait 4 pour 1000 femmes-années pour ces femmes les plus exposées.
Le risque de méningiome diminuait nettement après l’arrêt du traitement pendant une année sur le suivi disponible. En France, le nombre de cas de méningiomes traités attribuables à l’exposition à l’acétate de cyprotérone à forte dose a été supérieur à 500 entre 2007 et 2015.